不同基因型普通白菜对铬胁迫的生理响应及铬吸收差异
2012-08-08吕金印李鹰翔孙惠莉
吕金印 齐 君 王 帅 李鹰翔 孙惠莉
(1西北农林科技大学生命科学学院,陕西杨凌 712100;2西北农林科技大学理学院,陕西杨凌712100)
随着我国工业生产的快速发展,含铬(Cr3+)废水废渣的排出逐年增加,导致土壤、水体和生物受到不同程度的污染。作物受Cr3+污染后,生长发育滞后,产量降低,甚至死亡(Bini et al.,2008;王爱云 等,2011)。Cr3+进入食物链,对人体健康造成危害。因此,筛选Cr3+低积累作物品种显得较为重要和迫切。普通白菜〔Brassica campestrisL.ssp.chinensis(L.)Makino var.communisTsen et Lee〕是我国广泛种植的大宗叶菜之一,对土壤环境中Zn、Cu、Pb有一定的富集能力,且品种间存在显著差异(任安芝和高玉葆,2000,胡学玉 等,2002;于光金 等2009)。铬对绿豆、黄瓜和油菜生长的影响已有报道(郭峰,2006;陈庆华,2009;沈奇 等,2009),但铬处理下普通白菜对重金属的吸收及生理变化鲜有报道。本试验选用 6个普通白菜品种,测定铬处理下不同基因型普通白菜对铬的吸收积累及生理变化,探讨普通白菜在铬处理下的生理响应,为普通白菜品种选育及无害化栽培提供依据。
1 材料与方法
1.1 试验材料
供试普通白菜品种为矮抗青、绿秀、五月慢、七宝青、鸡毛菜和黄心菜。其中矮抗青、五月慢、鸡毛菜、黄心菜种子购自陕西杨凌西北农林科技大学农城种业科技中心,绿秀种子购自青岛国际种苗有限公司,七宝青种子购自南京苏豪种业有限公司。
1.2 试验方法
试验于2011年4月在西北农林科技大学生命科学学院网室内进行。取大田耕层土壤,经室温风干后过5 mm筛。土壤有机质含量1.14%,速效氮85.94 mg·kg-1,速效磷40.01 mg·kg-1,速效钾81.34 mg·kg-1,总铬28.03 mg·kg-1,pH=8.3。以溶液态施入分析纯CrCl3,制成全铬含量为 90、150、200、250 mg·kg-1的污染土壤,其中最高浓度是参照国家土壤环境质量标准(GB15618-1995)中的二级标准。以不施铬为对照。室温放置20 d后装盆(上口径20.6 cm,下口径10.4 cm,高13.9 cm),每盆装2.3 kg干土。将6个普通白菜品种分别播于盆中,每盆15粒,20 d后间苗至8株。每品种3次重复。培养期间,根据普通白菜生长需要正常水肥管理。生长40 d后收集全部植株,先用自来水冲净表面污物,将地上部和地下部分开,用于测定各项指标。
1.3 测定项目
1.3.1 土壤基础养分测定 栽种前采用棋盘法收集土壤样品,土壤 pH测定采用电位法(水∶土=2.5∶1);有机质含量测定采用重铬酸钾滴定法;速效氮含量测定采用0.01 mol·L-1NaCl浸提、酚二磺酸比色法;速效磷含量测定采用0.5 mol·L-1NaHCO3浸提、钼锑抗比色法;速效钾含量测定采用1.0 mol·L-1NH4OAc浸提、火焰光度法;总铬含量测定采用HNO3-HClO4联合消化、原子吸收分光光度计(柳铃 等,2010)。
1.3.2 生物量测定 分别取地上部和地下部植株,105 ℃杀青 10 min,80 ℃烘干至恒质量,测定地上部和地下部干质量。
1.3.3 铬含量测定 分别取地上部和地下部植株,自来水浸泡10 h,除去根系表面Cr3+。离子水冲洗,吸干水分,105 ℃杀青15 min,80 ℃烘干至恒质量,磨碎混匀,加入 HNO3-HCLO4(4V∶1V)混合酸,220 ℃沙浴消解至透明色,用火焰原子吸收分光光度计(Perkin Elmer AA180-80)测定铬含量(孙守琴 等,2009;Liu et al.,2009)。
1.3.4 叶绿素、丙二醛、可溶性蛋白含量测定 用剪刀采集叶片鲜样,每个样品 0.5 g。叶绿素含量测定采用80%丙酮浸提法;丙二醛含量测定采用TBA比色法;可溶性蛋白含量测定采用考马斯亮蓝G-250法(高俊凤,2006)。
1.3.5 过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、过氧化物酶(POD)活性测定 酶液提取:分别称取叶片0.5 g,加入磷酸缓冲液(pH=7.5),冰浴研磨,4 ℃下离心(4000 r·min-1)15 min,上清液即为粗酶提取液。CAT活性采用紫外吸收法测定;SOD活性采用氮蓝四唑(NBT)比色法测定;POD活性采用愈创木酚比色法测定(高俊凤,2006;孙群和胡景江,2006)。
各项指标测定均为3次重复,结果以平均值±标准差表示,采用SPSS 17.0软件进行统计分析。
2 结果与分析
2.1 铬处理对不同基因型普通白菜生物量的影响
由表1可知,随着铬浓度增加,6个普通白菜品种生物量均呈下降趋势。低浓度Cr3+(90 mg·kg-1)处理下,6个普通白菜品种的生物量与对照相比下降均不显著。高浓度Cr3+(250 mg·kg-1)处理下,黄心菜、矮抗青、五月慢、绿秀及七宝青的生物量与对照相比显著下降,其中黄心菜、七宝青下降尤为明显,分别比对照下降了58.0%和48.8%;鸡毛菜下降幅度较小,比对照下降了34.0%。说明铬胁迫会降低普通白菜的生物量,对鸡毛菜的影响较小,而黄心菜、矮抗青、五月慢、绿秀及七宝青的生物量均显著降低。
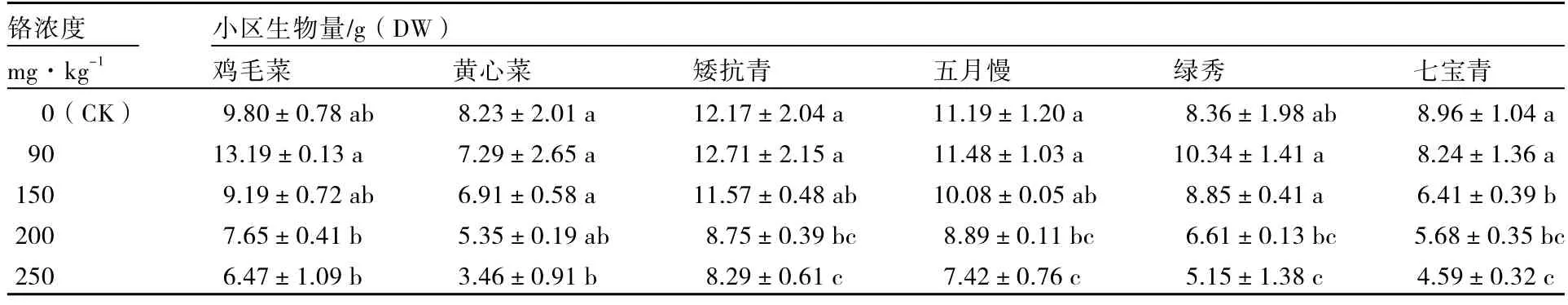
表1 不同浓度铬处理对不同基因型普通白菜生物量的影响
2.2 铬处理对不同基因型普通白菜铬吸收量的影响
由表2可知,低浓度Cr3+(90 mg·kg-1)处理下,矮抗青、鸡毛菜、五月慢、七宝青地上部铬含量与对照相比下降,而黄心菜和绿秀略有增加;6个普通白菜品种地下部铬含量均显著增加。高浓度Cr3+(250 mg·kg-1)处理下,6个普通白菜品种地上部和地下部铬含量大体上均显著增加,其中地下部铬含量增幅较大。说明高浓度Cr3+处理对普通白菜的根部伤害较大。
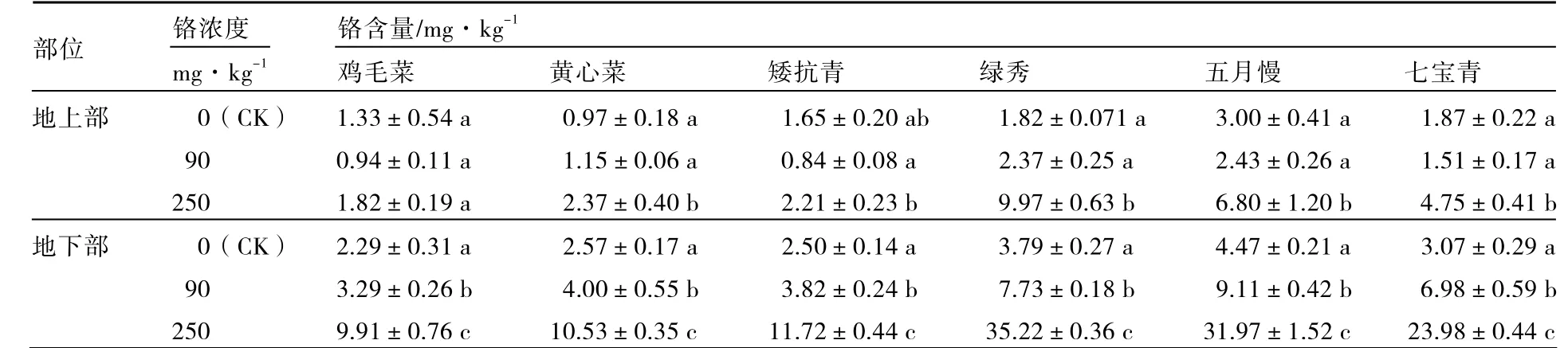
表2 不同浓度铬处理对不同基因型普通白菜地上部、地下部铬含量的影响
由图1可以看出,6个基因型普通白菜的铬转移率均随着铬浓度的增加而降低。高浓度Cr3+(250 mg·kg-1)处理下,鸡毛菜和矮抗青的铬转移率分别为0.18和0.19,低于绿秀(0.28)。表明在铬处理下,鸡毛菜和矮抗青根部滞留铬较多,向地上部转运较少;而绿秀向地上部转运相对较多。
2.3 铬处理对不同基因型普通白菜叶绿素含量的影响
由图 2可以看出,随着铬浓度的增加,普通白菜叶片叶绿素含量呈降低趋势。低浓度 Cr3+(90 mg·kg-1)处理下,鸡毛菜、五月慢和绿秀的叶绿素含量与对照相比增加。高浓度Cr3+(250 mg·kg-1)处理下,黄心菜和七宝青的叶绿素含量分别比对照下降了 38.5%和41.9%。这可能是铬处理下光合作用减弱,叶绿体结构和功能受到影响,导致叶绿素分解。
2.4 铬处理对不同基因型普通白菜丙二醛含量的影响
丙二醛可作为植物在逆境下细胞膜脂过氧化程度的指标。由图3可知,随着铬处理浓度的增加,6个基因型普通白菜叶片丙二醛含量呈增加趋势。高浓度 Cr3+(250 mg·kg-1)处理下,鸡毛菜、黄心菜、矮抗青的丙二醛含量分别是对照的1.86、1.59、1.51倍,而五月慢、绿秀、七宝青分别是对照的2.15、2.25、2.58倍。表明鸡毛菜、黄心菜、矮抗青的耐铬胁迫能力较强。
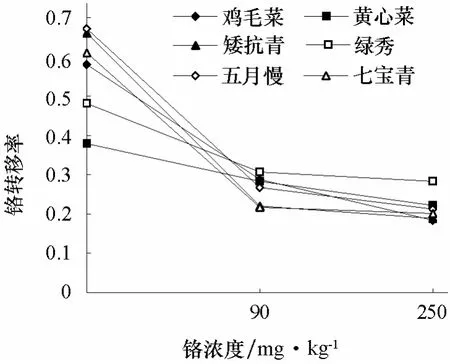
图1 不同浓度铬处理对不同基因型普通白菜铬转移率的影响
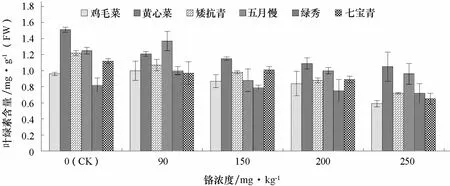
图2 不同浓度铬处理对不同基因型普通白菜叶片叶绿素含量的影响
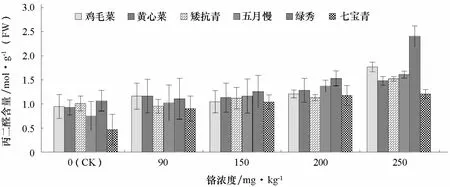
图3 不同浓度铬处理对不同基因型普通白菜叶片丙二醛含量的影响
2.5 铬处理对不同基因型普通白菜可溶性蛋白含量的影响
随着铬浓度的增加,普通白菜叶片可溶性蛋白含量呈先增后降的趋势(图 4)。低浓度 Cr3+(90 mg·kg-1)处理下,叶片可溶性蛋白含量增加,而高浓度(250 mg·kg-1)Cr3+处理则下降。中浓度Cr3+(150 mg·kg-1)处理下,鸡毛菜和黄心菜的可溶性蛋白含量下降明显,分别比对照降低了20.5%和36.3%。高浓度Cr3+(250 mg·kg-1)处理下,黄心菜和七宝青的可溶性蛋白含量降幅明显,分别比对照下降了28.6%和25.5%,而矮抗青和鸡毛菜分别比对照下降了16.9%和23.0%。
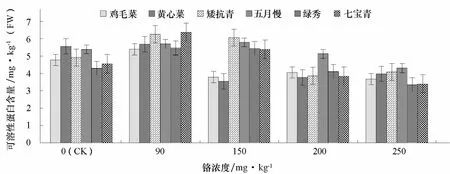
图4 不同浓度铬处理对不同基因型普通白菜叶片可溶性蛋白含量的影响
2.6 铬处理对不同基因型普通白菜抗氧化酶活性的影响
SOD、CAT、POD是植物体内清除活性氧重要的细胞保护酶类,其活性高低可以反映植物对逆境胁迫的适应能力(邹清成 等,2011)。由图5可以看出,6个基因型普通白菜叶片POD、SOD、CAT活性随着铬浓度的增加呈先升后降的趋势。高浓度Cr3+(250 mg·kg-1)处理下,绿秀、七宝青、五月慢POD活性分别比对照增加了 17.4%、9.2%、18.9%,SOD活性分别比对照增加了14.4%、12.6%、0.69%;而鸡毛菜、黄心菜、矮抗青POD活性分别比对照增加了31.7%、29.3%、33.2%,SOD活性分别比对照增加了28.1%、18.2%、24.1%。中浓度Cr3+(200 mg·kg-1)处理下,鸡毛菜、黄心菜、矮抗青、五月慢的CAT活性达到最高值,而绿秀、七宝青在150 mg·kg-1处理时达到最高值并开始下降。说明铬胁迫下鸡毛菜、黄心菜、矮抗青具有相对较高抗氧化酶活性,清除活性氧能力较强。
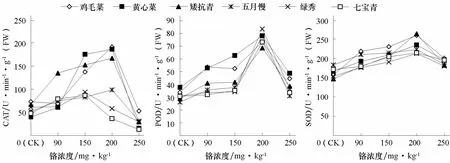
图5 不同浓度铬处理对不同基因型普通白菜叶片CAT、POD、SOD活性的影响
3 结论与讨论
铬对植物生长发育产生影响(Han et al.,2004),导致植物生理代谢紊乱,抑制正常生长。植物茎叶干物质可作为筛选对重金属耐性的指标之一。本试验中,低浓度铬处理普通白菜的生物量与对照相比没有显著影响,但高浓度的铬会明显降低普通白菜的生物量。这与王爱云等(2011)对芥菜型油菜在铬胁迫下的研究结果相符。可能高浓度铬抑制植物根细胞分化,阻碍水分吸收,从而导致植株矮小,叶片泛黄,叶面积减少,生物量降低(Dixit et al.,2002;Suseela et al.,2002;Shanker et al.,2004)。随着铬浓度的增加,黄心菜和七宝青生物量下降显著,而鸡毛菜、矮抗青则下降较少,可以推测鸡毛菜和矮抗青具有较强的铬耐受力。
转移率是反映植株富集重金属能力的指标之一,转移率低表明植株地上部分的富集量少。本试验中,鸡毛菜和矮抗青在高浓度铬胁迫下的铬转移率低于其他基因型普通白菜,表明鸡毛菜和矮抗青的地上部铬积累量相对较少。
丙二醛作为膜脂过氧化的产物(周希琴和吉前华,2005),其在机体内的积累会对细胞产生毒害作用,可作为膜脂过氧化程度的指标之一。随着铬浓度的增加,6个基因型普通白菜叶片丙二醛含量都逐渐增加。铬胁迫可促进植株体内活性氧的产生,启动膜脂过氧化,导致丙二醛积累,引起活性氧代谢平衡失调而最终破坏生物膜结构。本试验中,高浓度Cr3+(250 mg·kg-1)处理下,鸡毛菜、黄心菜和矮抗青的丙二醛含量增幅小于五月慢、绿秀和七宝青。表明鸡毛菜、黄心菜和矮抗青具有相对较高的抗氧化能力。
一般认为,重金属胁迫影响植物体内蛋白质代谢(柳玲 等,2010)。本试验中,高浓度Cr3+处理下,黄心菜和七宝青可溶性蛋白含量下降幅度大,而矮抗青和鸡毛菜可溶性蛋白含量下降幅度则相对较小,表明铬胁迫对矮抗青和鸡毛菜的影响相对较小。
叶绿素含量的高低在一定程度上反映光合作用水平。高浓度铬处理下,黄心菜和七宝青的叶绿素含量下降明显,可能是重金属抑制叶绿体色素生物合成及光合电子传递,导致叶绿素含量减少(何冰 等,2009)。
植物对逆境的生理响应与体内的抗氧化防御系统密切相关(陈茂铨和刘术新,2011)。有研究指出,镉胁迫下不同基因型的番茄幼苗抗氧化酶的生理活性存在差异(张微 等,2010)。黄永杰等(2009)通过水培试验研究不同浓度铜胁迫下水花生生长特性和体内生理特性的变化规律,结果表明低浓度铜处理下植物细胞内的SOD、POD和CAT活性均有所提高,高浓度铜处理下则有所下降。本试验中,随着Cr3+浓度的增加,6个基因型普通白菜POD、SOD、CAT活性均先升后降。低浓度 Cr3+处理下,SOD活性呈上升趋势,可能是由于铬刺激了植物体本身存在的SOD或者诱导合成新的SOD,而POD为清除过多的H2O2与SOD起协同保护作用(Vannini et al.,2006),以延缓活性氧的积累和降低铬胁迫造成的伤害。POD活性升高可能是铬胁迫导致 H2O2等POD底物增加。高浓度Cr3+(250 mg·kg-1)处理下,绿秀、七宝青、五月慢POD和SOD 活性增幅低于鸡毛菜、黄心菜和矮抗青,表明鸡毛菜、黄心菜、矮抗青脂质过氧化程度低,具有相对较高的抗氧化能力。
蔬菜对重金属的吸收积累存在基因型差异的普遍性,有选择的种植重金属低积累品种,对蔬菜无害化栽培具有重要的意义。本试验选用的 6个普通白菜品种中,鸡毛菜、矮抗青在高浓度铬处理下,生物量下降幅度低于五月慢、七宝青、黄心菜及绿秀;铬转移率低,地上部铬积累相对较少;丙二醛含量相对较低;抗氧化酶 POD、SOD、CAT活性较强,具有较好的抗氧化能力,属于铬低积累品种,适宜在生产中推广。
陈茂铨,刘术新.2011.Spd浸种对Cd胁迫下油菜幼苗的抗氧化系统的影响.农业环境科学学报,30(10):1953-1957.
陈庆华.2009.铬胁迫对黄瓜种子萌发及某些生理生化指标的影响.湖北农业科学,48(6):1402-1405.
高俊凤.2006.植物生理实验指导.北京:高等教育出版社.
郭峰.2006.重金属Hg、Pb、Cr单一污染对绿豆生理生化指标的影响.山西农业大学学报,26(3):382-387.
何冰,何计兴,何新华,李峰,韦泓明,蔡春波.2009.铅胁迫对杨梅生理特性的影响.农业环境科学学报,28(6):1263-1268.
胡学玉,李学垣,谢振翅.2002.不同青菜品种吸锌能力差异及与根系分泌物的关系.植物营养与肥料,8(2):234-238.
黄永杰,杨红飞,杨集辉,王晓兰,周守标.2009.铜胁迫对水花生生长及活性氧代谢的影响.生态学杂志,28(6):1112-1116.
柳玲,吕金印,张微.2010.不同浓度Cr6+处理下芹菜的铬累积量及生理特性.核农学报,24(3):639-644.
任安芝,高玉葆.2000.铅、镉、铬单一和复合污染对青菜种子萌发的生物学效应.生态学杂志,19(1):19-22.
沈奇,秦信蓉,张敏琴,郭贵敏,杜才富.2009.铬胁迫对油菜种子萌发及幼苗生长的毒性效应.贵州农业科学,37(10):25-26.
孙群,胡景江.2006.植物生理研究技术.杨凌:西北农林科技大学出版社:168-170,176-178.
孙守琴,何明,曹同,程颂,宋洪涛.2009.Pb、Ni胁迫对大羽藓抗氧化酶系统的影响.应用生态学报,20(4):937-942.
王爱云,钟国锋,徐刚标,刘志祥,申响保.2011.铬胁迫对芥菜型油菜生理特性和铬富集的影响.环境科学,32(6):1717-1725.
于光金,成杰民,姜琪,徐淑新.2009.不同土壤施铜对小白菜生物效应及吸收能力的研究.资源环境与发展,(4):22-25.
张微,吕金印,柳玲.2010.不同基因型番茄幼苗对镉胁迫的生理响应及镉吸收差异.农业环境科学学报,29(6):1065-1071.
周希琴,吉前华.2005.铬胁迫下不同品种玉米种子和幼苗的反应及其与铬积累的关系.生态学杂志,24(9):1048-1052.
邹清成,朱开元,刘慧春,周江华,马广莹.2011.外源茉莉酸甲酯对非生物胁迫下蝴蝶兰幼苗叶绿素荧光和抗氧化指标的影响.植物生理学报,47(9):913-917.
Bini C,Maleci L,Romanin A.2008.The chromium issue in soils of the leather tannery district in Italy.J Geochem Explor,96:194-202.
Dixit V,Pandey V,Shyam R.2002.Chromiumions inactivate electron transport and enhance superoxide generationin vivoin pea(Pisum sativumL. cv. Azad)root mitochondria.Plant,Cell & Environment,25(5):687-693.
Han F X,Maruthi S B B,Monts D L,Su Y.2003.Phytoavailability and toxicity of trivalent and hexavalent chromium toBrassica juncea.New Phytol,162:489-499.
Liu W T,Zhou Q X,Sun Y B,Liu R.2009.Identification of Chinese cabbage genotypes with low cadmium accumulation for food safety.Environ Pollut,157:1961-1967.
Shanker A K,Djanaguiraman M,Sudhagar R,Chandrashekar C N,Pathmanabhan G.2004.Differential antioxidative response of ascorbate glutathione pathway enzymes and metabolites to chromium speciation stress in green gram〔Vigna radiata(L.)R.Wilczek.cv CO 4〕roots.Plant Science,166(4):1035-1043.
Suseela M R,Sinha S,Singh S,Saxena R.2002.Accumulation of chromium and scanning electron microscopic studies inScirpus lacustrisL.treated with metal and tannery effluent.Bulletin of Environmental Contamination and Toxicology,68(4):540-548.
Vannini C,Iriti M,Bracale M,Locatelli F,Faoro F,Croce P,Pirona R,di Maro A,Coraggio I,Genga A.2006.The ectopic expression of the riceOsmyb4gene in Arabidopsis increases tolerance to abiotic,environmental and biotic stresses.Physiological and Molecular Plant Pathology,69(1-3):26-42.
Wu F Y,Leng H M,Wu S C,Ye Z H,Wang M H.2009.Variation in arsenic,lead and zinc tolerance and accumulation in six populations ofPteris vittataL.from China.Enviromental Pollution,157:2394-2404.
