用HPLC-ESI-IT-MSn法研究庆大霉素C1a的杂质谱
2012-08-06袁耀佐
杨 昊,袁耀佐,赵 恂,谭 力,张 玫,钱 文
江苏省食品药品检验所,南京 210009
临床上使用的庆大霉素(Gentamicin,GM)是由小单孢菌属发酵产生的一组结构相近的、多组分的氨基糖苷类抗生素,以 C 族复合物(C1、C2、C1a、C2a)为主,图1为庆大霉素及其部分杂质的化学结构式[1]。由于它们在化学结构上的差异,故生物活性和毒性不相同。C1毒副作用小,不易耐药,但疗效不如C2和C1a,而C2和C1a虽疗效高,但毒性大且易耐药[2]。赵敏等[3]的研究,以庆大霉素 C1a(GMC1a)为母核,经半合成改造,得到另一个新抗生素——依替米星(Etimicin,ETM)。该药具有抗菌活性强、疗效好、毒性低、抗耐药菌等优点,已被《中国药典》收载。工业化生产ETM需要大量高纯度低价格的GMC1a,为此,赵敏等[4]利用紫外光和氯化锂复合因子处理小诺霉素产生菌棘孢小单孢菌JIM-401,获得一发酵产生庆大霉素C1a单一组分的突变株JIM-202,又通过推理育种技术[5],获得庆大霉素C1a单组分高产菌,并在生产中得到应用。

图1 庆大霉素及部分杂质的分子结构
杂质谱(impurity profile)的分析,即分析样品中杂质结构和含量的分布情况,在原料药中的应用越来越广泛[6],但在中间体中的应用鲜见,作者在研究依替米星的杂质谱时发现,不同来源庆大霉素C1a合成的依替米星,杂质谱不同,有时还有较大的差异,甚至可能产生含量较大的新杂质,其安全性如何在临床上没有得到验证,直接给产品带来安全隐患。从全面质量管理的理念而言,有必要对庆大霉素C1a的杂质谱进行系统的研究。
随LC-MS联用技术的成熟,LC-MSn在氨基糖苷类抗生素杂质结构分析中应用报道很多[7-9],因氨基糖苷类抗生素极性很大,在反相色谱柱上不保留,文献中大多采用在流动相添加多氟有机酸改善色谱保留,而氟有机酸影响质谱的离子化效率,尤其是当采用电喷雾离子源时,正离子的形成几乎是不可能的,早期的文献中,消除离子抑制效率主要采用TFAfix技术[10],即根据实际情况在柱后添加挥发性小于多氟有机酸的其他有机酸,由于在柱后添加需要增加泵系统,比较费事,后来部分实验采用在流动相直接添加低挥发性有机酸或通过用氨水调节流动相pH至2.0的办法。Grahek[1]在研究庆大霉素杂质谱时还发现,采用APCI源代替ESI源,可以使灵敏度得到明显提高。上述方法在一定程度上解决了氨基糖苷类抗生素的色谱分离和质谱检测之间的矛盾,但在质谱仪中会有大量的多氟有机酸残留,给质谱仪的维护带来困难,长期使用,会大大降低仪器检测灵敏度,为此,作者在文献基础上[11],采用宽pH范围的色谱柱,在高pH值的流动相中,分离氨基糖苷类抗生素,用质谱检测器进行检测,并采用多级质谱对杂质的结构进行分析,成功地分析了依替米星[12]、小诺霉素[13]、奈替米星、西索米星的杂质谱,该方法在国内外均为首次报道。
本文是在文献方法的基础上,建立了用于庆大霉素C1a杂质谱研究的HPLC-ESI-IT-MSn方法,从庆大霉素C1a样品中共检出13个杂质,采用与杂质对照品比对色谱保留时间、一级质谱、二级质谱的方法,对2个杂质的结构进行了确证;利用已经总结出来的氨基糖苷类抗生素的特征裂解碎片离子和质谱裂解规律[12-13],根据一级、二级质谱信息,对另外12个杂质结构进行推定。
1 材 料
1.1 仪器与试剂
Agilent 1100 LC/MSD Trap液质联用仪 (美国Agilent公司)。
庆大霉素C1a(常州方圆制药有限公司);庆大霉素、依替米星、小诺霉素等对照品(中国药品生物制品检定所);甲醇为色谱纯;其余均为分析纯。
1.2 色谱与质谱条件
色谱柱:Gemini NX C18(4.6 mm×150 mm,5 μm,美国 Phenomnex 公司);流动相:[水-氨水-冰醋酸(96∶3.6∶0.4)]-甲醇(85∶15);流速:1 mL·min-1;柱温:35℃;进样量:20μL;柱后分流比:7∶3。
离子源:ESI源;离子源温度:350℃;雾化室压力:275.8 kPa;干燥气流速:10 L·min-1;离子扫描范围:100~900 m/z;正离子方式检测。
2 方法与结果
2.1 庆大霉素C1a的LC-MS分析
取庆大霉素C1a适量,用水溶解并稀释制成含庆大霉素C1a约5 mg·mL-1的溶液,进行一级质谱全扫描(Full scan)和二级质谱离子全扫描(Full scan-MS2)。 图 2为 LC-MS的总离子流图(TIC);表 1为庆大霉素C1a及其主要杂质的色谱保留时间及对应的一、二级质谱数据。
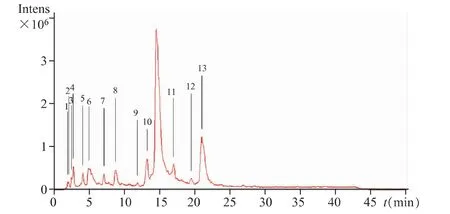
图2 庆大霉素C1a的LC-MS(TIC)图

表1 庆大霉素C1a及主要杂质LC-MS测定数据
2.2 杂质的结构推定
杂质1的[M+H]+m/z 469,与庆大霉素A的分子量吻合 (MW 468),其二级质谱为 [M+H]+m/z 451、420、366、348、324、308、205、187、163、146, 用庆大霉素A的结构解析,各碎片离子均能得到合理解释,裂解途径如图3所示。郑卫等[14]报道小单孢菌FM-203能产生庆大霉素A组分,旁证结构推定的合理性,表明杂质1为庆大霉素A。

图3 杂质1(庆大霉素A)二级质谱可能的裂解途径
杂质2的[M+H]+m/z 468,其二级质谱为[M+H]+m/z 450、419、365、347、323、308、205、187、163、146,其分子量比庆大霉素A少1 Da,与庆大霉素A二级质谱对应离子比较,碎片离子m/z 348、308、205、187、163、146 完全相同, 碎片离子 m/z 450、419、365、347、323少1 Da,可见,杂质2具有庆大霉素A的B+C环结构,但A环结构中某个羟基应被氨基替换,可能的结构如图4所示。

图4 杂质2二级质谱可能的裂解途径
杂质3的[M+H]+m/z 322,与庆大霉素C1a脱去A环得到的降解产物(B+C环)的加氢离子的质荷比吻合,提示该组分为庆大霉素C1a失去A环的降解物,即加洛糖胺(garamine),其二级质谱为[M+H]+m/z 205、187、163、160、142、129、112,各碎片离子均能得到合理解释,裂解途径如图5所示,证明杂质3为加洛糖胺。

图5 杂质3(加洛糖胺)二级质谱可能的裂解途径
杂质4的[M+H]+m/z 483,与庆大霉素B的分子量吻合,其二级质谱为[M+H]+m/z 434、366、348、324、323、322、307、255、228、189、163、144, 各 碎 片离子均能得到合理解释,裂解途径如图6所示,黎俊等[15]发现庆大霉素C1a的产生菌(棘孢小单孢菌)可以产生庆大霉素B,旁证该结构推定的合理性,即杂质4为庆大霉素B。
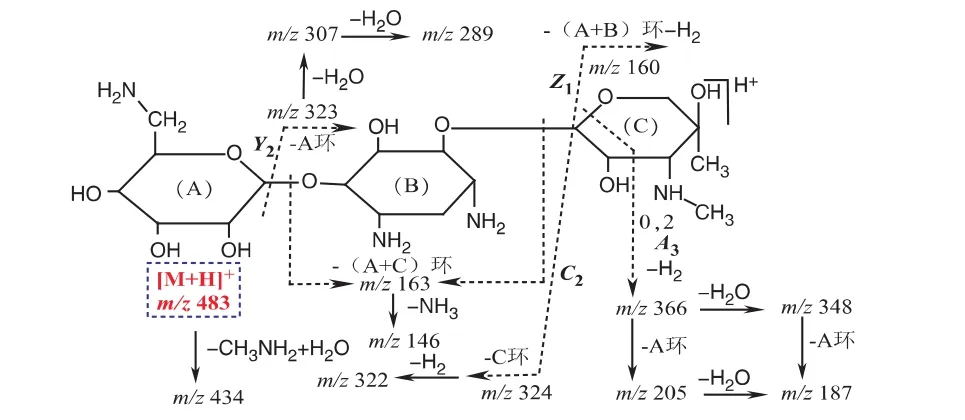
图6 杂质4(庆大霉素B)二级质谱可能的裂解途径
杂质5的[M+H]+m/z 305,与 gentamineC2、C2a、C2b(小诺霉素脱C环的降解物)相同(如图1所示),其二级质谱为 [M+H]+m/z 288、163、143、126、112,用上述三候选结构对二级质谱进行解析,均能使所有碎片得到合理解释,考虑到样品中小诺霉素(为主要杂质),杂质5的结构为gentamine C2b可能性更大。见图7。

图7 杂质5(gentamine C2b)二级质谱可能的裂解途径
杂质6的[M+H]+m/z 431,与西索米星的分子量差17 Da,提示可能比其少1分子氨,二级质谱为m/z 332、314、296、272、269、254、227、199、173、163、160、154,其中m/z 163、160分别为西索米星的 B环和C环的特征离子[8],提示杂质6中有这两特征基团,由此可知缺少的1分子氨应在A环结构中,根据上述分析,杂质6可能的结构如图8所示,该结构可以合理解释二级质谱中的主要碎片离子。
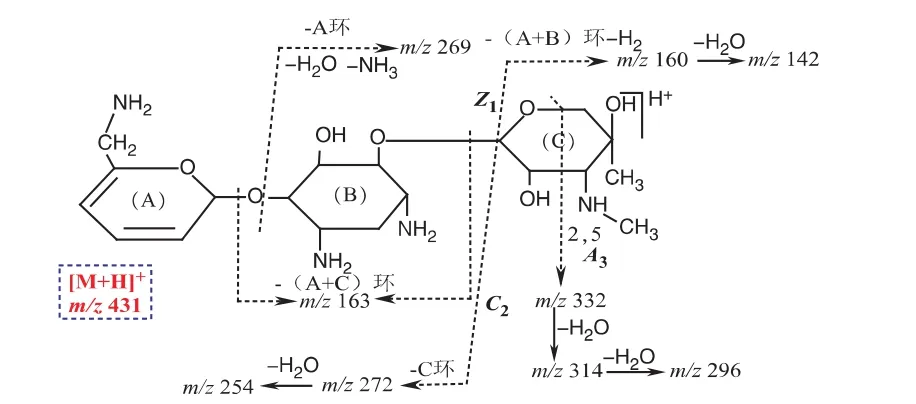
图8 杂质6二级质谱可能的裂解途径
杂质7的[M+H]+m/z 446,其二级质谱为318、290、160、142;目前无分子量为445 Da的氨基糖苷类抗生素的结构报道,仅根据这些质谱信息无法推测其结构。
杂质8的[M+H]+m/z 450,其二级质谱碎片离子 m/z 433、308、288、205、187、163、143,文献[1]报道庆大霉素原料中 [M+H]+m/z 450组分除庆大霉素C1a外,还发现有庆大霉素Ⅶ-2和庆大霉素Y-02077H(如图1所示),用这两结构均能合理解释,故从二级质谱上无法区分A环的6位上的甲基的连接方式,进一步用多级质谱对特征离子m/z 143进行分析,得到三级质谱为 m/z 143、126、109,表明A环中有两个自由的氨基,这与庆大霉素Ⅶ-2结构吻合,表明杂质8为庆大霉素Ⅶ-2,其二级质谱裂解过程如图9所示。
杂质9的[M+H]+m/z 492,比小诺霉素的[M+H]+大 28 Da,其二级质谱为[M+H]+m/z 475、350、305、188、163、143,其中m/z是小诺霉素的A+B环特征离子,m/z 163是庆大霉素C1a的B环特征离子[12-13],提示杂质9中有小诺霉素的A+B环结构,增加的结构部分应连接在C环上,文献[1]报道,庆大霉素原料中分离出3个 [M+H]+m/z 492组分的结构,其中XK-62-7的结构能合理解释其二级质谱,杂质9可能的结构如图10所示。

图9 杂质8(Ⅶ-2)二级质谱可能的裂解途径
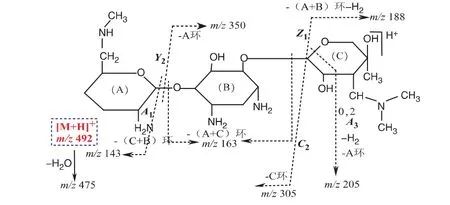
图10 杂质9(XK-62-7)二级质谱可能的裂解途径
杂质10和杂质13的一级、二级质谱及色谱保留分别与西索米星和小诺霉素一致(质谱及色谱保留时间见表1),即为杂质10为西索米星,杂质13为小诺霉素。
杂质11的[M+H]+m/z 451,比庆大霉素C1a的分子量多1 Da,其二级质谱为[M+H]+m/z 434、334、322、292、275、205、163、160、142, 其 中 m/z322、205、163、160、142 是庆大霉素 C1a中 B+C 环的特征离子[12-13],提示杂质11结构中有庆大霉素C1a的B+C环结构,增加的1 Da应发生在A环上,即杂质11的结构为庆大霉素C1a的A环中某个氨基为羟基替代而得,如图11所示。

图11 杂质11二级质谱可能的裂解途径
杂质12的[M+H]+m/z 462,比小诺霉素的分子量([M+H]+m/z 464)少2Da,提示结构中有双键,其二级质谱为 444、413、322、303、285、254、205、163、160、142,其中碎片离子 m/z 322、205、163、160 为小诺霉素的B+C环特征离子[12-13]在A环上,倪雍富等[16]曾从橄榄星孢小单孢菌无锡亚种M-41的发酵液中分离到威达米星(verdamicin),该结构可以合理解释上述二级质谱中所有碎片离子,可见杂质12可能为威达米星,结构如图12所示。

图12 杂质12(verdamicin)二级质谱可能的裂解途径
3 讨 论
本研究首次建立用于庆大霉素C1a中杂质结构推定的HPLC-ESI-IT-MSn方法,并从庆大霉素C1a中检出13个杂质,对其中的12个杂质结构进行了推定 (见表1),该方法可以用于本品杂质谱的研究。由于样品有限,未对不同批次、不同来源的庆大霉素C1a中杂质的种类和含量之间的变化情况进行分析。
推定结构基本思路因有无杂质对照品而异。对有对照品的杂质,则通过比对两者的色谱保留时间、一级质谱和二级质谱,来确证结构。对无对照品的杂质,则利用已经总结出来的氨基糖苷类抗生素的特征裂解碎片离子和质谱裂解规律,通过一级、二级质谱或多级质谱信息,对未知杂质结构进行推导,有时还需要查阅相关文献或生产工艺,对结果进行佐证。
通过二级或多级质谱信息推导结构时,对结构中部分基团的位置或空间构型无法确定,这是用LC-MS进行结构鉴定的一个缺陷。由于这些杂质在样品中含量极微,用富集的制备方法获得杂质精制品的工作量大,甚至还需要特殊的设备,成为未知杂质研究的瓶颈所在,期待更先进的分析手段如LC-NMR加速发展来推动这方面工作的深入研究。
与其他氨基糖苷类抗生素一样,庆大霉素C1a中含有很多氨基和羟基,溶液状态下易离子化,故实验中选用电喷雾离子化方法,分别用正、负离子模式扫描庆大霉素C1a溶液,结果显示,正离子模式下检测灵敏度远远大于负离子检测模式,合理的解释为:流动相中氨水的挥发性远远大于冰醋酸,电喷雾形成的液滴在去溶剂时氨水部分先挥发去除,使残存液滴由原先的碱性转变为酸性,提供氢离子,庆大霉素C1a及其杂质经库仑爆炸后呈现为加氢离子,故实验中选择正离子模式进行质谱检测。
[1]Grahek R,Zupancic-Kralj L.Identification of gentamicin impurities by liquid chromatography tandem mass spectrometry[J].J Pharm Biomed Anal,2009,50(5):1037-43.
[2]杨蕴刘,郑霏琴,王宗阳,等.庆大霉素3种组分对绿脓假单胞菌抗菌活力的比较 [J].抗生素,1982,7(1):12-6.
[3]赵敏,范瑾.半合成新抗生素——依替米星[J].医药研究通讯,2002,31(7):24-5.
[4]赵 敏,范 瑾,胡小玲,等.庆大霉素C1a单组分产生菌-棘孢小单孢菌JIM-202的筛选和研究[J].中国抗生素杂志,1997,22(1):12.
[5]范铭琦,赵 敏,华 祥,等.庆大霉素C1a高产菌株的推理育种的研究[J]. 中国抗生素杂志,1998,23(6):410.
[6]Anand MK,Satish AP.Impurity profile of active pharmaceutical ingredient:A review[EB/OL].(2006-09-24)[2010-09-24]http://www.pharmainfo.net/reviews/impurity-profile-active-pharmaceutical-ingredient-review.
[7]Li B,Adams E,Van Schepdael A,et al.Analysis of unknown compounds in gentamicin bulk samples with liquid chromatography coupled with ion trap mass spectrometry[J].Rapid Commun Mass Spectrom,2006,20(3):393-402.
[8]Li B,Van Schepdael A,Hoogmartens J,et al.Investigation of unknown related substances in commercial neomycin samples with liquid chromatography/ion trap tandem massspectrometry[J].RapidCommunMass Spectrom,2007,21(11):1791-8.
[9]Li B,Van Schepdael A,Hoogmartens J,et al.Characterization of impurities in sisomicin and netilmicin by liquid chromatography/mass spectrometry[J].Rapid Commun Mass Spectrom,2008,22(22):3455-71.
[10]盛龙生,苏焕华,郭丹滨.色谱质谱联用技术[M].北京:化学工业出版社,2005.
[11]Vogel R,Defillipo K,Reif V.Determination of isepamicin sulfate and related compounds by high performance liquid chromatography using evaporative light scattering detection[J].J Pharm Biomed Anal,2001,24(3):405-12.
[12]袁耀佐,张 玫,钱 文,等.高效液相色谱-电喷雾-离子阱质谱法推定硫酸依替米星中有关物质的结构[J].分析化学,2010,38(6):817-22.
[13]袁耀佐,谭 力,张 玫,等.HPLC-ESI-IT-MSn法快速推定硫酸小诺霉素中有关物质的结构 [J].药学与临床研究,2010,18(1):31-7.
[14]郑 卫,魏天恩,程振泰,等.小单孢菌FIM-203产生庆大霉素 A 的研究[J]. 海峡药学,2006,18(4):170-3.
[15]黎 俊,付志纲,张 威,等.庆大霉素B的生产工艺:中国,200810070844[P].2008-08-27.
[16]倪雍富,朱坚屏.氨基糖苷类抗生素M-41-A的分离和鉴别[J]. 中国抗生素杂志,2001,26(5):337-9.