人参皂苷Rg1联合BMSCs对大鼠脑缺血再灌注损伤的保护作用
2012-08-05包翠芬包翠芳
包翠芬,包翠芳,李 磊,刘 霞
(1辽宁医学院科学实验中心,辽宁锦州121000;2锦州市中心医院;3辽宁医学院组胚教研室)
研究发现,有效剂量的人参皂苷Rg1能够改善脑缺血损伤的神经功能症状、减轻脑梗死程度[1]。另外,人参皂苷Rg1作为骨髓间充质干细胞(BMSCs)的诱导剂可以促进BMSCs分化为神经元样细胞。目前,关于人参皂苷Rg1与BMSCs联合应用治疗缺血性脑病的研究还未见报道。2011年3~12月,我们通过体内模拟脑缺血模型,同时联合应用人参皂苷Rg1及BMSCs进行干预,从分子水平和基因水平探讨二者联合应用对于缺血性脑病的保护作用及可能机制,为防治缺血性脑病提供实验依据。
1 材料与方法
1.1 材料 健康雄性SD大鼠(以排除雌激素影响)25只,体质量为(250±50)g,随机分为正常对照组(A组)、模型组(B组)、BMSCs治疗组(C组)、人参皂苷Rg1治疗组(D组)、BMSCs和人参皂苷Rg1联合治疗组(E组)各5只。人参皂苷Rg1(纯度>95%)购自吉林大学有机化学教研室;DMEM、F12培养基、胎牛血清(Hyclone公司);BrdU(SIGMA公司);兔抗大鼠 BrdU、NSE单克隆抗体(博奥森公司);PV6001二抗试剂盒、DAB试剂盒(北京中杉公司)。
1.2 方法
1.2.1 BMSCs的培养及体外标记 取4周龄 SD大鼠,10%水合氯醛腹腔麻醉,100%乙醇浸泡,无菌条件下于髂骨抽取骨髓;采用胰酶消化,纱网过滤、离心、弃上清,以分离细胞;加入标准培养液重悬,纯化为单细胞悬液;计数,接种,置于37℃、5%CO2、饱和湿度培养箱培养;隔日换液,定期观察,记录生长曲线。取第3代细胞,采用BrdU进行标记,标记48 h后进行脑室内注射。
1.2.2 脑缺血模型的制备及给药方式 10%水合氯醛腹腔麻醉,采用脑室内注射法将标记的BMSCs细胞悬液(5×105)一次性注入右侧脑室内(C组、E组);除A组外,其余各组均采用改良线栓法制备大鼠右侧大脑中动脉缺血模型。栓塞4 h后,将鱼线轻轻拔出并缝合皮下筋膜及皮肤,即为再灌注模型。术后,D组、E组分别腹腔注射人参皂苷Rg1(20 mg/kg),每日1次,B组、C组分别腹腔注射等量的生理盐水。动物清醒后参照Zea Longa的5分制评分标准,采用单盲法进行神经功能缺损程度判定,取3~4分大鼠纳入实验。
1.2.3 组织样本的制备 各组大鼠于造模后4周采用单盲法进行神经功能缺损评分后,用4%多聚甲醛全身灌注,在前囟尾侧4.6~2.6 mm间冠状切取脑组织块,梯度乙醇脱水、二甲苯透明、石蜡包埋,切片厚度5μm。
1.2.4 尼氏染色及图像分析 取以上各组切片常规脱蜡至水,经1% 焦油紫染液染色后,快速脱水透明,封片,光镜下观察(神经元的尼氏体呈蓝紫色)。采用CIAS-1000型细胞图像分析仪计数400倍视野下结构完整的神经元数量。
1.2.5 免疫组化染色检测BrdU、NSE的表达 取上述切片常规脱蜡至水,3%H2O2处理30 min以去除内源性过氧化物酶,高压修复抗原,分别滴加1∶100稀释的兔抗大鼠BrdU、NSE抗体,4℃过夜,滴加辣根酶标记羊抗兔多聚体,37℃孵育30 min。DAB显色,苏木素复染,中性树胶封片。阴性对照用PBS替代一抗DAB显色。采用CIAS-1000型细胞图像分析仪计数每个视野下阳性细胞百分率。
1.2.6 统计学方法 应用SPSS10.0统计软件,数据均用¯x±s表示。多组间差异性检验采用单因素方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 各组神经功能症状评分及神经元计数 造模后动物清醒时A组活动自如,局灶性肌力无减弱,未见神经功能缺损症状;其余各组均出现明显的神经功能缺损症状。4周后各组大鼠神经功能缺损症状均有不同程度的改善,其中E组最为显著。焦油紫染色可见A组右侧皮层神经元形态正常,细胞质中可见深紫色尼氏体;B组正常神经元数量显著减少,尼氏体明显减少甚至消失;C、D、E组神经元存活数量得到不同程度地提高,与B组比较差异有统计学意义,其中E组与A组比较无统计学差异。见表1。
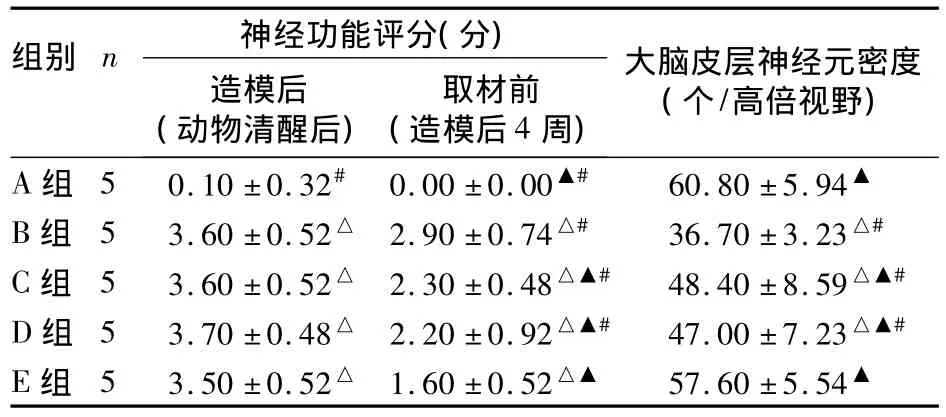
表1 各组大鼠神经功能评分、大脑皮层神经元密度比较(¯x ± s)
2.2 BrdU、NSE蛋白表达 造模4周后免疫组化染色A、B、D组未见BrdU蛋白阳性表达细胞;C、E组可见梗死区附近有细胞核黄染的BrdU蛋白阳性细胞。C、E两组BrdU蛋白表达比较无统计学差异。NSE阳性定位于细胞质。造模4周后A组为正常的脑细胞形态,神经元胞质及突起呈较强的NSE蛋白阳性表达。B组细胞排列紊乱,细胞呈三角形或梭形,间质疏松,可见少量的神经元NSE蛋白阳性表达;与B组比较,C、D、E组的形态结构有不同程度的改善,且NSE蛋白阳性表达增强,以E组最为显著。见表2。
3 讨论
近年有研究表明,BMSCs移植对于缺血性脑病的治疗具有重要的作用。Kopen等[2]将BMSCs注入新生的小鼠侧脑室,并经小鼠的前脑和小脑到达宿主的大脑内,而不破坏宿主的脑内结构,这一实验开始了BMSCs治疗脑部疾病的新时代;朱洁等将未经诱导的BMSCs直接注入CIRI大鼠脑内,通过示踪法发现移植BMSCs向缺血性脑损伤区定向迁移。
BMSCs虽然是缺血性脑病移植的理想种子细胞,但是深入研究发现,BMSCs于体外诱导为神经细胞后存活率可高达80%,但在体内仅为3% ~10%,并且存活时间不超过1周。推测可能与体内微环境的改变有关。当脑组织缺血缺氧时,组织内兴奋性氨基酸、氧自由基、黏附分子、炎症因子分泌增多等因素,导致脑细胞生存微环境改变,影响BMSCs的存活和增殖。BMSCs移植的低存活率大大地影响了其治疗效果,因此,寻找一种有效的促进BMSCs增殖、提高BMSCs存活率的方法成为当前研究的热点。
近年来研究表明,某些药物可以与BMSCs联合应用治疗脑缺血。如 Li等[3]联合应用脑脉通与BMSCs治疗脑缺血,结果显示联合用药组神经功能缺损症状显著改善。但是没有证据显示二者联合应用可以促进BMSCs的增殖、提高BMSCs存活率。
人参皂苷Rg1是传统“补气生血”药人参的根、茎提取物,具有明显的神经保护作用。近年来,部分学者开始将人参皂苷Rg1应用于缺血性脑病的实验研究中。此外,人参皂苷Rg1还可以作为干细胞的诱导剂促进干细胞的定向分化,并且可以诱导干细胞的增殖。研究显示,人参皂苷Rg1可以在体外促进大鼠BMSCs增殖、诱导BMSCs分化为神经元样细胞,并且对内源性神经干细胞、血管内皮干细胞的增殖、分化起重要的调节作用[4~9]。本实验结果显示,联合应用人参皂苷Rg1和BMSCs能够显著改善脑缺血大鼠的神经功能缺损症状,提高神经元存活率,而BrdU示踪显示联合用药组的移植细胞数量较单独应用时显著增多,并能促进损伤神经元的修复。其机制可能是Rg1作为小分子物质,易于通过血脑屏障,并且具有抗炎、抗氧化、清除自由基、改善神经功能缺损、减轻脑梗死体积、抑制细胞凋亡等作用,从而为BMSCs在脑内的存活及分化提供一个良好的微环境,有利于BMSCs在脑内的增殖。因此,人参皂苷Rg1与BMSCs的联合应用可以为治疗缺血性脑病的新方法提供实验基础。
[1]胡霞敏,严常开,胡先敏.人参皂苷Rg1对脑缺血再灌注损伤大鼠脑线粒体功能的影响[J].中国新药杂志,2006,15(7):514-517.
[2]Kopen GC,Prockop DJ,Phinney DG.Marrow stromal cells migrate throughout forebrain and cerebellum,and they differentiate into astrocytes after injection into neonatal mouse brains[J].Proc Natl Acad Sci USA,1999,96(2):10711-10716.
[3]Li JS,Liu JX,Tian YS,et al.Effects of naomaitong combined with mobilization of bone marrow mesenchymal stem cells on neuron apoptosis and expressions of Fas,FasL and caspase-3 proteins in rats with cerebral ischemia[J].Journal of Chinese Integrative Medicine,2009,7(9):860-867.
[4]张德凤,潘家华,张梅,等.丹参联合骨髓间充质干细胞移植治疗新生鼠缺氧缺血性脑损伤的实验研究[J].J Appl Clin Pediatr,2011,26(2):143-145.
[5]Shi AW,Wang XB,Lu FX,et al.Ginsenoside Rg1 promotes endothelial progenitor cell migration and proliferation[J].Acta Pharmacol Sin,2009,30(3):299-306.
[6]Lu XZ,Wang JH,Wu X,et al.Ginsenoside Rg1 promotes bone marrow stromal cells proliferation via the activation of the estrogen receptor-mediated signaling pathway[J].Acta Pharmacol Sin,2008,9(10):1209-1214.
[7]游辉,彭玉,张其梅,等.亚低温与脑缺血大鼠骨髓间充质干细胞的迁移[J].中国组织工程研究与临床康复,2010,14(32):5931-5934.
[8]石永江,刘宏亮,姚忠祥,等.人参皂甙Rg1、Rb1对 SVZa-NSCs增殖影响及其与STAT3的关系[J].中国康复,2007,22(2):75-78.
[9]Zhuang P,Zhang Y,Pang T.Proliferation effect of neural stem cell of ginsenoside Rg1 in vitro[J].Zhongguo Zhongyao Zazhi,2009,34(4):443-446.
