结直肠癌组织中miR-338-3p、SMO的表达变化及意义
2012-08-05苏桂源李国新
苏桂源,孙 凯,李国新,余 江
(南方医科大学南方医院,广州510515)
微小RNA(miRNA)是真核生物中一类长约22个核苷酸的非编码小分子RNA,于转录后水平调控靶基因表达,其作为一类潜在的癌基因或抑癌基因参与多种肿瘤的发生发展过程[1~3]。miRNA-338-3p(miR-338-3p)是新近发现的一种miRNA,其在结直肠癌中的表达情况及其调控靶目标的表达情况尚未见报道。Smoothened(SMO)蛋白是Sonic hedgehog(Shh)信号通路中的一个关键跨膜蛋白,具有开关该信号通路的作用;Shh信号通路异常激活可促进肿瘤细胞增殖、迁徙以及新生血管的形成[4,5]。本研究观察了结直肠癌组织中miR-338-3p及SMO的表达情况,为探讨两者可能的内在调控关系提供实验依据。
1 资料与方法
1.1 临床资料 2010年9~12月南方医科大学南方医院收治的结直肠癌患者30例,男16例,女14例;年龄(58.8±11.2)岁。其中结肠癌19例,直肠癌11例。患者接受手术治疗时,留取癌组织,同时取距离癌肿5 cm的肠黏膜(癌旁组织)及距离癌肿10 cm以上的肠黏膜(作为正常对照)。全部患者术前未接受放化疗。标本采集后用DEPC水处理并快速置液氮中冷冻,-80℃保存。
1.2 引物设计与合成 自miRNA Base数据库(http://microrna.sanger.ac.uk/)和 Genebank 查找基因序列,用Primer-Express 2.0软件进行引物设计。miR-338-3p及内参照RNU6B由GeneCopoeia公司设计合成。SMO上游引物为5'-TTACCTTCAGCTGCCACTTCTACG-3',下游引物为 5'-GCCTTGGCAATCATCTTGCTCTTC-3',扩增片段长 322 bp;内参照GAPDH上游引物为5'-GCTCTCCAGAACATCATCCCTGCC-3',下游引物为 5'-CGTTGTCATACCAGGAAATGAGCTT-3',扩增片段长346 bp;上述引物由上海英潍捷基公司合成。
1.3 miR-338-3p的检测 采用实时荧光定量聚合酶链反应(RT-PCR)技术。用Trizol抽提标本组织中的总RNA,使用Beckman Coulter DU800核酸蛋白分析仪测定 RNA浓度,RNA的 A260nm∶A280nm≥1.8,经甲醛变性凝胶电泳后取 28S、18S泳道的RNA条带进行鉴定,实验所用RNA具备较高的纯度及完整性。使用All-in-OneTMmiRNA qRT-PCR Detection试剂盒进行miRNA逆转录反应和Q-PCR反应,严格按照说明书进行操作,每个标本均作复管PCR反应。用RNU6B作为内参照。样本中miR-338-3p的ΔCt值 =样本中 miR-338-3p的 Ct值 -RNU6B的Ct值;因用Real-time Q-PCR来检测RNA时,不同RNA样本存在不同的逆转录效率,故以正常对照的肠黏膜ΔCt值进行校正,得出ΔΔCT值,ΔΔCt=(CtmiR-338-3p- CtRNU6B)目的样本- (CtmiR-338-3p-CtRNU6B)校正样本,各样本中 miR-338-3p 的含量用 2-ΔΔCt表示。
1.4 SMO mRNA的检测 采用半定量RT-PCR技术。取提取的总RNA 3μg作为模板合成cDNA,然后进行PCR。取扩增产物5μL行2.0%琼脂糖凝胶电泳,用Pharmacia Master Image紫外凝胶成像系统进行电泳条带分析。SMO mRNA相对含量=目的基因条带积分吸光度值/内参照GAPDH基因条带积分吸光度值。每个样本重复检测3次。
1.5 SMO蛋白的检测 采用Western blot。称取标本组织100 mg,置高压灭菌的研钵上,加液氮研磨成组织浆,加入蛋白提取液1 mL,充分搅匀后超声破碎5 min,4℃、12 000 g离心10 min,收集裂解物总蛋白;凯基BCA蛋白检测试剂盒测定蛋白浓度。取总蛋白50μg,加凝胶上样缓冲液调整体积,于100℃加热5 min,使蛋白完全变性。SDS-PAGE凝胶电泳分离蛋白并原位电转印至PVDF膜,该膜经5%脱脂奶粉封闭处理后,与兔抗人SMO多克隆抗体和内参照β-Acion分别孵育。膜漂洗后分别与辣根过氧化物酶耦联的特异性二抗反应,增强化学发光法(ECL)显影得到蛋白印记条带,以Quantity One软件检测灰度值。每个样本重复检测3次。
1.6 统计学方法 采用SPSS13.0统计软件。组间比较用配对设计两两比较t检验,相关性分析用Spearman相关分析法。P≤0.05为差异有统计学意义。
2 结果
结直肠癌组织中miR-338-3p的表达量为0.153 7 ±0.126 4,SMO mRNA 相对表达量为 0.371±0.116,SMO 蛋白灰度值为 3.195 ±1.623,癌旁组织分别为 0.901 5 ±0.426 3、0.366 ±0.117、0.733±0.305,两种组织中的 miR-338-3p、SMO 蛋白表达相比,P均<0.01;miR-338-3p与SMO蛋白的表达呈负相关(r= - 0.877,P < 0.01)。SMO mRNA、SMO蛋白的电泳条带见图1、2。
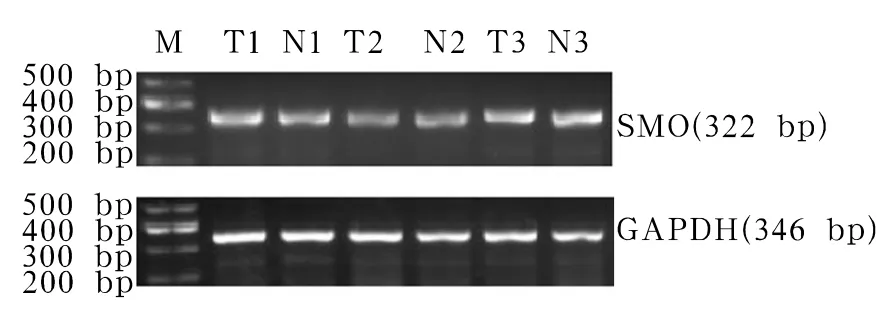
图1 SMO mRNA在结直肠癌及癌旁组织中的表达注:T1和N1、T2和N2、T3和N3分别为3例患者癌组织和癌旁组织中的SMO mRNA
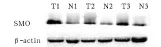
图2 SMO蛋白在结直肠癌与癌旁组织中的表达
3 讨论
有学者[6]曾采用液相芯片技术检测发现,miR-338-3p在肝细胞癌组织中的表达显著下调。本研究结果显示,miR-338-3p在结直肠癌组织中的表达水平较癌旁组织显著下降。提示miR-338-3p基因的表达缺失可能参与了结直肠癌的发生及演进过程。miR-338-3p定位于染色体17q25.3,而染色体17q23-25位点常是多种恶性肿瘤的突变热点,且其突变后的遗传表型常与肿瘤的血管侵袭和远处转移等恶性生物学行为密切相关[7],此现象亦提示miR-338-3p可能参与了肿瘤侵袭转移的进程,而这亦与我们前期预实验中所发现的miR-338-3p在转移性结直肠癌中表达水平更低的结果相一致。说明miR-338-3p可能是一种与结直肠癌侵袭转移密切相关的抑癌基因。
Shh信号转导通路主要由分泌型信号糖蛋白Shh配体、跨膜蛋白受体Ptch和另一跨膜蛋白SMO组成的复合物以及下游转录因子Gli蛋白等组成[8]。其中SMO蛋白是Shh信号通路中关键的信号转换器,具有调控Shh信号通路开或关的作用,即SMO蛋白能够将细胞外的Shh信号转换成细胞内的Gli信号,从而启动细胞核内特异基因的转录,对Shh信号通路具有激活作用。研究[9]证实,Shh信号通路亦参与调控肿瘤细胞的运动、迁移和肿瘤血管形成,在肿瘤侵袭与转移过程中发挥重要作用,相应地激活或抑制Shh信号亦可促进或抑制肿瘤转移。我们通过TargetScan、PicTar、miRanda等生物信息学分析软件筛选miR-338-3p的可能作用靶基因,发现miR-338-3p与SMO mRNA 3'非翻译区(UTR)存在互补结合,提示SMO蛋白可能是miR-338-3p在结直肠癌中新的作用靶点,miR-338-3p可能通过调控SMO蛋白表达,进而影响结直肠癌侵袭转移的生物学行为。
miRNA主要通过切割降解和翻译抑制两种机制来调控其靶基因的转录后表达。由于绝大部分miRNA不能与其靶基因的转录体完全配对,故认为miRNA主要通过翻译抑制的方式发挥生物学效应[10~12]。本研究证实,SMO mRNA 在结直肠癌和癌旁组织中的表达差异无统计学意义,但SMO蛋白却在结直肠癌组织中表达显著增高,再结合miR-338-3p表达下降且两者之间存在明显的负相关关系这一结果,推测miR-338-3p可能通过不完全互补配对方式与SMO mRNA 3'UTR结合,故仅能抑制SMO mRNA的进一步翻译,但不能将其根本降解;而结直肠癌组织中由于miR-338-3p表达下调,从而未能于转录后水平沉默SMO蛋白表达,导致SMO蛋白表达上调,继而异常激活Shh信号通路,促进结直肠癌侵袭转移。
综上所述,结直肠癌组织中miR-338-3p表达明显下调,SMO蛋白表达明显上调,miR-338-3p可能通过转录后基因沉默机制使SMO蛋白表达下降,从而抑制结直肠癌的发生发展。此为结直肠癌发病机制和诊断治疗的研究提供了新的思路和实验基础。
[1]Sun K,Wang W,Zeng JJ,et al.MicroRNA-221 inhibits CDKN1C/p57 expression in human colorectal carcinoma[J].Acta Pharmacol Sin,2011,32(3):375-384.
[2]Ng EK,Chong WW,Jin H,et al.Differential expression of microRNA in plasma of patients with colorectal cancer:a potential marker for colorectal cancer screening[J].Gut,2009,58(10):1375-1381.
[3]Guarnieri DJ,DiLeone RJ.MicroRNAs:a new class of gene regulators[J].Ann Med,2008,40(3):197-208.
[4]Coon V,Laukert T,Pedone CA,et al.Molecular therapy targeting Sonic hedgehog and hepatocyte growth factor signaling in a mouse model of medulloblastoma[J].Mol Cancer Ther,2010,9(9):2627-2636.
[5] Lum L,Beachy PA.The hedgehog response network:sensors,switches,and routers[J].Science,2004,304(5678):1755-1759.
[6]Huang XH,Wang Q,Chen JS,et al.Bead-based microarray analysis of micro RNA expression in hepatocellular carcinoma:miR-338 is down-regulated[J].Hepatol Res,2009,39(8):786-794.
[7]Tsuchiya S,Oku M,Imanaka Y,et al.MicroRNA-338-3p and microRNA-451 contribute to the formation of basolateral polarity in epithelial cells[J].Nucleic Acids Res,2009,37(11):3821-3827.
[8]Stanton BZ,Peng LF.Small-molecule modulators of the Sonic Hedgehog signaling pathway[J].Mol Biosyst,2010,6(1):44-54.
[9]Wang K,Pan L,Che X,et al.Sonic Hedgehog/GLI1 signaling pathway inhibition restricts cell migration and invasion in human gliomas[J].Neurol Res,2010,32(9):975-980.
[10]孙凯,曾俊杰,王伟,等.微小RNA-221对结直肠癌中CDKN1C/p57表达的调控研究[J].中华胃肠外科杂志,2011,14(4):279-283.
[11]曾俊杰,孙凯,吴承堂,等.应用实时荧光定量PCR检测结直肠癌与癌旁组织中miRNA-221的差异表达状况[J].山东医药,2010,50(12):26-28.
[12]Sevignani C,Calin GA,Siracusa LD,et al.Mammalian microRNAs:a small world for fine-tuning gene expression[J].Mamm Genome,2006,17(3):189-202.
