川芎嗪对肾间质纤维化大鼠中MMP-9、TIMP-1表达的影响*
2012-08-04李健芝庾江东刘玉明刘丽君周秀田莫文娟
李健芝 庾江东 刘玉明 胡 丽 刘丽君 周秀田 莫文娟
1 南华大学护理学院,湖南省衡阳市 421001; 2 湖南省衡阳市中心医院 3 南华大学医学院病理教研室
细胞外基质合成和降解失衡引起的基质积聚是导致肾间质纤维化的基本病理生理过程。基质金属酶系统(MMPS/TIMPS)是ECM降解过程中的关键性降解酶系之一,MMPS/TIMPS比例降低也是导致肾小球和肾间质纤维化的重要原因[1]。川芎嗪是中药川芎的有效成分之一,有扩张血管、抑制血小板聚集、改善微循环和减轻组织缺氧性损害、抗细胞凋亡以及抗组织纤维化的作用。然而对于其抗肾纤维化的作用机制仍不清楚。本文旨在通过建立单侧输尿管梗阻肾纤维化模型,以国际公认的具有肾脏保护作用的血管紧张素Ⅱ受体拮抗剂缬沙坦作为阳性对照,观察川芎嗪对肾间质纤维化大鼠肾脏组织基质金属蛋白酶-9(MMP-9)、金属蛋白酶组织抑制因子-1(TIMP-1)表达的影响,探讨其抗肾间质纤维化的作用机制,为临床肾间质纤维化的防治提供理论依据。
1 材料与方法
1.1 实验动物及主要试剂 清洁级、健康SD大鼠由南华大学试验动物部提供,体重220~250g,4~6周龄,生长良好,普食喂养。兔抗鼠MMP-9多克隆抗体、兔抗鼠TIMP-1多克隆抗体、SABC免疫组织化学试剂盒及DAB显色剂均购自武汉博士德生物有限公司。盐酸川芎嗪注射液由郑州卓峰制药有限公司提供,批号:H20055479;缬沙坦胶囊,80mg/粒,由海南澳美华制药有限公司提供,批号:101203。
1.2 模型建立与分组 将32只雌性大鼠随机分为4组:Shan组(Sham组)、模型组(UUO组)、川芎嗪治疗组(Lig组)、缬沙坦治疗组(ARB组),每组8只。除Sham组外,其他3组大鼠均在无菌条件下行左侧输尿管结扎术建立单侧输尿管梗阻模型,手术方法:2%戊巴比妥5ml/kg腹腔注射麻醉大鼠,取右侧卧位,背部左肋下备皮,常规消毒,选左侧背部肋下0.5cm为切口,打开腹腔,游离左肾及左侧输尿管,将输尿管用组织钳托起,取中上段,两端用丝线结扎后,剪断左输尿管,然后逐层缝合;Shan组打开腹腔后分离左侧输尿管,并不结扎即关闭腹腔。Lig组、ARB组于手术前1d开始灌胃给药,1次/d,连续2周,川芎嗪40mg/(kg·d),缬沙坦1.5mg/100g。Sham组、UUO组用相同体积的生理盐水灌胃。各组大鼠均于术后14d处死大鼠,处死后留取左侧肾标本,用10%中性甲醛固定6~24h后,脱水,常规石蜡包埋,制成3mm厚切片,切片做HE染色、Masson染色及免疫组化染色。
1.3 观察指标
1.3.1 血肌酐(Scr)和血尿素氮(BUN)的检测:腹主动脉采血,采用OlymusAU21000型全自动生化分析仪测定Scr、BUN。
1.3.2 肾组织病理检查:肾组织经固定、脱水、石蜡包埋、常规切片,厚度3μm,行 HE染色和 Masson染色。肾小管间质病变的判断:取Masson染色切片观察各组肾小管间质纤维化程度。按文献[2]描述的方法进行半定量评分,在光镜下(×400),对每张切片随机选择10个不含肾小球和大血管的肾皮质视野进行分析。肾小管间质病变按以下3个参数决定:蛋白管型和肾小管的扩张、坏死、萎缩;炎性细胞浸润;间质纤维化的程度。每个参数按0~3分评定(0=正常,1=轻度受损,2=中度受损,3=重度受损)。每个视野小管间质的评分为0~9分,计算其均值作为该标本的肾小管间质损伤指数。
1.3.3 肾组织免疫组织化学(SABC法):兔抗鼠MMP-9多克隆抗体、兔抗鼠TIMP-1多克隆抗体、SABC法试剂盒及DAB显色剂均购自武汉博士德生物有限公司,按SABC法试剂盒说明进行操作。应用真彩色病理图像分析系统对 MMP-9、TIMP-1结果进行分析,每张肾组织切片在400倍镜下随机选取5个面积相同的视野,摄取图像,输入图像分析系统,对免疫组化阳性信号进行积分光密度图像自动测量分析。
1.4 统计学方法 采用SPSS11.5统计学软件进行分析,数据以()表示,多样本均数比较采用单因素方差分析。以P<0.05为有统计学差异。
2 结果
2.1 肾功能检测 造模后UUO大鼠血尿素氮及肌酐均明显升高,与Shan组相比,差异均有统计学意义(P<0.05);Lig组、ARB组与 UUO组,两两比较,差异均无统计学意义(P>0.05)。见表1。
表1 各组大鼠Scr、BUN的变化(,n=8)

表1 各组大鼠Scr、BUN的变化(,n=8)
注:与Shan组比较,*P<0.05。
2.2 HE和Masson染色光镜观察结果 光镜下Shan组肾脏肾小管结构正常,间质未见增宽,无炎性细胞浸润,小管基底膜光滑完整。UUO组肾小管上皮细胞弥漫空泡变性,多数肾小管扩张、萎缩,多灶状炎性细胞浸润和纤维化。Lig组和ARB组间质内炎性细胞呈小灶状浸润,少许上皮细胞肿胀,少许肾小管轻度扩张,肾间质未见明显纤维化。Masson染色见Shan组肾脏的胶原染色主要位于肾小球基膜、Bowman囊、系膜区和肾小管毛细血管周围,而肾小管周围间质部分则比较少;UUO组可见肾间质大量胶原纤维增生,间质胶原纤维呈蓝色染色,间质纤维化呈灶状分布,肾小球病变不明显,偶见肾小球局灶节段性硬化。Lig组和ARB组上述病变均有所减轻。见图1、2。
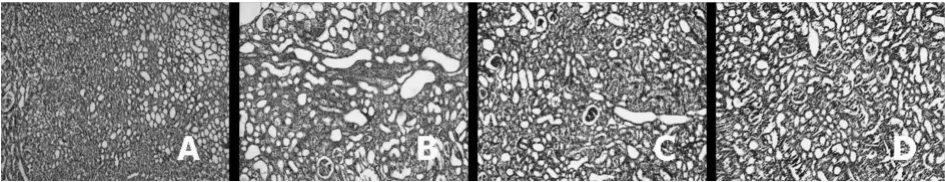
图1 各组肾组织病理变化(HE染色,×100)A:Shan组B:UUO组 C:Lig组 D:ARB组

图2 各组肾组织病理变化(Masson染色,×400)A:Shan组B:UUO组 C:Lig组 D:ARB组
2.3 肾小管间质损伤指数 肾小管间质损伤指数半定量评分UUO组明显高于Shan组(P<0.01),Lig组和ARB组明显低于UUO组(P<0.01),但Lig组和ARB组无显著性差异。见表2。
表2 各组大鼠肾小管间质损伤指数半定量评分(,n=8)

表2 各组大鼠肾小管间质损伤指数半定量评分(,n=8)
注:与Shan组比较,*P<0.01;与 UUO组比较,#P<0.01。
2.4 免疫组化结果 Shan组大鼠肾小管上皮细胞胞浆有少量 MMP-9、TIMP-1表达,肾小球和肾间质细胞少见 MMP-9、TIMP-1表达。UUO组可见MMP-9、TIMP-1表达较 Shan组明显增强且分布面积增加,主要在皮髓交界的肾小管间质区以及肾小管上皮细胞表达明显。Lig组和ARB组较模型组表达减弱,且分布面积减少,但二者无显著性差异。
MMP-9、TIMP-1免疫组化积分光密度值UUO组较Shan组明显上调(P<0.01),Lig组和ARB组均较UUO组减少(P<0.01),二者亦无显著性差异。与Shan组比较,其他各组 MMP-9/TIMP-1比值均明显下调(P<0.01)。见表3、图3、4。
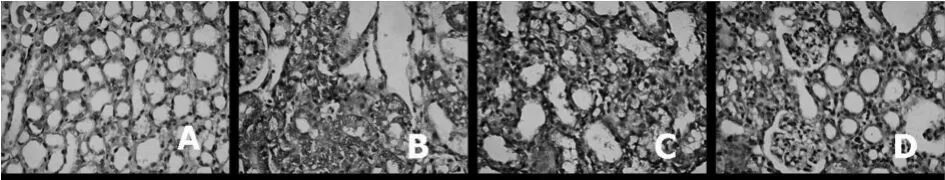
图3 肾组织MMP-9免疫组织化学染色(×400)A:Shan组B:UUO组 C:Lig组 D:ARB组
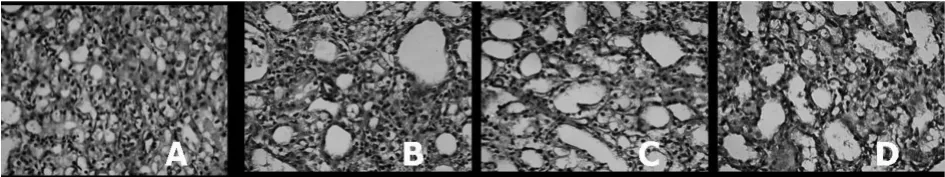
图4 肾组织TIMP-1免疫组织化学染色(×400)A:Shan组B:UUO组 C:Lig组 D:ARB组
表3 各组大鼠肾脏 MMP-9、TIMP-1的积分光密度值比较(,n=8)
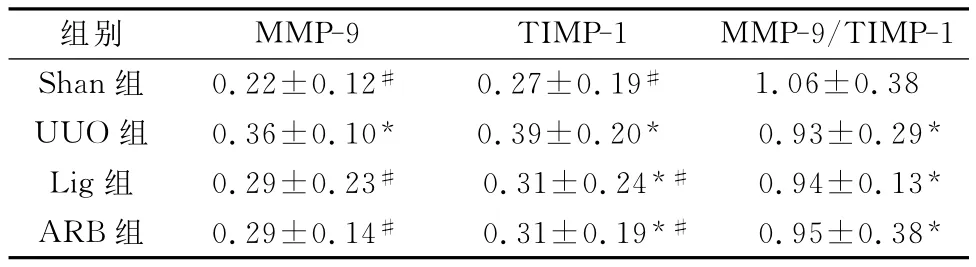
表3 各组大鼠肾脏 MMP-9、TIMP-1的积分光密度值比较(,n=8)
注:与Shan组比较,*P<0.01;与UUO组比较,#P<0.01。
3 讨论
单侧输尿管梗阻是目前公认的导致肾间质纤维化病理学改变的经典模型,通过该模型可以有效地评价药物对肾间质纤维化的疗效。本实验中模型组大鼠肾实质萎缩,肾脏质地变硬,肾盂扩张,呈囊状。肾小管上皮细胞萎缩,大部分肾小管管腔扩张,间质纤维组织增生,大量炎性细胞浸润,说明模型建立成功。
MMPs是降解ECM的关键酶,人们已发现20种MMPs,其中MMP-9又称明胶酶B,主要降解明胶、Ⅳ、Ⅴ、Ⅶ型胶原及层粘连蛋白、蛋白聚糖及弹性蛋白等,能降解完整的基底膜[3,4]。TIMP-1 是MMP-9的天然抑制剂,在ECM中与 MMP-9之间存在着微妙的平衡关系[5,6],其机理是特异性地与MMP-9催化活化中心的锌离子结合封闭其催化活性。
RQ Chen[7]等研究显示,在大鼠 UUO模型中TIMP-1、TIMP-2及 MMP-2、MMP-9的 mRNA 及蛋白质的表达在术后各时间点均显著增高,MMP-2和MMP-9的蛋白质水解活性逐渐下降。其活性下降与TIMP-1及TIMP-2蛋白质表达的增加呈明显的负相关。Zhang X[8]等研究显示,TIMP-1过度表达增加了衰老大鼠肾间质纤维化。同时,还有研究发现肾硬化[9]、糖尿病肾病[10]等有ECM 增多的肾脏疾病均有 TIMP-1增多或 MMPs/TIMP-1比例降低。本实验免疫组化的结果显示:术后2周,UUO组 MMP-9、TIMP-1表达较Shan组明显增强且分布面积增加,但 MMP-9/TIMP-1减低,与国内外的研究结果一致。上述的研究结果均提示TIMP-1高表达和 MMP-9/TIMP-1比例降低是导致肾脏纤维化的重要原因。
川芎嗪是中药川芎的有效成分之一,属酰胺类生物碱类,其化学结构为四甲基吡嗪,有扩张血管,抑制血小板聚集,改善微循环和减轻组织缺氧性损害,抗细胞凋亡以及抗组织纤维化的作用。本实验中Lig组MMP-9、TIMP-1表达较假模型组明显减低且分布面积减少,与ARB组之间无显著差异,提示川芎嗪与血管紧张素Ⅱ受体拮抗剂的治疗效果一致,可能通过恢复MMP/TIMP间的网络平衡来减少细胞外基质中胶原蛋白的合成,增加其降解,从而达到减轻或抑制肾小管间质纤维化进程的目的。
综上所述,肾组织中 MMP-9、TIMP-1表达与肾间质纤维化密不可分,川芎嗪通过下调MMP-9、TIMP-1表达可延缓肾间质纤维化发生、发展,为临床防治肾间质纤维化提供新的途径。
[1]Liu Y,Rajur K,Tolbert E,et al.Endogenous hepatocyte growth factor ameliorates chronic renal injury by activating matrix degradation pathways〔J〕.Kidney Int,2000,58(5):2028-2043.
[2]Taal MW,Zandi-Nejad K,Weening B,et al.Proinflammatory gene expression and macrophage recruitment in the remnant kidney〔J〕.Kidney int,2000,58(4):1664-1667.
[3]Kawata N,Nagane Y,Igarashi T,et al.Strong significant correlation between MMP-9and systemic symptoms in patients with localized renal cell carcinoma〔J〕.Urology,2006,68(3):523-527.
[4]李圣青,张艰,黎志东,等.小鼠肺纤维化模型中基质金属蛋白酶-9及其抑制剂表达水平的变化〔J〕.细胞与分子免疫学杂志,2004,20(6):724-726.
[5]Rysz J,Banach M,Stolarek RA,et al.Serum matrix metalloproteinases MMP-2and MMP-9and metalloproteinase tissue inhibitors TIMP-1and TIMP-2in diabetic nephropathy〔J〕.J Nephrol,2007,20(4):444-452.
[6]Boyd S,Tolvanen K,Virolainen S,et al.Differential expression of stromal MM P-1,MMP-9and TIMP-1in basal cell carcinomas of immunosuppressed patients and controls〔J〕.Virchows Arch,2008,452(1):83-90.
[7]RQ Chen,XM Chen,SW Cui,et al.Significance of imbalance between matrix metalloproteinases and tissue type inhibitor of metalloproteinases in renal tubulointerstitial lesions of aging rats〔J〕.Zhonghua Yi Xue Za Zhi,2004,84(11):937-942.
[8]Zhang X,Chen X,Hong Q,et al.TIMP-1promotes age-related renal fibrosis through upregulating ICAM-1in human TIMP-1transgenic mice〔J〕.J Gerontol A Biol Sci Med Sci,2006,61:1130-1143.
[9]曹灵,孙兴旺,马跃荣,等.小鼠膜性肾病肾脏中TIMP-1的表达及意义〔J〕.中国中西医结合肾病杂志,2004,5(6):325.
[10]陈荣权,陈香美,崔世维,等.基质金属蛋白酶/组织金属蛋白酶抑制物表达失衡在衰老大鼠肾小管间质损害中的意义〔J〕.中华医学杂志,2004,84(11):93.
