阿尔茨海默病患者脑脊液tau标志物含量与海马体积的相关性
2012-08-03李在坡连云港市第一人民医院神经内科江苏连云港222002
李在坡 (连云港市第一人民医院神经内科,江苏 连云港 222002)
阿尔茨海默病(AD)患者的海马体积(HVs)和脑脊液(CSF)中tau蛋白标志物与神经原纤维缠结沉积相关〔1,2〕,推测CSF tau蛋白或CSF tau高磷酸化蛋白(P-tau)与HVs可能相关;但有文献报道了与此推测冲突的神经影像学研究结果〔3,4〕,也有研究结果证明AD患者体内CSF标志物与HVs并无相关性〔5〕。本文旨在分析CSF生物标志物与大脑体积或HVs的相关性。
1 资料与方法
1.1 一般资料 收集我院2007年7月至2011年7月诊治的AD患者36例,平均年龄(62.6±8.1)岁,采用美国国立神经病语言障碍卒中研究所(NINCDS)和AD及相关疾病协会(ADRDA)建立的 NINCDS-ADRDA 新诊断标准〔6〕,入选标准:(1)进展期记忆障碍患者;(2)AD CSF得分<1〔7〕;(3)临床痴呆评定量表(CDR)得分>0。排除标准:(1)具有临床或影像学证据局灶性病变的患者;(2)严重皮质或皮下血管病变;(3)严重的抑郁症。收集符合标准的潜伏期、轻度认知能力受损和痴呆三个时期患者的全部临床检查、神经心理学评估结果、脑部MRI、CSF 标志物〔Aβ42,总 tau 蛋白(T-tau)和 P-tau〕检测结果。
1.2 方法
1.2.1 CSF生物标志物检测 通过腰椎穿刺(LP)获取患者CSF样本,4℃ 1 500 r/min离心10 min分离细胞,取上清至0.4 ml EP管中,-80℃保存。采用双抗夹心酶联免疫法(ELISA)(Innogenetics,Gent,Belgium)测定样本的 CSF 生物标志物含量。
1.2.2 核磁共振成像(MRI) 通过标准三维序列法获得T1加权核磁共振图像。见表1。
1.2.3 自动化HVs计算 采用SPM5分割软件自动化程序方法测量患者HVs、灰质、白质和全脑体积,并通过头部大小均一化HVs。
1.3 统计学方法 采用SPSS15.0统计软件进行分析,数据分布的正态性采用Shapiro-Wilk检验,统计分析采用参数化检验,相关性研究采用Pearson相关系数检验。

表1 核磁共振仪器参数统计表
2 结果
2.1 简易精神状态评分(MMSE)、CSF T-tau、P-tau、HVs 水平 36例患者MMSE评分为(19.2±6.3)分,临床CDR分布:0.5分6例,1分10例,1.5分10例,2分10例。CSF中T-tau平均含量为(506.52±160.22)pg/ml(其中 23例 T-tau>450 pg/ml),P-tau平均含量为(82.42±19.59)pg/ml(其中32例P-tau>60 pg/ml)。左右平均HVs无明显不对称〔左HV为(2.22±0.49)cm3;右HVs为(2.21±0.50)cm3〕。平均全血黏度为(1 021±140.47)cm3。
2.2 CSF生物标志物与神经影像学变量相关性分析 Pearson相关系数检验结果显示,左侧HVs与T-tau含量呈现显著的负相关(R= -0.53,P<0.001),与 P-tau同样呈现负相关(R=-0.56)。左右脑HVs平均值与P-tau呈现显著负相关(P=0.001;R=-0.52),见图1;但与 T-tau无显著相关性,见图2。HVs与Aβ42浓度无显著相关性。归一化全脑体积与Aβ42,T-tau,P-tau,T-tau/Aβ42,P-tau/Aβ42无相关性。见表 2。

图2 归一化平均海马体积与Aβ42相关性分析
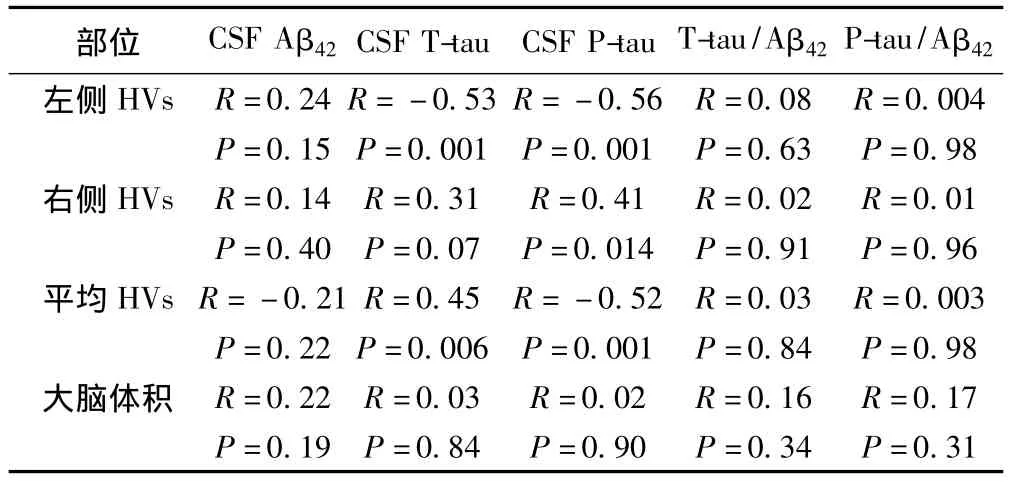
表2 CSF生物标志物与神经影像学变量相关性分析
3 讨论
本研究通过对潜伏期、进展期AD患者的CSF生物标志物和HVs萎缩程度的相关性研究,以及短间隔进行MRI和腰椎穿刺等方法,确定了CSF T-tau和P-tau含量水平,而非Aβ42与AD患者HVs具有显著相关性,且与近期相关性研究部分相同。研究还表明,左侧HVs与CSF T-tau和P-tau具有更好的相关性,这一结果与文献〔2,8〕报道相同,但其原因目前并不清楚。
综上所述,本研究结果对前期假设提供了佐证,在临床AD患者中,CSF P-tau的高含量预示由于神经元纤维缠结造成神经元死亡过程的发生,CSF tau标志物与神经元萎缩具有显著相关性。
1 Csernansky JG,Hamstra J,Wang L,et al.Correlations between antemortem hippocampal volume and postmortem neuropathology in AD subjects〔J〕.Alzheimer Dis Assoc Disord,2004;18(2):190-5.
2 Tapiola T,Alafuzoff I,Herukka,et al.Cerebrospinal fluid{beta}-amyloid 42and tau proteins as biomarkers of Alzheimer-type pathologic changes in the brain〔J〕.Arch Neurol,2009;66(4):382-9.
3 Apostolova LG,Hwang KS,Andrawis JP,et al.Alzheimer's disease neuroimaging initiative,3D PIB and CSF biomarker associations with hippocampal atrophy in ADNI subjects〔J〕.Neurobiol Aging,2010;31(110):1284-303.
4 Thomann PA,Kaiser E,Schönknecht P,et al.Association of total tau and phosphorylated tau 181protein levels in cerebrospinal fluid with cerebral atrophy in mild cognitive impairment and Alzheimer disease〔J〕.J Psychiatry Neurosci,2009;34(2):136-42.
5 Fagan AM,Head D,Shah AR,et al.Decreased cerebrospinal fluid Abeta(42)correlates with brain atrophy in cognitively normal elderly〔J〕.Ann Neurol,2009;65(2):176-83.
6 Dubois B,Feldman HH,Jacova C,et al.Research criteria for the diagnosis of Alzheimer's disease:revising the NINCDS-ADRDA criteria〔J〕.Lancet Neurol,2007;6:734-46.
7 Visser PJ,Verhey F,Knol DL,et al.Prevalence and prognostic value of CSF markers of Alzheimer's disease pathology in patients with subjective cognitive impairment or mild cognitive impairment in the DESCRIPA study:a prospective cohort study〔J〕.Lancet Neurol,2009;8(5):619-27.
8 Jack CR,Jr Dickson DW,Parisi JE,et al.Antemortem MRI findings correlate with hippocampal neuropathology in typical aging and dementia〔J〕.Neurology,2002;58(6):750-7.
