海藻酸钠固定化S-腺苷甲硫氨酸合成酶的制备及其性质研究
2012-07-28尹春丽曹珊珊牛卫宁
尹春丽,曹珊珊,牛卫宁
(1.西安文理学院生命科学系,陕西 西安 710065;2.西北工业大学生命学院,陕西 西安 710072)
S-腺苷甲硫氨酸(S-Adenosylmethionine,SAM)是广泛存在于生物体内的一种活性小分子,在体内SAM是由三磷酸腺苷(ATP)和L-甲硫氨酸(L-Met)经S-腺苷甲硫氨酸合成酶(S-Adenosylmethionine synthetase)催化合成[1]。在欧洲,SAM已作为处方药广泛用于肝病、抑郁症、关节炎等疾病的治疗;在美国,SAM已经成为一种畅销的保健品[2~4];在我国,SAM的市场需求不断增长,但售价昂贵。因此,建立廉价高效的SAM生产工艺是SAM大规模推广应用的关键。
目前,SAM的生产方法主要为酵母菌发酵法,存在生产周期长、底物转化率低、纯化工艺复杂、能耗高等缺点,而体外酶促法克服了发酵法的不足,是工业化生产SAM的一条新途径。 尽管Park等[5,6]通过游离酶催化合成了SAM,但是存在酶无法回收重复利用的问题。牛卫宁等[7,8]构建了高效表达SAM合成酶的重组大肠杆菌(E.coli)JM109(pBR322-SAMS),重组菌酶活性比原始菌提高了157倍。
与游离酶相比,固定化酶的热稳定性和化学稳定性大幅提高。同时,固定化酶与反应产物可以通过离心或过滤等简单方式加以分离,有利于酶的多次重复使用及产品的纯化。海藻酸钠安全无毒、价廉易得,用它与钙盐形成的凝胶来包埋SAM合成酶,具有反应条件温和、操作简单、不改变酶蛋白结构、酶活力损失小等优点。作者在此对海藻酸钠固定化SAM合成酶的制备条件进行了优化,同时研究了固定化SAM合成酶的酶学性质及其在SAM合成中的应用。
1 实验
1.1 菌种、试剂与培养基
重组菌株E.coliJM109(pBR322-SAMS),自行构建并保存[9]。
Phenyl-Sepharose Fast Flow(1 mL)预装柱,GE公司;S-腺苷甲硫氨酸标准品,Sigma公司;其余试剂均为分析纯。
LB培养基(%):酵母粉0.5,蛋白胨1,氯化钠1;四环素(Tetracycline)终浓度为15 μg·mL-1。
1.2 方法
1.2.1 重组SAM合成酶的表达
将重组菌E.coliJM109(pBR322-SAMS)接种到500 mL含有15 μg·mL-1四环素的LB培养基中,于30 ℃、220 r·min-1培养12~16 h,使菌体生长达到稳定期,重组蛋白在大肠杆菌中可实现高效的组成型表达,然后于4 ℃、6000 r·min-1离心10 min,将获得的菌体悬浮洗涤后,离心收集,备用。
1.2.2 重组SAM合成酶的纯化[8]
将1 L培养液离心后收集的菌体用缓冲溶液清洗,加入40 mL裂解液(100 mmol·L-1Tris-HCl,2 mmol·L-1EDTA-Na2,pH值8.0),在冰水浴中超声(300 W,超声3 s,间隔5 s)处理12 min破碎菌体,将破碎液于4 ℃、10 000 r·min-1离心30 min得到上清液;在上清液中加入(NH4)2SO4固体粉末至终浓度为40%,于10 000 r·min-1离心20 min得到沉淀;沉淀用100 mmol·L-1Tris-HCl(pH值8.0)溶解并加入(NH4)2SO4至终浓度为0.75 mol·L-1,用0.22 μm滤膜过滤,备用。
将上述经(NH4)2SO4沉淀的酶液加入到经Buffer A[50 mmol·L-1Tris-HCl,2 mmol·L-1EDTA-Na2,0.75 mol·L-1(NH4)2SO4,pH值8.0]预平衡的Phenyl-Sepharose Fast Flow(1 mL)柱,流速1 mL·min-1洗脱至基线。然后用Buffer B(50 mmol·L-1Tris-HCl,2 mmol·L-1EDTA-Na2,pH值8.0)直接洗脱得到SAM合成酶溶液。
1.2.3 固定化酶的制备
称取1 g海藻酸钠配制成水溶液,与一定量的SAM合成酶溶液混合后充分搅拌。 用6号针头注射器将该混合溶液滴加到4%(质量分数)的CaCl2溶液中,固定化30 min后,取出,洗净,备用。
1.2.4 固定化酶催化合成SAM
取1 g固定化酶加到10 mL SAM合成反应液(100 mmol·L-1Tris、100 mmol·L-1KCl、70 mmol·L-1MgSO4、40 mmol·L-1L-Met、30 mmol·L-1ATP、0.8 mol·L-1对甲基苯磺酸钠,pH值6.5)中,于35 ℃、200 r·min-1反应8 h,收集上清液进行HPLC分析。
1.2.5 酶活力的测定
在3 mL反应体系(100 mmol·L-1Tris、100 mmol·L-1KCl、2 mmol·L-1MgSO4、1 mmol·L-1L-Met、1 mmol·L-1ATP、0.5%β-巯基乙醇,pH值8.5)中加入适量SAM合成酶溶液,37 ℃下温育1 h后,加入终浓度为10%(质量分数)的三氯乙酸终止反应,离心,去沉淀,上清液用高效液相色谱(HPLC)进行分析,根据标准曲线(使用SAM标准品绘制色谱峰峰面积和SAM质量浓度之间的关系曲线)计算样品中SAM的质量浓度,进而计算SAM合成酶的酶活力。以不加酶液的反应液作空白对照。
同法测定固定化酶的酶活力。固定化酶的活力与固定化时所加游离酶总活力的比值即为固定化酶的活力回收率。
酶活力单位定义:在上述反应体系下,37 ℃、1 h催化产生1 μmol SAM所需要的酶量定义为1个酶活力单位(U)。
HPLC色谱条件为:色谱柱Kromasil C18(4.6 mm×250 mm,5 μm);检测波长260 nm;流动相:在900 mL纯水中加入40 mmol 乙酸钠和50 mL甲醇,用乙酸溶液调pH值至4.6,定容至1 L;流速0.6 mL·min-1。
2 结果与讨论
2.1 SAM合成酶的纯化
菌体超声破碎后,上清液经40%(NH4)2SO4盐析,离心,收集沉淀。沉淀溶解后加入(NH4)2SO4至终浓度为0.75 mol·L-1,上样到预平衡的Phenyl-Sepharose Fast Flow柱,然后直接洗脱得到SAM合成酶溶液。
结果发现,1 L发酵液纯化得到156 mg粗酶,酶纯化的活力回收率为76%,单位酶活力为30 U·mg-1。
为了降低固定化酶的成本,本研究并没有将SAM合成酶纯化至电泳纯,而是使用部分纯化的粗酶用于固定化研究。
2.2 SAM合成酶固定化条件的优化
2.2.1 海藻酸钠质量分数的确定
在SAM合成酶加量(以每克海藻酸钠计,下同)为75 mg、CaCl2质量分数为4%、固定化时间为30 min的条件下,考察海藻酸钠质量分数对固定化酶活力的影响,结果见图1。

图1 海藻酸钠质量分数对SAM合成酶固定化的影响
由图1可知,随着海藻酸钠质量分数的增大,固定化酶活力先上升后下降,当海藻酸钠质量分数为3%时,固定化酶活力达到最大。这是因为,海藻酸钠与Ca2+反应形成凝胶时,凝胶的孔径随着海藻酸钠质量分数的增大而缩小;当海藻酸钠质量分数较小时,凝胶孔径较大,凝胶内的酶分子容易泄露,故固定化酶活力较低;当海藻酸钠质量分数过大时,凝胶孔径太小,此时底物和产物的扩散受到限制,导致固定化酶活力下降。因此,确定海藻酸钠质量分数以3%较为适宜。
2.2.2 CaCl2质量分数的确定
在SAM合成酶加量为75 mg、海藻酸钠质量分数为3%、固定化时间为30 min的条件下,考察CaCl2质量分数对固定化酶活力的影响,结果见图2。
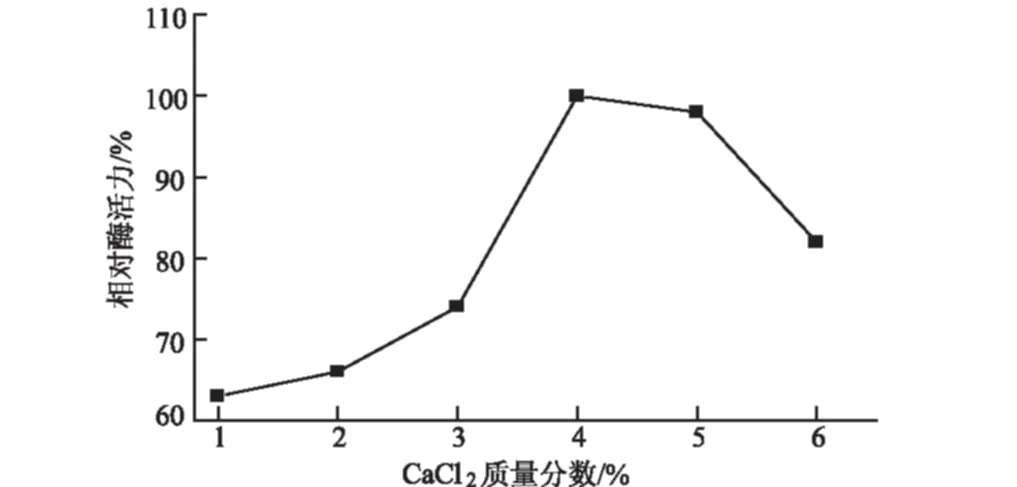
图2 CaCl2质量分数对SAM合成酶固定化的影响
由图2可知,当CaCl2质量分数超过2%时,固定化酶活力快速上升;当CaCl2质量分数达到4%时,固定化酶活力达到最大;CaCl2质量分数继续增大时,固定化酶活力反而下降。这是因为,当CaCl2质量分数较小时,海藻酸钠凝胶固化不充分,SAM合成酶包埋不完全,容易流失,从而导致固定化酶活力较低;当CaCl2质量分数过大时,与海藻酸钠作用形成致密的结构,使反应底物和产物的扩散变得困难,导致固定化酶活力下降。因此,确定CaCl2质量分数以4%较为适宜。
2.2.3 SAM合成酶加量的确定
在海藻酸钠质量分数为3%、CaCl2质量分数为4%、 固定化时间为30 min的条件下,考察SAM合成酶加量对固定化酶活力的影响,结果见图3。

图3 SAM合成酶加量对SAM合成酶固定化的影响
由图3可知,随着SAM合成酶加量的增加,固定化酶活力逐渐上升;当酶加量增加到75 mg时,载体承载量达到最大值,此时固定化酶活力回收率为42%;继续增加酶加量,固定化酶活力反而下降。因此,确定SAM合成酶加量以75 mg较为适宜。
2.2.4 固定化时间的确定
在SAM合成酶加量为75 mg、海藻酸钠质量分数为3%、CaCl2质量分数为4%的条件下,考察固定化时间对固定化酶活力的影响,结果见图4。

图4 固定化时间对SAM合成酶固定化的影响
由图4可知,当固定化时间为30 min时,固定化酶活力达到最大值;固定化时间过短或过长,均会使固定化酶活力下降。这是因为,随着固定化时间的延长,SAM合成酶在海藻酸钠凝胶中被包埋得更牢固,不易脱落;但当固定化时间过长时,海藻酸钠凝胶球表面形成的钙化层过于致密,影响反应底物和产物的自由扩散,导致固定化酶活力下降。因此,确定固定化时间以30 min较为适宜。
2.3 固定化酶的酶学性质
2.3.1 固定化酶的热稳定性
将固定化酶和游离酶于不同温度下保温5 h,分别测定酶活力。以未处理的固定化酶和游离酶的酶活力为100%,计算相对酶活力,结果见图5。

图5 固定化和游离SAM合成酶的热稳定性
由图5可知,在50 ℃ 下保温5 h,游离酶活力完全丧失,而固定化酶仍保留69%的酶活力;在55 ℃下保温5 h,固定化酶仍保留32%的酶活力。可见固定化酶的热稳定性优于游离酶。这是由于,SAM合成酶经固定化后,酶分子被固定在凝胶中,分子整体运动受限,酶的热稳定性也随之增强。
2.3.2 固定化酶的pH值稳定性
4 ℃下,将固定化酶和游离酶在pH值为6.0~9.5的缓冲溶液中放置10 h,测定酶活力。以未处理的固定化酶和游离酶的酶活力为100%,计算相对酶活力,结果见图6。
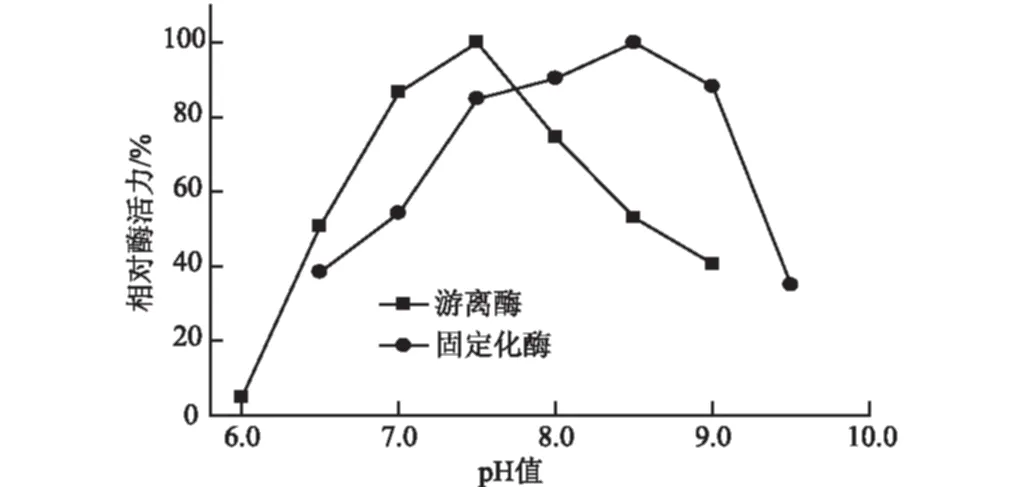
图6 固定化和游离SAM合成酶的pH值稳定性
由图6可知,游离酶在pH值为6.5~8.5的条件下均能保留50%以上的酶活力,但在pH值为6.0的缓冲溶液中几乎完全失活;固定化酶在pH值为7.5~9.0的条件下均能保留84%以上的酶活力,在pH值为9.0时仍保留88%的酶活力。因此,固定化酶在碱性条件下的稳定性优于游离酶。
2.3.3 固定化酶的操作稳定性
取一定量固定化SAM合成酶,连续进行8批次反应,每次反应完毕将固定化酶过滤洗涤后重复使用。测定每次反应后固定化SAM合成酶的剩余酶活力。以反应前固定化酶的总活力为100%,计算相对酶活力,结果见图7。
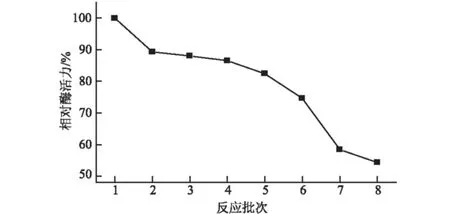
图7 固定化酶的操作稳定性
由图7可知,在第1批次反应后酶活力有一定程度的下降,残余酶活力为89%;连续反应5批次后,保留82%的酶活力;连续反应8批次后,仍保留54%的酶活力。表明固定化SAM合成酶具有较好的操作稳定性。
3 结论
以海藻酸钠包埋法制备固定化SAM合成酶具有工艺简单、条件温和及操作方便的特点。最佳固定化条件为:海藻酸钠质量分数3%、CaCl2质量分数4%、SAM合成酶加量75 mg、固定化时间30 min,在此条件下,固定化酶活力回收率达到42%。固定化酶在50 ℃下保温5 h仍保留69%的酶活力,而游离酶则完全失活。固定化酶在碱性条件下的稳定性较好,在pH值为7.5~9.0的缓冲溶液中4 ℃下保温10 h仍保留84%以上的酶活力。将固定化酶用于SAM的合成,连续反应5批次后,仍保留82%的酶活力。该研究为工业化生产SAM提供了一条新途径。
参考文献:
[1] 牛卫宁,左晓佳,王莉衡,等.S-腺苷甲硫氨酸制备方法的研究进展[J].化学与生物工程,2009,26(3):1-5.
[2] Lu S C.S-Adenosylmethionine[J].Int J Biochem Cell Biol,2000,32(4):391-395.
[3] Bottiglieri T.S-Adenosyl-L-methionine(SAMe):From the bench to the bedside——Molecular basis of a pleiotrophic molecule[J].Am J Clin Nutri,2002,76(5):1151S-1157S.
[4] Grillo M A,Colombatto S.S-Adenosylmethionine and its products[J].Amino Acids,2008,34(2):187-193.
[5] Park J,Tai J,Roessner C A,et al.Enzymatic synthesis ofS-adenosyl-L-methionine on the preparative scale[J].Bioorg Med Chem,1996,4(12):2179-2185.
[6] Park J,Tai J,Roessner C A,et al.Overcoming product inhibition ofS-adenosyl-L-methionine(SAM) synthetase:Preparation of SAM on the 30 mM scale[J].Bioorg Med Chem,1995,5(19):2203-2206.
[8] 牛卫宁,左晓佳,尚晓娅,等.固定化E.coliJM109(pBR322-MAT)细胞催化合成S-腺苷蛋氨酸[J].现代化工,2009,29(3):38-41.
[9] 田林奇,牛卫宁,左晓佳,等.S-腺苷甲硫氨酸合成酶的组成型表达、产物纯化及鉴定[J].中国生物工程杂志,2010,20(3):61-66.
[9] 牛卫宁,左晓佳,丁焰,等.重组大肠杆菌全细胞催化合成S-腺苷甲硫氨酸[J].精细化工,2009,26(3):288-292.
