蚤休薯蓣皂苷对内皮细胞的保护作用涉及TLR4/NF-κB途径
2012-07-28高琳琳李福荣姚树桐司艳红秦树存
高琳琳,李福荣,姚树桐,桑 慧,司艳红,焦 鹏,秦树存
(泰山医学院1.病理生理学教研室,2.药物化学教研室,3.动脉粥样硬化研究所,山东 泰安 271000)
动脉粥样硬化(atherosderosis,AS)是一种复杂的多因素疾病,内皮细胞功能障碍是AS形成的早期病变,内皮细胞损伤、炎症机制在动脉粥样硬化的发生和发展中起着极为重要的作用[1]。最近研究表明,非感染性甚至感染性因素引起的炎症反应和免疫系统的活化贯穿于AS的始终[2]。
近年研究表明介导先天免疫和炎症反应的受体Toll样受体4(TLR4)参与了 AS的发生和发展。TLR4与特异性自身配体结合后,通过髓样分化因子88(MyD88)依赖性或非依赖性信号转导途径激活下游一系列蛋白级联反应,将刺激信号转导至细胞核内,导致细胞核因子κB(nuclear factor kappa B,NF-κB)、活化蛋白-1、干扰素调节因子等重要免疫基因转录因子的活化,最终激发一系列针对不同病原微生物的免疫事件[3],而TLR4信号转导通路在AS发生和发展中的机制尚不明确。
本课题组前期实验中发现传统抗蛇毒药物蚤休能够减轻高脂血症大鼠动脉内皮细胞损伤,减少内皮细胞合成和释放内皮素以及抗H2O2诱导的凋亡[4-6],具有减轻动脉内皮细胞氧化损伤和抑制主动脉中膜平滑肌增殖的功效,从而具有防治AS和高血压病的作用。为了进一步探讨蚤休对内皮细胞氧化损伤的保护机制,深入研究中医药对TLR4及其下游信号转导通路的生物学特性及其调控机制的影响,从细胞和分子水平开展前瞻性的实验研究,本实验应用流式细胞仪PI染色、激光共聚焦显微镜JC-1染色及Western blot检测ox-LDL损伤前后对脐静脉内皮细胞细胞周期、线粒体电位、TLR4和NF-κB蛋白的表达的影响,旨在进一步探讨蚤休成分对细胞氧化损伤保护作用的机制及其相关信号转导通路。
1 材料与试剂
1.1 材料 蚤休薯蓣皂苷(Rhizome Dioscin,RD)由天津马克生物技术有限公司提供,人脐静脉内皮细胞株(HUVEC)与JC-1荧光染料购自南京凯基生物公司,兔抗人TLR4、NF-κB多克隆抗体购自武汉博士德公司,二抗羊抗兔IgG购自美国Santa Cruz公司,PI染液、JC-1染色试剂盒购于南京凯基生物科技发展有限公司。
1.2 ox-LDL的制备和鉴定[7]采用序列超速离心法分离健康人新鲜血浆低密度脂蛋白(low density lipoprotein,LDL),经琼脂糖电泳、十二烷基磺酸钠-聚丙烯酰胺凝胶电泳均显示为单一蛋白条带。提纯的LDL用不含乙二胺四乙酸(EDTA)的PBS液透析48 h,随后在含 10 μmol·L-1CuSO4的 PBS 液(pH 7.2)中37℃温育透析12 h,最后在含100 μmol·L-1EDTA的 PBS中4℃透析24 h。过滤除菌,BCA试剂定量蛋白,用 PBS调蛋白浓度至1 g·L-1,4℃保存备用。取氧化前后的 LDL,测定硫代巴比妥酸反应物质丙二醛(malondialdehyde,MDA)的浓度,并采用琼脂糖凝胶电泳鉴定ox-LDL的形成。
1.3 细胞培养及干预 将人脐静脉内皮细胞株(HUVEC)在37℃,5%CO2条件下培养,以含10%FBS的RPMI 1640培养液调整细胞密度,按每瓶2 ml接种于25 ml的细胞培养瓶,每48 h更换培养液1次。待细胞融合率为70% ~80%时,无血清培养12 h后使细胞同步化于G0期,然后按分组分别加药进行预处理24 h。细胞分组如下:正常对照组:不加任何药物的培养基;氧化损伤组:ox-LDL终浓度为100 mg·L-1;RD高、中、低剂量预处理组:(1 mg·L-1、100 μg·L-1、10 μg·L-1),加药预处理后加入ox-LDL,作用12 h。
2 方法
2.1 流式细胞仪PI染色分析各实验组细胞周期变化 37℃温箱取出各处理组细胞培养瓶,胰蛋白酶消化,分别收集细胞放入试管中。将试管以1 000 r·min-1离心 5 min,弃上清液,加入 4℃ PBS,涡旋方式混匀,再离心,洗涤细胞2次。将4℃ 70%的乙醇约0.5 ml贴壁缓慢加入试管中,固定细胞。以1 800 r·min-1离心细胞悬浮液5 min,倾去固定液。再加PBS离心洗涤细胞1次。每毫升106细胞加入500 U的RNA酶,使终浓度为50 mg·L-1,37℃保温30 min。离心去除RNA酶,再经PBS洗1次,去上清液。每106细胞加50 mg·L-1的 PI 1 ml,室温下避光染色20 min以后,300目尼龙网过滤。上流式细胞仪测定(激发波长488 nm,氢离子激光),用multcycleDNA分析软件包进行细胞周期分析。
2.2 JC-1染色检测线粒体膜电位 盖玻片培养细胞于6孔板,药物处理结束,PBS洗涤,加入500 μl JC-1工作液,培养箱中孵育15~20 min,孵育液洗涤,取出盖玻片于荧光显微镜下观察拍照。当膜电位水平较高时,JC-1主要以聚合体形式存在,呈红色荧光,当膜电位水平较低时,主要以单体形式存在,呈绿色荧光。通过Image ProPlus图像分析软件测定细胞内的红色和绿色荧光强度,相对定量线粒体膜电位水平。
2.3 Western blot法检测蛋白的表达 细胞接种于25 mm培养瓶内,在各处理因素作用后,预冷的PBS洗2次,加入 65 μl细胞裂解液,4℃静置30 min,1 200 r·min-1离心 10 min,取上清,BCA 法进行蛋白定量。总蛋白经SDS-PAGE分离后,转移至PVDF膜上,用5%脱脂奶粉室温封闭2 h,随后加入1∶1 000稀释的兔抗人的抗体,轻摇过夜,用TBST洗3次,加入相应的二抗,室温孵育1 h,漂洗3次,ECL显色后,用Image软件进行灰度分析。
3 结果
3.1 实验各组药物对细胞周期的影响 各实验组DNA倍体分析图可见,损伤组G0/G1期细胞比例明显高于对照组、S期细胞百分比低于对照组(P<0.01),而RD各浓度组预处理后,G0/G1期细胞比例低于对照组、S期细胞百分比明显高于对照组(P<0.05或P<0.01),见流式细胞仪PI染色DNA倍体分析结果(Fig 1、2)。
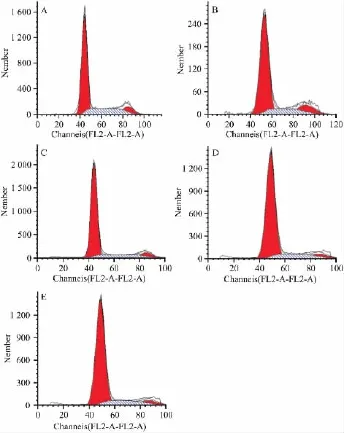
Fig 1 Effect of RD on cell cycle of HUVEC observed by flow cytometry A:Normal control;B:injured group;C:10 μg·L-1RD;D:100 μg· L-1 RD;E:1 mg·L-1RD
3.2 激光共聚焦显微镜JC-1染色检测细胞线粒体跨膜电位(ΔΨm)的变化 与正常对照组相比,ox-LDL损伤组红色荧光强度减弱而呈现较为鲜亮的绿色,显示线粒体对JC-1摄取量下降,表明ox-LDL引起线粒体跨膜电位降低,导致电位去极化的发生。RD预处理24 h的HUVEC,同阴性对照组相比膜电位升高,细胞着色逐渐向红色过渡,见Fig 3。
3.3 实验各组TLR4和NF-κB表达的变化 结果表明,经ox-LDL诱导,TLR4和NF-κB的表达增多,而RD各组均可抑制TLR4和NF-κB的表达 其中RD低剂量组与ox-LDL损伤组各指标相差不明显,RD中高剂量组较损伤组则有明显差异,见Fig 4、5。
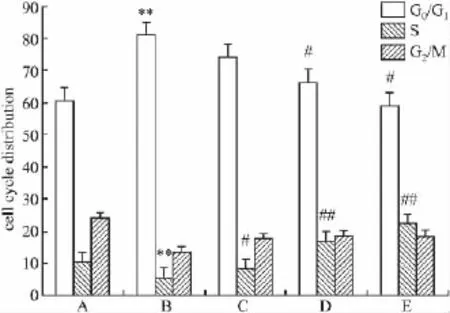
Fig 2 Ratio of cell cycle distribution of RD of HUVEC observed by flow cytometry
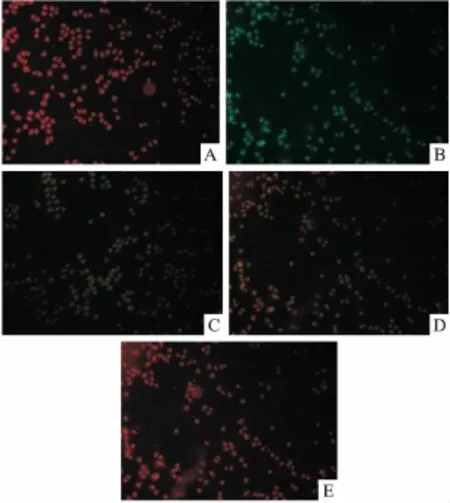
Fig 3 Effect of RD on mitochondrial membrane potential(ΔΨm)of HUVEC observed by laser scanning confocal microscope
4 讨论
蚤休为百合科多年生草本植物蚤休及其同属植物的根茎,药用历史悠久,具有清热解毒、消肿止痛、凉肝定惊等功效,是著名的中成药“云南白药”的成分之一。常用于治疗痈肿、咽喉肿痛、毒蛇咬伤、惊风抽搐等。蚤休化学成分复杂,主要包括有甾体、脂肪酸酯、黄酮类及多糖。蚤休主要有效成分是甾体皂苷,文献报道及本课题组前期实验均证实皂苷有较强的抗氧化和抗炎症损伤的药理活性。

Fig 4 Effect of RD on TLR4 expression in protein level of HUVEC by Western blot
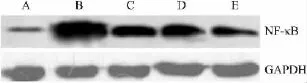
Fig 5 Effect of RD on NF-κB expression in protein level of HUVEC by Western blot
目前动脉粥样硬化(AS)被认为是一种在发病起始和整个过程中都伴有免疫反应的慢性炎症性疾病过程,大量流行病学临床病理学和动物模型的研究均提示,TLR4在AS的发生、发展中起着重大作用。TLR4通过激活天然免疫,参与特异性免疫应答的启动,促进炎症的发展,在AS中发挥了重要作用。同时在AS发展过程中血管平滑肌细胞(VSMC)发生增殖、迁移,并分泌细胞因子、趋化因子、蛋白酶等,促进 AS的发生、发展。此外,TLR4与VSMC之间存在一定的相互作用,对AS的不同阶段产生影响。
研究发现 ,与正常血管相比,AS病变中的TLR4表达明显增加。体外培养的人血管内皮细胞在基础条件下TLR4表达很低,但经促炎因子刺激,TLR4表达明显升高[8]。此外,在早期AS病变中血管平滑肌细胞迁移至内膜下转变为泡沫细胞,在此过程中血管中层平滑肌细胞中TLR4表达上调。而ox-LDL等TLR4内源性配体与TLR4结合后,致使TLR4的表达增加以及 TLR4信号转导途径激活[9]。Edfeldt等[10]在AS的斑块中发现TLR4的表达明显提高,并证实正是通过 TLR4的识别功能导致一系列与AS有关的细胞因子的合成与释放TLR4激活所生成的炎症因子 IL-6、IL-1和TNF-α等能刺激血管平滑肌细胞的迁移及增殖。
JC-1是一种广泛用于检测线粒体膜电位(mitochondrial membrane potential)ΔΨm的理想荧光探针。可以检测细胞、组织或纯化的线粒体膜电位。在线粒体膜电位较高时,JC-1聚集在线粒体的基质(matrix)中,形成聚合物(J-aggregates),可以产生红色荧光;在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体(monomer),可以产生绿色荧光。线粒体电位去极化导致荧光染料的摄入量下降是大多数细胞凋亡的早期事件,其发生意味着线粒体功能发生损伤[11]。本研究结果发现,与正常对照组细胞着色为亮红色不同,ox-LDL可导致HUVEC的线粒体膜电位下降,细胞呈现鲜亮的绿色,而RD处理后,随着药物浓度增加逐渐向红色过渡,因此RD能够抑制ox-LDL诱导的ΔΨm下降。
本研究发现,ox-LDL氧化损伤的HUVEC的TLR4的表达明显增加,且这种增加可能与其血浆中ox-LDL等修饰脂蛋白增加有关,实验结果表明,RD作用后,HUVEC的氧化凋亡下降,细胞周期阻滞解除,线粒体膜电位恢复,表现为S期细胞比率增加,JC-1染色显示线粒体膜电位呈浓度依赖性明显升高,且TLR4及其下游信号转导途径中的NF-κB表达明显减弱,这提示RD具有抑制ox-LDL诱导的HUVEC发生凋亡的作用,其机制可能部分与TLR4/NF-κB信号转导途径的激活、稳定线粒体膜电位、保护线粒体功能、从而抑制内皮细胞凋亡有关。TLR4信号转导途径在AS发生当中有着重要作用,该信号途径的激活至少是 AS发生当中的一个重要环节[10],通过对 TLR4及其下游信号转导途径在AS发生、发展中所起作用的认识,有助于人们找到治疗AS性疾病新的治疗策略。因此,开发靶点特异、高效的TLR4拮抗药物,可望为AS的中医药治疗及其机制研究提供新的切入点。结合本实验研究结果提示,RD是一种具有多方位内皮保护效应的药物,在抑制 TLR4/NF-κB途径的激活,阻断内皮细胞氧化损伤、细胞周期阻滞,继而阻断AS的发生发展,尤其是预防上具有潜在的应用价值。至于RD对蛋白表达调控具体的信号转导机制还有待进一步研究。
[1] Ross R.Atherosclerosis-An inflammation disease[J].N Engl J Med,1999,340(2):115 -23.
[2] Doyle S L,O’Neill L A.Toll-like receptors:from the discovery of NFkappaB to new insights into transcriptional regulations in innate immunity[J].Biochem Pharmacol,2006,72(7):1102 -13.
[3] Youn H S,Lee J Y,Saitoh S I,et al.Suppression of MyD88 and TRIF-dependent signaling pathways of Toll-like receptor by(-)-epigallocatechin-3-gallate,a polyphenol component of green tea[J].Biochem Pharmacol,2006,72(7):850 -9.
[4] 杜艳芝,闫晓梅,胡维诚,等.清热解毒液对高脂血症大鼠内皮素影响的研究[J].中国病理生理杂志,1999,15(12):1134-7.
[4] Du Y Z,Yan X M,Hu W C,et al.The effect of heat-clearing and detoxifying fluid on endothelin in hyperlipidemic rats[J].Chin J Pathophysiol,1999,15(12):1134 -7.
[5] 高琳琳,李福荣,康 莉,等.蚤休醇提物对 H2O2损伤的ECV304细胞的细胞周期与凋亡的影响[J].中国药理学通报,2008,24(11):1513 -8.
[5] Gao L L,Li F R,Kang L,Wang H.Effects of bistortae ethanol extraction on cell cycle and apoptosis of ECV304 injured by hydrogen peroxide[J].Chin Pharmacol Bull,2008,24(11):1513 -8.
[6] 高琳琳,李福荣,康 莉,王 浩.蚤休皂苷对过氧化损伤导致的ECV304细胞凋亡的作用机制研究[J].中国老年学杂志,2009,29(3):274 -7.
[6] Gao L L,Li F R,Kang L,Wang H.Effects of Pariphyllin on injury induced by hydrogen peroxide on apoptosis in ECV304[J].Chin J Gerontol,2009,29(3):274 -7.
[7] Cominacini L,Garbin U,Davoli A,et al.A simple test for predisposition to LDL oxidation based on the fluorescence development during copper-catalyzed oxidative modification[J].J Lipid Res,1991,32(2):349 -58.
[8] Wu J,Zhou J,Chen X,et al.Attenuation of LPS-induced inflammation by ICT,a derivate of icariin,via inhibition of the CD14/TLR4 signaling pathway in human monocytes[J].Int Immunopharmacol,2012,12(1):4 -9.
[9] Guerrero A T,Cunha T M,Verri WA Jr,et al.Toll-like receptor 2/MyD88 signaling mediates zymosan-induced joint hypernociception in mice:participation of TNF-α,IL-1β and CXCL1/KC[J].Eur J Pharmacol,2012,674(1):51 -7.
[10] Edfeldt K,Bennet A M,Eriksson P,et al.Association of hyporesponsive toll-like receptor 4 variants with risk of myocardial infarction[J].Eur Heart J,2004,25(16):1447 - 53.
[11]侯金才,张 鹏,刘建勋,等.栀子苷对缺氧/复氧小胶质细胞TLR4通路的影响[J].中国药理学通报,2011,27(6):769 -73.
[11] Hou J C,Zhang P,Liu J X,et al.Geniposide on TLR4 pathway in cultured rat microglia with hypoxia/reoxygenation[J].Chin Pharmacol Bull,2011,27(6):769 -73.