循环内皮祖细胞与急性脑梗死及脑血管病危险因素的相关性研究
2012-07-28屈新辉刘诗英谢旭芳高幼奇吴晓牧张昆南
屈新辉 刘诗英 何 丹 谢旭芳 高幼奇 吴晓牧 张昆南▲
1.江西省人民医院神经内科,江西 南昌 330006;2.江西省人民医院中心实验室,江西 南昌 330006
动脉粥样硬化是缺血性脑血管病的最主要原因,可引起颅内外段脑供血动脉的狭窄及继发血栓形成,导致脑梗死。动脉粥样硬化的早期病理改变表现为血管内皮功能异常[1]。内皮祖细胞(EPCs)是一类能增殖并分化为血管内皮细胞的前体细胞[2],在血管修复和维持内皮功能完整中具有重要作用[3]。近年文献报道,循环EPCs数量和功能与心血管危险因素相关[2,4]。本研究旨在观察外周血EPCs数量与急性脑梗死及脑血管危险因素的关系。
1 资料与方法
1.1 一般资料
选择2009年1月~2010年12月于我院神经内科就诊和住院患者,其中,急性脑梗死患者(脑梗死组)145例,脑血管危险因素患者(危险因素组)118例。脑梗死组患者均符合全国第四届脑血管病学术会议修订的脑梗死诊断标准,均为发病时间≤24 h的首次发病患者并全部经头部CT或MRI证实。危险因素组为有脑血管病危险因素但无脑血管事件的患者。两组均排外感染、肿瘤、免疫性疾病、肝肾功能不全患者。对照组99例系同期门诊健康体检者,无高血压、血脂异常、脑卒中史、糖尿病史、肿瘤、肝肾疾病、免疫性疾病和感染性疾病史。
表1 三组一般情况、临床及实验室检验指标比较()

表1 三组一般情况、临床及实验室检验指标比较()
注:与对照组比较*P<0.05;1 mm Hg=0.133 kPa
组别 性别(男/女,例)年龄(岁)SBP(mm Hg)DBP(mm Hg)HbA1c(mmol/L)CHO(mmol/L)TG(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)脑梗死组(n=145)危险因素组(n=118)对照组(n=99)89/56 73/45 61/38 64.58±7.07 65.03±6.83 63.67±6.49 164.97±20.21*168.62±21.75*137.11±16.75 91.54±9.85*94.46±9.41*82.55±8.79 6.28±1.79*6.97±1.52*5.01±1.29 5.38±1.09 5.16±1.24*4.86±1.54*1.62±0.79 1.71±0.81 1.53±0.66 1.48±0.66*1.51±0.68*1.61±0.71 3.83±0.91*3.94±0.96*3.07±0.85
1.2 方法
1.2.1 记录研究对象基本特征 包括年龄、性别、收缩压、舒张压、糖化血红蛋白(HbA1c)、血总胆固醇(CHO)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)和美国国立卫生研究院卒中量表(NIHSS)评分。
1.2.2 流式细胞仪检测EPCs 取外周血50 μL加入5 μL PE标记的抗人CD133及3 μL PerCP/Cy5.5标记的抗人KDR,4℃冰箱中避光孵育30 min,试管中加入红细胞裂解液500 μL避光孵育10 min,加入PBS 1~2 mL,以1 500 r/min离心10 min,去上清,加入500 mL PBS缓冲液使细胞重新悬浮,通过流式细胞仪计数CD133、KDR双阳性细胞作为EPC的百分比。检测时用PE-IgG1及PerCP/Cy5.5-IgG1作为同型对照。
1.3 统计学方法
采用SPSS 11.5统计学软件进行数据分析,计量资料数据用均数±标准差()表示,多组间的比较采用单因素方差分析,组间两两比较采用LSD-t检验;相关性分析采用Pearson检验。以P<0.05为差异有统计学意义。
2 结果
2.1 三组一般情况、临床及实验室检验指标比较情况
三组患者年龄、性别一般情况比较差异无统计学意义(P>0.05)。脑梗死组和危险因素组收缩压(SBP)、舒张压(DBP)、HbA1c、CHO、LDL-C 水平均显著 高于 正常对照组,HDL-C显著低于正常对照组,差异均有统计学意义(均P<0.05)。见表1。
2.2 三组循环EPC数量比较
与对照组比较,脑梗死组和危险因素组循环EPC数量均明显减少,差异有统计学意义(均P<0.01);脑梗死组循环EPC数量较危险因素组高,但差异无统计学意义(P=0.0578)。见表2。
表2 三组循环EPC数量比较(,%)
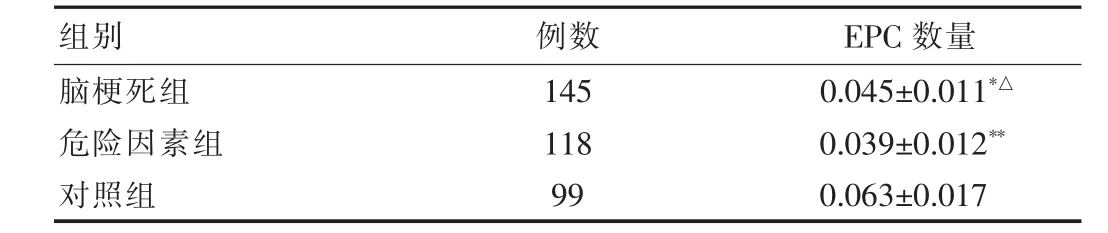
表2 三组循环EPC数量比较(,%)
注:与对照组比较,*P<0.05,**P<0.01;与危险因素组比较△P<0.05
组别 例数 EPC数量脑梗死组危险因素组对照组145 118 99 0.045±0.011*△0.039±0.012**0.063±0.017
2.3 循环EPC数量与脑血管危险因素的关系
以循环EPC数量为因变量行非参数Pearson相关分析,结果显示,脑梗死组 EPC 数量与 SBP、DBP、HbA1c、CHO、LDLC 水平呈显著负相关(r=-0.358、-0.176、-0.264、-0.165、-0.283,均 P < 0.05),与 HDL-C 呈显著正相关(r=0.172,P < 0.05);危险因素组EPC数量与SBP、HbA1c、CHO、LDL-C水平呈显著负相关 (r=-0.378、-0.259、-0.248、-0.251, 均 P < 0.05),与HDL-C 呈显著正相关(r=0.169,P<0.05);两组 EPC 数量均与年龄、TG无相关性(均P>0.05)。见表3。

表3 循环EPC数量与脑血管危险因素的关系
2.4 脑梗死组与循环EPC数量NIHSS评分的关系
脑梗死组循环EPC数量与NIHSS评分呈显著负相关(r=-0.706,P < 0.05)。
3 讨论
脑梗死是一种多危险因素疾病,即各种血管危险因素引起内皮细胞损伤和功能不全,启动动脉粥样硬化地形成而发生动脉粥样硬化性脑梗死。在正常情况下内皮损伤和骨髓来源的EPCs修补之间存在动态平衡,以维持内膜完整性。一些研究发现,在血管危险因素、组织缺血、血管损伤等病理性刺激下循环EPCs可发生变化[5]。
2004年Taguchi等[6]首次报道5例急性脑梗死患者脑梗死病灶数目与循环CD34+、CD133+细胞数值呈明显的负相关。2005年Ghani等[7]发现,急性缺血性脑卒中患者发病后4 h外周血EPC数量与正常对照组比较有明显下降。最近一些研究也提示,急性脑卒中患者EPC数量与神经功能评分相互关联,脑卒中48 h后神经功能严重缺损患者较神经功能轻微缺损患者EPC数量明显减少,而且急性脑卒中后循环EPC数量增加预示疾病预后较好[8-10]。Sobrino等[11]分别对脑卒中急性期、稳定期及短暂性脑缺血发作、健康人群的外周血EPC数量进行测定发现,前3组患者EPC数量比健康人群显著下降,且3组间差异无统计学意义(P>0.05)。本研究亦得出同样结果,急性脑梗死和脑血管危险因素患者EPCs数量明显下降(P<0.01),且EPCs数量与NIHSS评分呈显著负相关(P<0.05);但本研究还发现,急性脑梗死患者和脑血管危险因素患者EPCs数量差异无统计学意义(P=0.057 8),但急性脑梗死后EPCs数量有增加趋势,认为脑梗死时脑组织损伤,组织缺氧、缺血会增强骨髓EPCs迁移至外周血,使外周血EPCs数量增加,从而应对血管损伤应激需要[12]。
本研究结果发现,急性脑梗死组和脑血管危险因素组EPCs数量与血压、HbA1c、CHO、LDL-C水平呈显著负相关,与HDL-C呈显著正相关,与年龄、TG无相关性。分析原因可能为高血压状态下肾素-血管紧张素-醛固酮系统(RAAS)机能亢进,血管紧张素Ⅱ通过诱导氧化应激反应抑制EPCs分化,抑制EPCs端粒酶活性,加速EPCs老化,且这种作用可被血管紧张素受体拮抗剂所抑制[13]。另外,醛固酮可通过抑制血管内皮生长因子(VEGF)的释放及影响蛋白激酶B(Akt)信号传导,抑制EPCs增殖、分化。高血糖及其作用的产物可通过多种信号途径影响EPCs,高糖本身和其介导的氧化应激可使EPCs的磷脂酰肌醇3激酶 (PI3-K)/蛋白激酶B(PKB/Akt)通路受阻,从而影响EPCs的分化;高糖介导的胰岛素B细胞转录因子(FoxO)磷酸化/乙酰化失衡,可能使FoxO蛋白表达增加,上调前凋亡基因表达,造成EPCs凋亡[14];糖基化终产物AGEs聚积改变骨髓和修复靶点的微环境,影响EPCs的动员和归巢[15]。另外,在胰岛素抵抗时,高浓度胰岛素使胰岛素受体底物(IRS)和PI3K/Akt通路受阻,抑制内皮一氧化氮合酶(eNOS)磷酸化,减少NO释放,损害EPCs的功能[16]。另有研究显示,在血胆固醇增高的个体EPCs集落数量明显减少,且氧化LDL-C是高胆固醇血症患者EPCs数量功能改变的主要原因[17-18]。LDL-C也通过中间代谢产物氧化LDL-C影响端粒酶活性,降低EPCs的存活率;通过Akt失活,降低VEGF诱导的EPCs分化,而且氧化LDL-C对EPCs的负性作用还有一定的量-效关系[19]。而HDL-C对EPCs具有保护作用,体外培养时HDL-C通过增加eNOS和降低前MMP-9表达来保护EPCs凋亡;在体内主要是通过抑制半胱氨酸天冬氨酸特异性蛋白酶-3(Caspase-3),减少EPCs凋亡,维持 EPCs的数量[20]。
总之,循环EPCs数量减少与急性脑梗死显著相关,EPCs数量越少神经功能缺损评分越低,且EPCs数量与脑血管病危险因素相关,而脑梗死后可能有骨髓EPCs的有限动员。
[1]Lerman A,Zeiher AM.Endothelial function: cardiac events[J].Circulation,2005,111(3):363-368.
[2]Hill JM,Zalos G,Halcox JP,et al.Circulating endothelial progenitor cells,vascular function, and cardiovascular risk[J].N Engl J Med,2003,348(7):593-600.
[3]Werner N,Junk S,Laufs U,et al.Intravenous transfusion of endothelial progenitor cells reduces neointima formation after vascular injury[J].Cire Res,2003,93(2):l7-24.
[4]Vasa M,Fichtlscherer S,Aicher A,et al.Number andmigratory activity of circulating endothelial progenitor cells inversely correlate with risk factors for coronary artery disease[J].Circ Res,2001,891:1-7.
[5]Mihail H,Wolfgang Er,Peter CW,et al.Endothelial progenitor cells mobilization, differentiation,and homing[J].Arterioscler Thromb Vasc Bio J,2003,23:1185-1189.
[6]Taguchi A,Matsuyama T,Moriwaki H,et al.Circulating CD34-positive cells provide an index of cerebrovascular function[J].Circulation,2004,109:2972-2975.
[7]Ghani U,Shuaib A,Salam A,et al.Endothelial progenitor cells during cerebrovascular disease[J].Stroke,2005,36:151-153.
[8]Yip HK,Chang LT,Chang WN,et al.Level and value of circulating endothelial progenitor cells in patients after acute ischemic stroke[J].Stroke,2008,39(1):69-74.
[9]Fadini GP,Coracina A,Baesso I,et al.Peripheral blood CD34+KDR+endothelial progenitor cells are determinants of subclinical atherosclerosis in a middle-aged general population[J].Stroke,2006,37(9):2277-2282.
[10]Chu K,Jung KH,Lee ST,et al.Circulating endothelial progenitor cells as a new marker of endothelial dysfunction or repair in acute stroke[J].Stroke,2008,39(5):1441-1447.
[11]Sobrino T,Hurtado O,Moro MA,et al.The increase of circulating endothelial progenitor cells after acute ischemic stroke is associated with good outcome[J].Stroke,2007,38(10):2759-2764.
[12]Cho HJ,Lee N,Lee JY,et al.Role of host tissues for sustained humoral effects after endothelial progenitor cell transplantation into the ischemic heart[J].J Exp Med,2007,204(13):3257-3269.
[13]Imanishi T,Moriwaki C,Hano T,et al.Endothelial progenitor cell senescence is accelerated in both experimental hypertensive rats and patients with essential hypertension[J].J Hypertens,2005,23(10):1831-1837.
[14]Balestrieri ML,Rienzo M,Felice F,et al.High glucose downregulates endothelial progenitor cell number via SIRT1[J].Biochim Biophys Acta,2008,1784(6):936-945.
[15]Krankel N,Adams V,Linke A,et al.Hyperglycemia reduces survival and impairs function of circulating blood-derived progenitor cells[J].Arterioscler Thromb Vasc Biol,2005,25:698-703.
[16]Cubbon RM,Rajwani A,Wheatcroft SB.The impact of insulin resistance on endothelial function,progenitor cells and repair[J].Diab Vasc Dis Res,2007,4(2):103-111.
[17]Tso C,Martinic G,Fan WH,et al.High-density lipoproteins enhance progenitor-mediated endothelium repair in mice[J].Arterioscler Thromb Vasc Biol,2006,26(5):1144-1149.
[18]朱军慧,陈君柱,王兴祥,等.氧化低密度脂蛋白对外周血内皮祖细胞数量和功能的影响[J].中华内分泌代谢杂志,2005,21(1):13-17
[19]Imanishi T,Hano T,Matsuo Y,et al.Oxidized low-density lipoprotein inhibits vascular endothelial growth factor-induced endothelialprogenitor celldifferentiation[J].Clin Exp Pharmacol Physiol,2003,30:665-670.
[20]Noor R,Shuaib U,Wang CX,et al.High-density lipoprotein cholesterol regulates endothelial progenitor cells by increasing eNOS and preventing apoptosis[J].Atherosclerosis,2007,192:92-99.
