奥曲肽对重症急性胰腺炎大鼠枯否细胞m2极化功能的调节作用
2012-07-25牟佼,孙辉,丁震,刘俊
牟 佼,孙 辉,丁 震,刘 俊
1.华中科技大学附属协和医院消化内科,湖北武汉430022;2.陕西省西安市中心医院消化内科
重症急性胰腺炎(severe acute pancreatitis,SAP)是临床常见危重症,普遍认为炎性因子的产生及其级联的“瀑布效应”是胰腺由局部炎症发展为威胁生命的全身炎症的关键。临床上奥曲肽多年来被用于急性胰腺炎的治疗,但其治疗机制并不十分清楚。近来有大量研究表明肝脏Kupffer细胞可能是急性胰腺炎时炎性因子的主要来源,我们从奥曲肽治疗SAP时血清和Kupffer细胞内的炎症因子的动态变化着手,探讨肝Kupffer细胞在SAP中的作用及奥曲肽对Kupffer细胞m2极化功能的调节作用,为临床应用奥曲肽治疗急性胰腺炎奠定理论基础。
1 材料与方法
1.1 材料 健康雄性SD大鼠36只(购自华中科技大学同济医学医院动物中心),体质量200~250 g。奥曲肽购自Novartis Pharma Schweiz AG公司,牛黄胆酸钠购自ACROS ORGANICS,胶原酶Ⅳ购自GIBCO公司,Percoll液购自GE Healthcare Bio-Science AB公司,免疫荧光抗体F4/80购自Abcam公司,DAB染色剂购自武汉生命科技有限公司,Elisa试剂盒购自 ebioscience公司。
1.2 方法
1.2.1 分组及造模:随机分为6组:假手术组(S)、SAP组、奥曲肽治疗组(ST)、生理盐水治疗组(NT)、奥曲肽预防组(SP)、生理盐水预防组(NP)。实验前12 h禁食不禁水,1%戊巴比妥钠腹腔注射麻醉大鼠进行无菌手术,开腹后,将靠近肝门段的胆胰管先以小动脉夹予以夹闭,经胰管逆行缓慢注射5%牛黄胆酸钠,注射完毕后退出针头用手压迫进针处约3 min。观察胰腺出现均匀性的出血、肿胀、渗出,确定SAP模型成功,关腹。假手术组开腹后仅翻动肠道数次后关腹。奥曲肽治疗组于造模后0、8、16 h腹部皮下注射奥曲肽 20 μg/μL,奥曲肽预防组造模前 1 h,造模后 8、16 h腹部皮下注射奥曲肽,它们的对照组分别于相同的时间点腹部皮下注射等量生理盐水。
1.2.2 Kupffer细胞的分离和提取:24 h后麻醉大鼠开腹,下腔静脉取血,3 000 r/min,离心20 min,取血清置-70℃冷藏备用。门静脉插管手术缝线固定,先用无Ca2+Mg2+的HBSS液250 mL匀速灌注,冲洗肝脏内的红细胞;再用含0.02%胶原酶Ⅳ的HBSS液750 mL匀速缓慢灌注,注意保持灌注温度(37℃),尽量保证肝包膜完整,待肝脏变软结构塌陷,将其完整分离,浸泡入50 mL HBSS液中,移入超净台进行分离和提取Kupffer细胞。将肝包膜撕去,用加样枪反复吹打液体使细胞充分悬浮,再将其倒入50 mL离心管,70×g,3 min离心,留沉淀;取上清继续70×g,3 min离心,弃沉淀,留上清;将上两步的沉淀和上清混匀,650×g,7 min离心,取沉淀;在15 mL离心管中先加入50%Percoll液4 mL,再缓慢加入25%Percoll液4 mL,最后将2 mL细胞液缓慢加入最上面,1 800×g,15 min,将离心机的brake调为0;离心后管内液体分为四层,最上层为星状细胞、内皮细胞等,最下层为破碎的红细胞,都弃去,用玻璃滴管吸取中间两层,再650×g,7 min离心,弃去上清则为所需的较纯 Kupffer细胞。将Kupffer细胞用20%培养液培养1 h,弃去上清液,贴壁的为Kupffer细胞。
1.2.3 Kupffer细胞的鉴定:DAB染色和免疫荧光染色,光镜下计数,台盼蓝染色计算存活率。DAB染色实验:Kupffer细胞培养2 h后,将6孔板中的上清液吸尽,1.5%戊二醛固定10 min,吹干;用PBS洗2次,每次 3 min ,0.05%DAB+0.03%H2O2混合后立即使用;室温下作用显微镜下立即观察,黄染呈“煎蛋样”的细胞为Kupffer细胞(见图1)。
免疫荧光染色:F4/80一抗1∶100稀释,每孔100 μL,4℃过夜;FITC羊抗兔二抗1∶100稀释,每孔100 μL,室温1 h,避光;hoechst33258 染色液 1∶1000 稀释,每孔100 μL,室温10 min避光。
1.2.4 血清中 TNF-ɑ、IL-4、IL-10 水平的检测:采用ELISA法,按照试剂说明书操作,酶标仪读值后绘制标准曲线,计算因子浓度。
1.2.5 肝 Kupffer细胞内 TNF-ɑ、IL-4、IL-10 表达的检测:用Trizol提取Kupffer细胞内的RNA。RT-PCR法进行检测。PCR反应条件:95℃10 min、95℃15 s、60℃ 1 min,40个循环。引物由上海英骏公司合成,序列如下:GAPDH:上游:5'-GTATGACTCTACCCACGGCAAGT-3';下游:5'-TTCCCGTTGATGACCAGCTT-3'。TNF-ɑ:上游:5'-CCGATTTGCCACTTCATACCA-3';下游:5'-TAGGGCAAGGGCTCTTGATG-3'。IL-4:上游:5'-CAGACGTCCTTACGGCAACA-3';下游:5'-CTGGAAGCCCTGCAGATGA-3'。IL-10:上游:5'-AGAAGGACCAGCTGGACAACAT-3';下游:5'-CAAGTAACCCTTAAAGTCCTGCAGTA-3'。
1.2.6 胰腺组织病理学检查:取胰腺组织4%多聚甲醛固定,石蜡包埋,HE染色后显微镜观察。
1.3 统计学分析 用SPSS 17.0统计软件进行分析,所有数据以均值±标准差(±s)表示,采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 Kupffer细胞成功培养及鉴定 特异性标记抗体F4/80免疫荧光染色可见呈现不规则多边形的Kupffer细胞,用细胞计数板计数 Kupffer细胞约为(4~7)×106,细胞存活率>87%(见图2)。
2.2 胰腺病理改变 光镜下假手术组胰腺组织大致正常。SAP组可见大量出血、间质水肿、炎细胞浸润、小叶轮廓消失,甚至满视野充满红细胞,腺细胞成大片状坏死。NT组和NP组可见胰腺腺泡坏死、出血、大量炎细胞浸润。ST组和SP组炎症反应明显减轻(见图3)。

图1 DAB染色“煎蛋样”Kupffer细胞(SP 400×);图2 免疫荧光染色可见不规则多边形的Kupffer细胞(SP 400×);图3 各组胰腺病理改变(SP 400×)A:SAP组;B:生理盐水治疗组;C:生理盐水预防组;D:假手术组;E:奥曲肽治疗组;F:奥曲肽预防组Fig 1 “Omelette-like”Kupffer cells by DAB staining(SP 400×);Fig 2 Immunofluorescence staining showed Kupffer cells of irregular polygons(SP 400×);Fig 3 Pathological changes of the pancreas with S,SAP,Octreotide and normal saline groups(SP 400×)A:SAP group;B:NS therapy group;C:NS prophylaxis group;D:S group;E:Octreotide therapy group;F:Octreotide prophylaxis group
2.3 血清中 TNF-α、IL-4、IL-10水平检测 SAP组、生理盐水治疗组和预防组TNF-α的水平明显升高,与奥曲肽治疗组相比差异显著(P<0.05或0.01),与奥曲肽预防组比较并无明显差异。奥曲肽治疗组和预防组IL-4水平明显增高,与其他组相比有显著差异(P<0.01),而其两组之间IL-4水平无差异。IL-10水平在奥曲肽治疗组明显升高,与SAP组、生理盐水治疗组和预防组相比差异显著(P<0.01),而IL-10水平在奥曲肽预防组并未见明显升高,与奥曲肽治疗组相比有明显差异(P<0.05,见表1)。
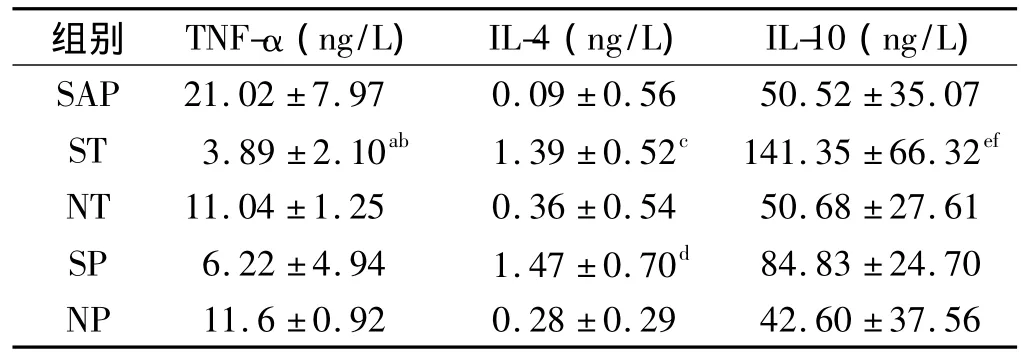
表1 血清中 TNF-α、IL-4、IL-10 水平 (x- ± s)Tab 1 Levels of TNF-α,IL-4 and IL-10 in serum(x- ± s)
2.4 奥曲肽可诱导Kupffer细胞的m2极化 与假手术组相比,TNF-α在SAP组的表达明显上升(P<0.01),而其在奥曲肽治疗组和预防组的表达明显降低,与假手术组、SAP组比较差异显著(P<0.01)。IL-4的表达量SAP组与假手术组相比明显下降(P<0.01),而其在奥曲肽治疗组和预防组的表达量明显上升,与SAP组、生理盐水治疗组和预防组相比差异显著(P<0.05或0.01)。SAP组与假手术组相比,IL-10的表达量显著降低(P<0.01),而其表达量在奥曲肽治疗组和预防组明显升高,与假手术组、SAP组、生理盐水治疗组和预防组相比差异明显(P<0.01或0.05)(见表2)。
表2 Kupffer细胞中 TNF-α,IL-4,IL-10 表达水平(±s)Tab 2 Expression levels of TNF-α,IL-4 and IL-10 in Kupffer cells(±s)

表2 Kupffer细胞中 TNF-α,IL-4,IL-10 表达水平(±s)Tab 2 Expression levels of TNF-α,IL-4 and IL-10 in Kupffer cells(±s)
与S组、ST组和SP组相比,aP<0.01;与SAP组、NT组和NP组相比,bP <0.01,cP <0.05;与 SAP 组相比,fP <0.01,与 S组、SAP组、NT组和 NP组相比,dP <0.01,eP<0.05
组别 TNF-α(ng/L)IL-4(ng/L)IL-10(ng/L)S 1.00 ±0.10 1.03 ±0.28b 1.004 ±0.09f SAP 10.61 ±1.18a 0.01 ±0.002 0.17 ±0.23 ST 0.33 ±0.08 1.60 ±0.57c 5.21 ±1.10d NT 3.24 ±2.30 0.003 ±0.001 0.66 ±0.12 SP 0.31 ±0.06 0.6 ±0.17b 26.44 ±11.83e NP 21.6 ±12.55 0.08 ±0.02 1.02 ±0.35
3 讨论
重症急性胰腺炎实质上是一种严重的全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),普遍认为各种有害物质.致病因子刺激胰腺腺泡细胞,引起细胞损伤,导致胰酶释放,激活中性粒细胞和巨噬细胞释放大量炎性因子,而这些因子通过“扳机样作用”产生连锁和放大效应,导致多器官损伤。那么在SAP中这些炎症因子主要是从哪里产生的呢?
肝Kupffer细胞是人体组织内的最大定居巨噬细胞群,约占巨噬细胞的80% ~90%。SAP时,胰腺组织大量坏死,导致胰酶异常激活后进入血液,同时释放大量的炎症因子,而胰腺的血液必须先经过肝脏的处理后才入体循环,所以Kupffer细胞在胰腺炎的发生发展中的作用越来越受到关注。Gloor等[1-2]的研究表明SAP时,肝脏在处理各种有毒物质和炎性因子过程中,会激活Kupffer细胞内的信号转导通路,导致其释放大量炎症介质,在SAP的发展中起到关键作用。
Folch-puy等[3]报道了门体断流术可以预防急性胰腺炎模型中肺损伤的发生;随后又有多项实验结果显示急性胰腺炎时肝静脉中细胞因子的浓度明显高于门静脉[4];进一步人们用Kupffer细胞的特异性抑制剂氯化钆可以预防SAP所致的呼吸衰竭[5]。而大量实验也表明活化的Kupffer细胞可产生大量细胞因子,例如TNF-α、IL-1β、IL-6等,这些因子增加毛细血管的通透性,促进白细胞的黏附、聚集和渗出,导致多器官的损害,阻断Kupffer的这些作用能明显改善SAP的预后率和死亡率。
Kupffer细胞是巨噬细胞的一种,有研究表明成熟巨噬细胞在不同的微环境中可被诱导分化出不同的表型和功能状态,称为巨噬细胞的极化[6],主要有两种极化状态,促进炎症反应的巨噬细胞状态被称为m1极化,而与其相对抑制炎症反应的巨噬细胞状态称为m2极化[7-8]。极化细胞的重要特征为产生不同细胞因子。m2极化的巨噬细胞通过分泌炎症调节因子IL-4、IL-10和/或TGF-β等,下调免疫应答,促进细胞外基质的沉淀,并加速组织的修复[9]。Zhang等[10]发现大鼠SAP造模前或后给予IL-4均能减轻胰腺组织的坏死程度。Kusske等[11]采用IL-10预处理和治疗ANP小鼠,均降低了SAP的严重程度和死亡率。
尽管有明确的研究结果显示奥曲肽通过多种途径对急性胰腺炎产生保护作用,但是对奥曲肽是否作用于处于急性胰腺炎炎症核心的Kupffer细胞,是否介导了Kupffer细胞的m2极化尚未见报道。我们拟通过体内试验来观察奥曲肽对Kupffer细胞的作用。通过急性胰腺炎造模前后给予奥曲肽干预,检测血清中TNF-α、IL-4、IL-10水平,通过在体肝脏灌流密度梯度离心法提取Kupffer细胞,检测细胞内TNF-α、IL-4、IL-10的表达来确定奥曲肽的体内效应,病理组织切片观察胰腺的病理改变。我们发现奥曲肽治疗组和预防组的大鼠死亡率明显降低,开腹后出现腹水和钙化灶的情况较少。胰腺组织病理切片可见SAP组胰腺小叶结构消失,组织间质水肿,大量的炎症细胞浸润,甚至镜下满视野充满红细胞,组织大片状坏死;生理盐水治疗组和预防组亦可见胰腺组织的出血坏死,炎症细胞浸润,但反应较SAP组轻;而奥曲肽治疗组和预防组胰腺组织炎症反应明显减轻。
IL-4参与机体体液免疫应答,它促进Th2细胞分化,产生IL-4、IL-10等炎症调节因子,在防御细胞外病原菌和某些自身免疫性疾病中有着重要作用。有研究表明IL-4通过抑制巨噬细胞的活化和聚集来显示它的抗炎特性[12]。Hart等[13]的体外研究显示,IL-4 在mRNA水平上抑制TNF-α和IL-1β的表达,减少其生成。IL-4亦可以上调IL-1受体拮抗剂的表达[14],刺激巨噬细胞15-脂氧化酶活性[15],这些功能对于我们控制SAP过程中常见的系统炎症反应有重要意义。从我们的实验也得出奥曲肽治疗组Kupffer细胞内IL-4的表达升高,相应的TNF-α表达减少,在血清中也可见IL-4增多而TNF-α降低。
抑炎因子IL-10主要是抑制巨噬细胞向Th1细胞递呈抗原,减少巨噬细胞MHC-2类分子的表达,从而抑制TNF-α等炎性因子的产生。而目前的实验研究表明,IL-10是通过抑制NF-κB的激活在转录水平抑制炎性介质的产生[16-17]。Van Laethem 等[18]发现注射IL-10单克隆抗体可使AP小鼠病情加重,在抵消了内源性IL-10作用的同时,使肝脏胰腺TNF-α mRNA表达增加。在我们的实验中也观察到了,奥曲肽治疗组Kupffer细胞内的IL-10表达增加,相应的TNF-α mRNA的表达减少。提示奥曲肽可能通过影响IL-10抑制NF-kB的激活抑制了TNF-α的转录表达,同时血清中IL-10的水平显著升高TNF-α水平降低。
在国外的研究中,奥曲肽治疗或预防性应用于急性重症胰腺炎大鼠,得到了不同的结果,而在本试验中得出奥曲肽治疗组的血清学检测结果优于奥曲肽预防组,我们推测奥曲肽作用于“活化”状态Kupffer细胞的效果优于“静止”状态Kupffer细胞。
综上所述,血清和Kupffer细胞中因子的变化水平与胰腺的病理变化呈一致性趋势,Kupffer细胞在重症急性胰腺炎中起着重要的作用,奥曲肽通过作用于Kupffer细胞,导致其促炎因子TNF-α表达分泌的减少,抑炎因子IL-4、IL-10表达分泌的增加,从而介导了Kupffer细胞的m2极化,抑制促炎因子的产生,增强抑炎因子的表达,减轻机体的炎症反应,对重症急性胰腺炎起到了调节治疗作用。
[1] Gloor B,Blinman TA,Rigberg DA,et al.Kupffer cell blockade reduces hepatic and systemic cytokine levels and lung injury in hemorrhagic pancreatifis in rats[J].Pancreas,2000,21(4):414-420.
[2] Murr MM,Yang J,Fier A,et al.Regulation of Kupffer cell TNF gene expression during experimental acute pancreatitis:the role of p38-MAPK,ERKI/2,SAPK/JNK,and NF-kappaB [J].J Gastrointest Surg,2003,7(1):20-25.
[3] Folch-Puy E.Importance of the liver in systemic complications associated with acute pancreatitis:the role of Kupffer cells[J].J Pathol,2007,211(4):383-388.
[4] Hoyos S,Granell S,Heredia N,et al.Influence of portal blood on the development of systemic inflammation associated with experimental acute pancreatitis[J].Surgery,2005,137(2):186-191.
[5] Grewal HP,Kotb M,el Din AM,et al.Induction of tumor necrosis factor in severe acute pancreatitis and its subsequent reduction after hepatic passage[J].Surgery,1994,115(2):213-221.
[6] Gordon S.Alternative activation of macrophages[J].Nat Rev Immunol,2003,3:23-35.
[7] Mantovani A,Sozzani S,Locati M,et al.Macrophage polarization:tumor-associated macrophages as a paradigm for polarized M2 mononuclear phagocytes[J].Trends Immunol,2002,23(11):549-555.
[8] Mantovani A,Sica A,Locati M.Macrophage polarization comes of age[J].Immunity,2005,23(4):344-346.
[9] Van Gnderachter JA,Movahedi K,Hassanzadeh Ghassabeh G,et al.Classical and alternative activation of mononuclear phagocytes:Picking the best of both worlds for tumor promotion [J].Immunobiology,2006,211(6-8):487-501.
[10] Zhang C,Ge CL,Guo RX,et al.Effect of IL-4 on altered expression of complement activation regulators in rat pancreatic cells during severe acute pancreatitis[J].World J Gastroenterol,2005,11(43):6770-6774.
[11] Kusske AM,Rongione AJ,Ashley SW,et al.Interleukin-10 prevents death in lethal necrotizing pancreatitis in mice[J].Surgery,1996,120(2):284-289.
[12] Cook HT,Singh SJ,Wembridge DE,et al.Interleukin-4 ameliorates crescentic glomerulonephritis in Wistar Kyoto rats[J].Kidney Int,1999,55(4):1319-1326.
[13] Hart PH,Vitti GF,Burgess DR,et al.Potential antiinflammatory effects of interleukin 4:suppression of human monocyte tumor necrosis factor alpha,interleukin 1,and prostaglandin E2 [J].Proc Natl Acad Sci U S A,1989,86(10):3803-3807.
[14] Vannier E,Miller L C,Dinarello C A.Coordinated antiinflammatory effects of interleukin 4:interleukin 4 suppresses interleukin 1 production but up-regulates gene expression and synthesis of interleukin 1 receptor antagonist[J].Proc Natl Acad Sci U S A,1992,89(9):4076-4080.
[15] Katoh T,Lakkis FG,Makita N,et al.Co-regulated expression of glomerular 12/15-lipoxygenase and interleukin-4 mRNAs in rat nephrotoxic nephritis[J].Kidney Int,1994,46(2):341-349.
[16] Dhingra S,Sharma AK,Arora RC,et al.IL-10 attenuates TNF-α-induced NFκB pathway activation and cardiomyocyte apoptosis [J].Cardiovasc Res,2009,82(1):59-66.
[17] Minter RM,Ferry MA,Murday ME,et al.Adenoviral delivery of human and viral IL-10 in murine sepsis[J].J Immunol,2001,167(2):1053-1059.
[18] Van Laethem JL,Eskinazi R,Louis H,et al.Multisystemic production of interleukin 10 limits the severity of acute pancreatitis in mice[J].Gut,1998,43(3):408-413.
