肝硬化大鼠小肠黏膜形态结构改变与内毒素血症
2012-07-25赵生环宋正己
赵生环,范 红,宋正己,汤 敏
昆明医学院附属昆华医院·云南省第一人民医院消化内科,云南昆明650032
内毒素血症在肝硬化的发生、发展及转归过程中具有重要的病理生理意义。其发生机制相当复杂,尚未完全明了,国内外均有研究表明,肝硬化时小肠黏膜屏障功能受损及肠道通透性可明显增高,导致肠道内革兰氏阴性菌产生的内毒素容易进入循环系统,引起肠源性内毒素血症,本研究观察由硫代乙酰胺(TAA)诱导的和胆管结扎术(BDL)后胆汁淤积引起的肝硬化大鼠小肠黏膜形态结构的改变和内毒素水平的增高来阐明两者之间的密切相关性。
1 材料与方法
1.1 主要试剂与仪器 硫代乙酰胺(TAA)、内毒素鲎试剂盒(厦门市鲎试剂实验厂有限公司)、光镜、电镜、分光光度计。
1.2 肝硬化大鼠模型制作 实验动物随机分为3组:正常对照组、模型组每组12只。正常对照组:腹腔内注射注射用水0.5 mL,每周两次(周一、周四),共8周;模型组(TAA组):腹腔内注射10%TAA 200 mg/kg(首次剂250 mg/kg),每周2次(周一、周四),共8周;模型组(BDL组):自由饮水和饮食1周后,行胆总管结扎术,8周成模;大鼠造模死亡率为52.7%,最后成模共17只,TAA组10只,BDL组7只。
1.3 肠壁组织光镜观察 取十二指肠下空肠,生理盐水冲洗后在50%甲醛液中固定,石蜡包埋,切片后用常规苏木精伊红染色,切片光镜下观察。
1.4 肠壁组织电子显微镜观察 取十二指肠下空肠,生理盐水冲洗后,以2.5%的戊二醛固定,经脱水、包埋,超薄切片后于透射电镜下观察小肠黏膜超微结构改变。
1.5 血浆内毒素的检测 在无菌条件下采取腹主动脉血5 mL,采用显色基质鲎试剂盒,操作步骤按其说明书进行,结果以Eu/mL表示。
1.6 统计学处理 采用SPSS 15.0软件,数据以均数±标准差表示,两组计量资料的比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肠黏膜HE染色 光镜下观察到正常大鼠肠黏膜组织完整,绒毛整齐,上皮细胞形态正常,未见黏膜充血水肿和炎性细胞浸润,肝硬化伴内毒素血症大鼠肠黏膜绒毛稀疏、萎缩,上皮细胞坏死,黏膜水肿伴有炎性细胞浸润(见图1),并且发现TAA组大鼠肠黏膜改变较BDL组更严重。

图1 各组大鼠肠黏膜HE染色(100×)A:正常组;B:BDL组;C:TAA组Fig 1 Rat intestinal mucosa(HE 100×)A:control group;B:BDL group;C:TAA group
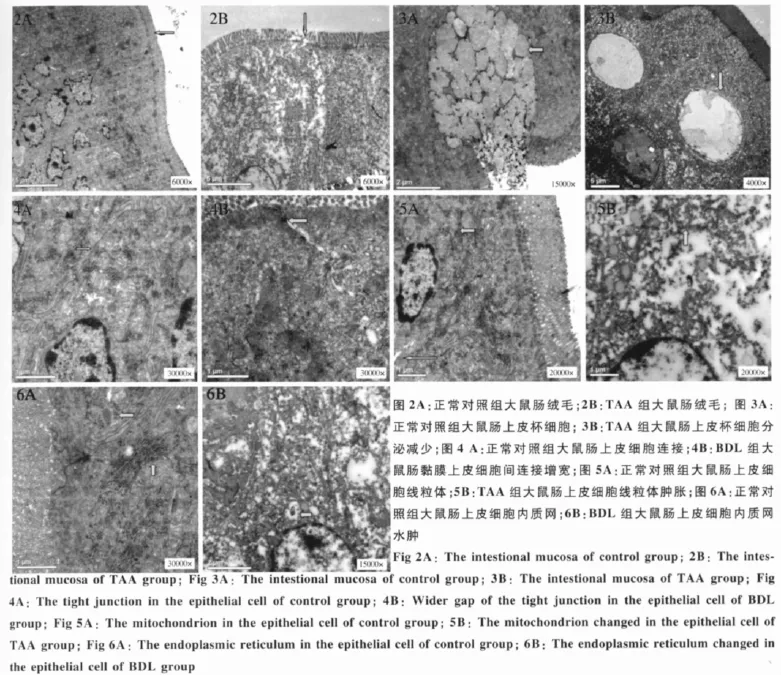
2.2 小肠黏膜超微结构的改变 正常对照组没有小肠黏膜超微结构的改变,TAA组和BDL组大鼠小肠黏膜出现超微结构的改变,电镜下观察到模型组大鼠小肠壁结构有明显改变,肠黏膜绒毛破坏、减少、变短、倒伏、缺失,肠黏膜紧密间隙增宽,肠黏膜杯状细胞分泌减少,肠黏膜上皮细胞内线粒体和内质网肿胀(见图2~6)。
2.3 血浆内毒素 正常对照组血浆内毒素素水平(0.043+0.011)Eu/mL,TAA 组血浆内毒素水平为(0.667+0.159)Eu/mL,与正常对照组比较,显著增加,差异有统计学意义。BDL组血浆内毒素水平为(0.806+0.382)Eu/mL,与 TAA 组比较,显著增加,差异有统计学意义。
3 讨论
肠黏膜屏障功能指的是肠黏膜本身及黏膜前后因素的总称,包括机械屏障、生物屏障和免疫屏障等,其主要作用是阻止肠道内有害物质(如肠内的细菌和毒素)进入体循环[1]。肠黏膜的机械屏障主要由肠上皮细胞及其紧密连接组成,其功能受损可以导致肠壁通透性增加,成为细菌及其产物的细胞旁通路,进入肠系膜淋巴结与门静脉循环,从而引起局部和全身的感染[2]。肝硬化机体免疫力下降等情况下,肠道内的致病菌特别是革兰阴性菌就会大量生长、繁殖并释放大量的内毒素可直接引起肠黏膜屏障损伤。本研究结果显示,与正常对照组相比较,药物性肝硬化和胆汁淤积性引起的肝硬化模型组光镜下观察到肝硬化大鼠小肠肠黏膜绒毛稀疏、萎缩,上皮细胞坏死,黏膜水肿伴有炎性细胞浸润,并且胆汁淤积性肝硬化病变程度较重,可能与胆汁酸分泌减少、胆盐的缺乏等有关;电镜下观察到模型组大鼠小肠壁结构有明显改变,肠黏膜绒毛破坏、减少、变短、倒伏、缺失,肠黏膜紧密间隙增宽,肠黏膜杯状细胞分泌减少,肠黏膜上皮细胞内线粒体和内质网肿胀。模型组血浆内毒素水平明显升高,并且BDL组内毒素水平高于TAA组,推测可能内毒素参与了机体自身免疫反应的发生,全身免疫系统被激活,导致机体免疫紊乱。Parks等[3]学者也观察到在胆管结扎肝硬化大鼠模型小肠黏膜形态受损,引起内毒素水平升高和肠道细菌移位。
这些现象提示,肝硬化时肠黏膜结构形态发生改变,肠黏膜屏障受损,肠壁的通透性增加,内毒素由肠道吸收增多。进入血循环中的内毒素直接损伤肠黏膜上皮细胞、线粒体和内质网,并引起肠微血管收缩,使肠黏膜血流量减少,肠组织缺血、缺氧,长期缺血缺氧,又加剧内毒素的吸收,形成恶性循环,同时,肝硬化时,Kupffer细胞功能、代谢严重受损对内毒素的清除能力下降故进入肝脏的内毒素不能被及时清除[4],也可引起肠源性内毒素血症。Such等[5]学者通过光镜观察到十二指肠绒毛的高度和宽度之比发生很大的变化。电镜下观察到肝硬化患者十二指肠黏膜的超微结构发生改变,细胞间隙增宽;提出肝硬化时发生感染是由于细菌通过肠黏膜屏障从肠道官腔移位到肠系膜淋巴结引起的,肠黏膜形态改变有利于细菌移位。细菌过度生长、细菌移位是肝硬化发生自发性腹膜炎的主要原因之一。我国学者任卫英等[6]认为小肠细菌过度生长、肠道细菌移位等同样也是肝硬化患者易发生内毒素血症时不可忽视的因素,可能与正常小肠壁结构的改变有一定的关系。同样,Chiva等[7]学者通过实验观察到有细菌移位的肝硬化大鼠回肠和盲肠黏膜的氧化损伤严重,提出肠道黏膜屏障的完整性在肝硬化细菌移位的发病机制中可能起着重要的作用。肝硬化大鼠门脉高压时肠道屏障完整性受损产生的自由基代谢物参与了肝硬化大鼠的细菌移位。Bauer等[8]学者也观察到肝硬化患者存在小肠细菌过度生长,其与内毒素密切相关,细菌数量可能是内毒素水平的决定因素,而不是菌群种类组成。也有学者[9]报道肝硬化大鼠肠道菌群失调能够引起细菌移位和肝脏功能的改变,实验发现肝硬化大鼠肠道杆菌水平高于正常对照组,给予双歧杆菌和肠球菌治疗后,肠道杆菌水平和内毒素水平都有所降低。Lata等[10]学者也报道微生态制剂可以改善肝硬化患者的肠道菌群和肝功能Child-Pugh评分,降低内毒素水平。这些研究理论对临床上防治肝硬化的内源性感染和肠源性内毒素血症有一定的价值。
内源性感染是肝硬化常见的并发症之一,肠道是内源性感染的主要来源,其中最为常见的是自发性腹膜炎和肠源性内毒素血症。肝硬化引起的肠源性内毒素血症对肝脏的损害,除内毒素本身的直接作用外,主要与内毒素激活巨噬细胞,使其产生与释放细胞因子有关,如肿瘤坏死因子 α、白介素(IL-1、IL-6、IL-8),血小板活化因子、白三烯、氧自由基、内皮素-1(ET-1)、一氧化氮(NO)等共同参与对肝组织的损伤,已有学者[11]正在临床研究证实,胆管结扎后所致的肝硬化大鼠存在内毒素血症,同时肿瘤坏死因子水平显著增高。
另外,肝硬化时,内毒素容易进入体循环的原因还有很多,如肝脏解毒能力下降、门体分流以及机体免疫功能受损等,同样,内毒素进入人体后使机体免疫力下降[12]。
内毒素血症、肠黏膜屏障衰竭在晚期肝硬化患者中大量存在,阻止其恶性循环的发生是治疗肝硬化患者的关键之一,是预防肝功能衰竭的重要环节。加强和深入对肝硬化患者肠黏膜屏障损伤的研究对防治肠源性内毒素血症具有重要意义。有报道[13]:西沙比利通过促进小肠蠕动和改善肠道渗透率可能有助于防止肠道细菌移位和内毒素血症。因此,通过调节肠道菌群、增加肠道动力、营养支持等方面来防治肝硬化内毒素血症的发生。
[1] Ren WY,Zhang SC,Tu CT,et al.The relationship between small intestinal mucosa injury and intestinal endotoxemia in cirrhotic rats[J].Fudan Univ J Med Sci,2008,35(1):125-127.
任卫英,张顺财,涂传涛,等.肝硬化大鼠小肠微绒毛形态和超微结构的改变与肠源性内毒素血症的关系[J].复旦学报(医学版),2008,35(1):125-127.
[2] Li J,Cheng LF,Du B,et al.The study of morphology of intestinal mucosa and bacterial translocation in the rat of cirrhosis[J].Chin J Gastroenterol Hepatol,2010,19(1):25-27.
李静,程留芳,杜斌,等.肝硬化大鼠模型肠壁结构及细菌移位的研究[J].胃肠病学和肝病学杂志,2010,19(1):25-27.
[3] Parks RW,Stuart Cameron CH,Gannon CD,et al.Changes in gastrointestinal morphology associated with obstructive jaundice[J].J Pathol,2000,192(4):526-532.
[4] Li QY,Shu JH,Yang JH.Relationship between ultrasturctural changes of small intestinal mucosa and plasma endotoxin in patients with cirrhosis[J].The Journal of Practical Medicine,2006,22(7):777-779.
李琪毅,舒建昌,杨绮红.肝硬化患者小肠黏膜超微结构改变与内毒素血症[J].实用医学杂志,2006,22(7):777-779.
[5] Such J,Guardiola JV,de Juan J,et al.Ultrastructural characteristics of distal duodenum mucosa in patients with cirrhosis[J].Eur Gastroenterol Hepatol,2002,14(4):371-376.
[6] Ren WY,Zhang SC,Zhou ZY,et al.The relationships between the histological changes of the small intestine and small intestine bacterial overgrowth and bacterial translocation in cirrhotic rats[J].Clinical Medical Journal of China,2004,11(2):168-170.
任卫英,张顺财,周昭彦,等.肝硬化大鼠小肠壁结构改变与小肠细菌过度生长和细菌转位的关系的研究[J].中国临床医学,2004,11(2):168-170.
[7] Chiva M,Guarner C,Peralta C,et al.Intestinal mucosal oxidative damage and bacterial translocation in cirrhotic rats[J].Eur J Gastroenterol Hepatol,2003,15(2):146-149.
[8] Bauer TM,Schwacha H,Steinbruckner B,et al.Small intestinal bacterial overgrowth in human cirrhosis is associated with systemic endotoxemia[J].Am J Gastroenterol,2002,97(9):2364-2370.
[9] Zhang W,Gu Y,Chen Y,et al.Intestinal flora imbalance results in altered bacterial translocation and liver function in rats with experimental cirrhosis[J].Eur Gastroenterol Hepatol,2010,14(4):371-376.
[10] Lata J,Novotny I,Pribramska V,et al.The effect of probiotics on gut flora,level of endotoxin and Child-Pugh score in cirrhotic patients:results of a double-blind randomized study[J].Eur J Gastroenterol Hepatol,2007,19(12):1111-1113.
[11] Yorganci K,Baykal A,Kologlu M,et al.Endotoxin challenge causes a proinflammatory state in obstructive jaundice[J].J Invest Surg,2004,17(3):119-126.
[12] Lin CY,Tsai IF,Ho YP,et al.Endotoxemia contributes to the immune paralysis in patients with cirrhosis[J].J Hepatol,2007,46(5):816-826.
[13] Zhang SC,Wang W,Ren WY,et al.Effect of cisapride on intestinal bacterial and endotoxin translocation in cirrhosis[J].World J Gastroenterol,2003,9(3):534-538.
