甲基化在食管胃结合部腺癌及胃远端腺癌的表达
2012-07-21西安交通大学医学院第一附属医院肿瘤外科西安710061
西安交通大学医学院第一附属医院肿瘤外科(西安710061)
刘 棣△ 刁冬梅 程 遥 汪建光 张 昊 袁达伟 党诚学▲
食管胃交界腺癌(Adenocarcino ma of esophagogastric junction,AEG)是指发生于食管胃交界EGJ(Gastroesophageal j unction,GEJ)区域的腺癌。多数学者认为AEG是一类独特的临床病理类型。近年来,食管胃交界部肿瘤发病率呈上升趋势。近年,各国学者开始对其病因、分类、治疗进行了深入研究[1]。目前,有关AEG分类主要有,WHO和Siewert两种。2000年时,WHO对食管胃交界腺癌定义为穿过食管胃交界处的腺癌,不管肿瘤的主体在何处。Siewert在1987年将EGJ近侧和远侧5c m之内的腺癌称作食管胃交界腺癌,并提出了相应的局部解剖学分型。目前研究显示:食管胃结合部肿瘤中发生机制和生物学行为方面可能不同于非EGJ区域的胃癌,为一种类型独特的肿瘤。因此,为揭示胃癌发生的分子机制,探讨不同部位胃癌的分子生物学特性显得尤为重要。
材料方法
1 标本与试剂 26例食管胃结合部腺癌和28例胃远端部腺癌手术切除标本取自西安交通大学医学院第一附属医院肿瘤外科标本库。所有患者术前均未接受任何放疗、化疗。食管胃结合部腺癌纳入标准为:肿瘤位置介于齿状线远心侧且位于齿状线下5c m以内,齿状线清晰可见,未累积,病理证实为腺癌。手术标本部分送病理科常规组织学检测,取小部分新鲜标本置液氮保存。标本在冰面,取癌组织、正常组织(距癌>5c m)、癌旁组织(距离癌3~5c m)。组织获取均征得患者及家属知情同意。DNA提取试剂盒购于天根公司,DNA甲基化修饰试剂盒购于Millipore公司,Taq酶,d NTP购自TAKARA公司,其它试剂购自西安沃尔森公司。
2 检测方法
2.1 DNA的提取 取肿瘤、正常、癌旁组织约30 mg,研磨,按天根TIANa mp Geno mic DNA Kit试剂盒操作步骤提取DNA,得DNA约10~30μg。
2.2 亚硫酸盐修饰 按照Cp Geno me Tur bo Bisulfite Modification Kit操作步骤。取1.5 ml离心管,加入 1.0μl 3 N Na OH ,1.0μg 已抽提的 DNA(10μl)。37°C 水浴10 min。加120μl新鲜配制的亚硫酸氢钠(DNA修饰试剂),漩涡混匀。70°C 水浴40 min。加500μl DNA结合缓冲液,将修饰DNA纯化柱放入2 ml收集管,将样本移入离心柱,离心11 000×g 1 min,弃去收集管中液体。加入700μl DNA洗脱缓冲液 离心11 000×g 1 min。加200μl新鲜配制的去硫溶液到离心柱的中心。室温放置15 min,离心11 000×g 1 min,弃去收集管中液体.加入700μl DNA洗脱缓冲液 离心11 000×g 1 min。重复次步1次。将离心柱放入一新的1.5 ml离心管,离心11 000×g 1 min。将离心柱放入一干净1.5 ml离心管,加入25μl DNA溶解缓冲液,室温放置1 min,全速离心1 min。样本保存于-20°C。
2.3 甲基化特异性PCR 依照甲基化特异性PCR(Met hylation specific PCR,MSP)方法[2],对每一个标本进行亚硫酸盐修饰,然后分别用甲基化和非甲基化引物进行PCR反应。采用25μl反应体系:10×缓冲液 2.7μl,d NTP(2.5μmol/L)3μl,正向引物(10μmol/L)2μl,反向引物(10μmol/L)2μl,模板 DNA 4μl,Taq DNA聚合酶0.3μl,去离子水补总反应体系至25μl。反应条件:95°C 预变性5 min,循环:95°C 30s,退火温度因不同基因而不同30s,72°C 30s,共40个循环,最后72°C延伸10 min,4°C保存产物。
引物由北京华大基因公司合成:①RASSF1 A[2]:MF gtgttaacgcgttgcgtatc MR aaccccgcgaactaaaaacga;UF tttggtt ggagtgt gttaatgt g UR caaaccccacaaactaaaaacaa;②RASSF2[3]:MF ttttttttttttgagttcgc MR ctaaaaaacgacgacgaact;UF tttttttttttttttgagttt gt UR cctaaaaaacaacaacaaacta; ③ RUNX3[4]: MF ttacgaggggcggtcgtacgcggg MR aaaacgaccgacgcgaacgcctcc;UF ttat gaggggt ggttgtatgt ggg UR aaaacaaccaacacaaacacctcc。
2.4 结果鉴定 配制3%琼脂糖凝胶,PCR产物用溴酚蓝染色,取5~10μl产物,加样于琼脂糖凝胶加样孔,置于电泳槽中电泳,电泳缓冲液为1×TAE,电压180 V。当溴酚蓝条带迁移至琼脂糖凝胶2/3处时终止电泳,紫光灯下观察电泳条带,凝胶成像仪采集图像。若甲基化引物扩增出现条带,而非甲基化无条带扩增,为纯合型甲基化。说明该病例发生甲基化,若非甲基化引物扩增出现条带,说明该病例处于非甲基化状态。若两对引物均扩增出目的条带,则为杂合型甲基化。采用Raji细胞株[5]作为阳性对照,Hela细胞株[6]作为阴性对照。
3 统计学处理 本组所有资料均采用SPSS17.0统计软件包进行统计处理,组间样本率比较采用四格表资料χ2检验(Chi-square Test)和行X列表资料的χ2检验,以P<0.05为有显著性差异,P<0.01为有极显著性差异。
结 果
1 AEG、GDA及癌旁正常组织中各基因甲基化率对比 见表1及附图。食管胃结合部腺癌组织、癌旁不典型增生组织、癌旁正常组织中RASSF1A基因启动子区甲基化发生率分别为65.38%,26.92%,15.38%,而在胃远端腺癌中的甲基化发生率分别为53.57%,17.86%,14.29%。RASSF2在食管胃结合部和胃远端腺癌中的甲基化为69.23%、57.14%,在不典型增生中的甲基化为30.77%和21.43%,在正常组织中为19.23%和17.86%。RUNX3在食管胃结合部和胃远端腺癌中的甲基化分别为(61.54%VS 53.57%),在不典型增生中(23.08%VS 25%),在癌旁正常组织(11.54%VS 10.71%)。甲基化在 RASSF1A、RASSF2和RUNX3在食管胃结合部腺癌和胃远端腺癌之间的表达情况无显著性差异(P>0.05),但每一个基因的甲基化发生率,随着相应部位黏膜病理病变的加重而呈上升趋势(P<0.05)。
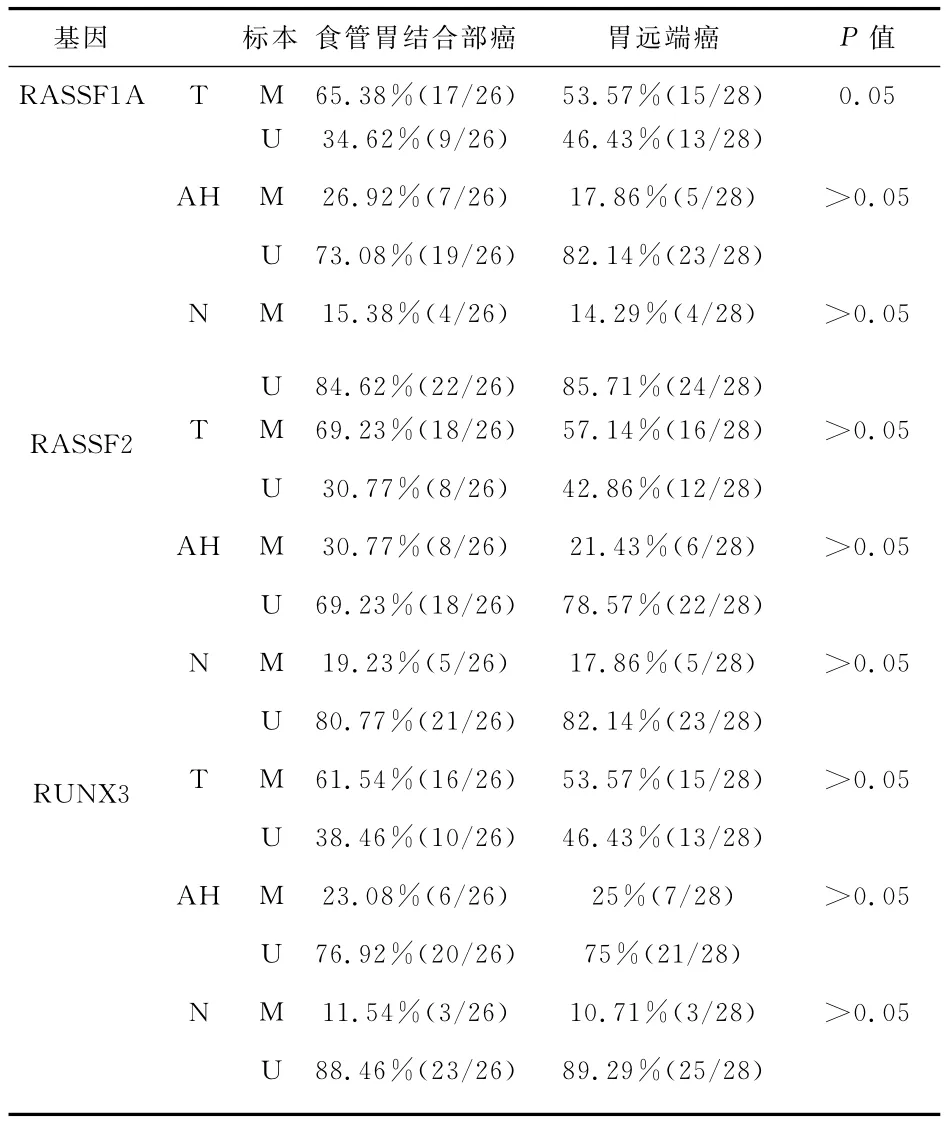
表1 食管胃结合部腺癌和胃远端腺癌在肿瘤、癌旁不典型增生、癌旁正常组织中的甲基化情况比较
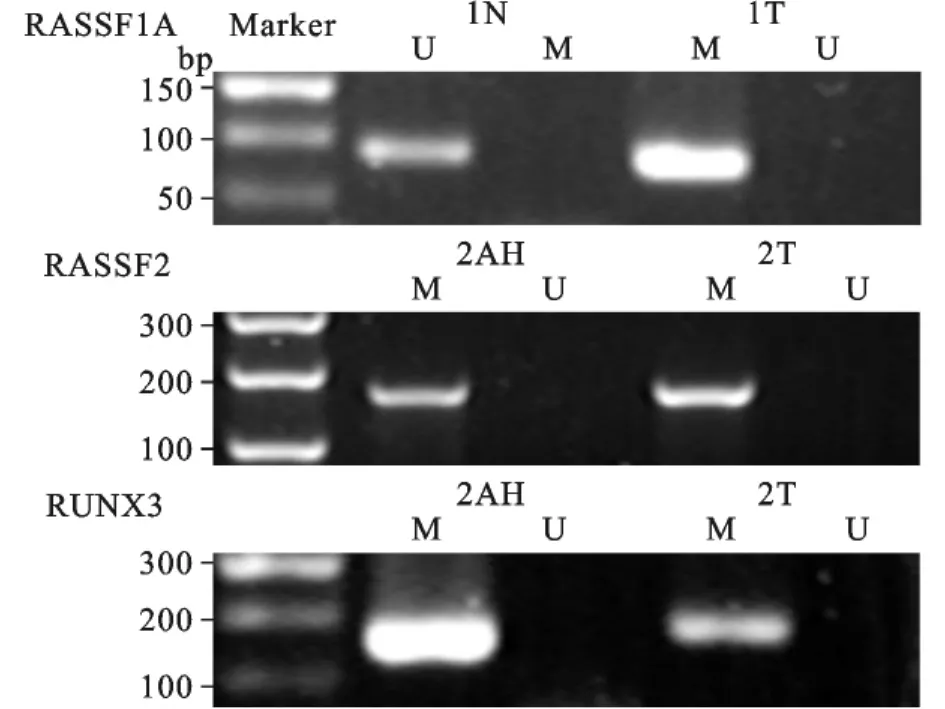
附图 肿瘤(T)、不典型增生(AH)及癌旁正常(N)组织甲基化电泳图 M示甲基化引物扩增反应;U示非甲基化引物扩增反应
2 癌和正常组织中 RASSF1A、RASSF2和RUNX3甲基化发生率比较 见表2。癌组织中RASSF1A、RASSF2和RUNX3甲基化发生率明显高于癌旁正常组织(P<0.05)。
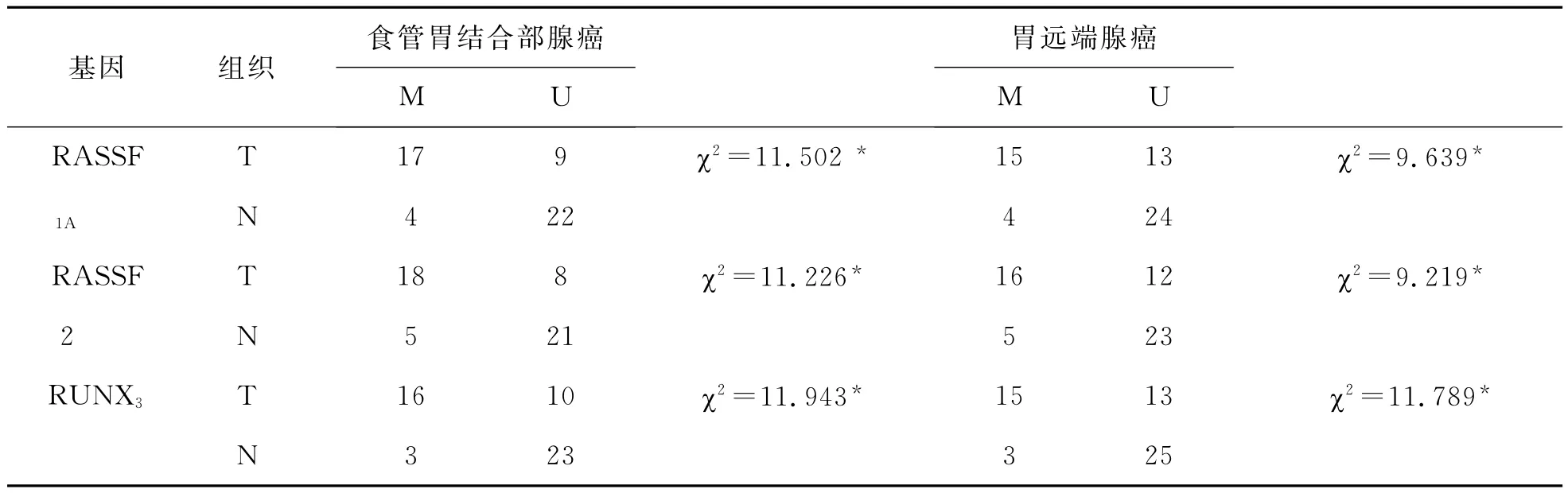
表2 肿瘤与相应癌旁正常组织甲基化发生率比较
讨 论
近年来表观遗传学是国内外研究肿瘤发生、发展的热点。遗传学是指基于基因序列改变所致基因表达水平变化,如基因突变、基因杂合性缺失及微卫星体不稳定。而表观遗传学则不同,他研究的是基因修饰后序列未发生改变情况下,基因表达水平改变。常见的就是甲基化、组蛋白乙酰化及染色质构象变化。DNA甲基化发生在启动子区Cp G岛,其中的胞嘧啶在DNA甲基转移酶的作用下转变为5-甲基胞嘧啶(mC)。甲基化在哺乳动物正常的生长、发育过程中发挥重要作用。而一些异常的甲基化则会形成细胞内的无序状态而促进肿瘤的发生。正常情况下,基因启动子区Cp G岛处于非甲基化状态,当其发生甲基化时,会导致基因转录抑制,使其功能丧失,从而导致正常细胞生长、分化调控失常,DNA损伤不能及时修复,这将可能引起肿瘤的发生。目前对于贲门癌的发病机制研究尚不清楚,有报道约半数的贲门癌与Barrett食管有关。
RASSF1A基因位于人染色体3p21.3区位点的抑癌基因,参与细胞的增殖和凋亡、维持微管稳定性。RASSF1A在多种恶性肿瘤,如肺癌、乳腺癌、膀胱癌、食管癌、结肠癌中表达下调或缺失,启动子Cp G岛异常甲基化和杂合性缺失是主要原因[7,8]。RASSF2是RASSF1家族中的一个成员,近年研究表明,它在胃癌中频繁甲基化,可能也是一个抑癌基因[9]。已经有相关研究证实RASSF1A和RASSF2在口腔鳞状细胞癌中的甲基化与预后有密切的关系[10]。RUNX3基因位于染色体1p36.1,对脊神经节的神经发育及胃黏膜上皮的增生有调节作用。作为一个抑癌基因,调控细胞生长发育和细胞凋亡,它的缺失或失活可以导致胃黏膜上皮细胞增生和分化异常。
食管胃结合部肿瘤是一类较特殊的肿瘤,预后不良。目前对于贲门癌的发病机制研究尚不清楚,有报道约半数的贲门癌与Barrett食管有关。本研究中,在食管胃结合部和胃远端肿瘤中,甲基化的发生率都要明显高于其相应的正常组织,然而食管胃结合部腺癌和胃远端腺癌的甲基化程度无显著性差异。由此可见,相关基因高甲基化状态可能是引起食管胃结合部腺癌和胃远端腺癌的共同分子机制之一。
食管胃结合部腺癌和胃远端腺癌的甲基化发生率要明显高于其相应的癌旁不典型增生组织,也高于癌旁正常组织。我们可以推测:食管胃结合部腺癌和胃远端腺癌的发生与甲基化的发生有密切的关系。过往的研究认为,食管胃结合部腺癌和胃远端腺癌,在病理发生上存在不同,我们对比了这两种肿瘤的甲基化发生率,发现无显著性差异,这可能与本组病例数较少有关。为探明它们发生的分子生物学区别,需要进一步研究。但目前已开展的表观遗传学的肿瘤治疗,可能同样应用于这两种肿瘤。
[1]Chandraso ma P,Wickra masinghe K,Ma Y,et al.Is intestinal metaplasia a necessar y precursor lesion for adenocarcino mas of the distal esophagus,gastr oesophageal junction and gastric cardia[J].Dis Esohpagus,2007,20(1):36-41.
[2]Her man JG,Graff JR,Myohanen S,et al.Methylationspecific PCR:a novel PCR assay for methylation status of Cp G islands[J].Proc Natl Acad Sci USA,1996,93(18):9821-9826.
[3]Shi J,zhang G,Yao D,et al.Prognostic significance of aberrant gene methylation in gastric cancer[J].Am J Cancer Res,2012,2(1):116-129.
[4]Lau QC,Raja E,Salto-Tellez M,et al.RUNX3is frequently inactivated by dual mechanis ms of protein mislocalization and pro moter hyper methylation in breast cancer[J].Cancer Res,2006,66(13):6512-6520.
[5]Wong-Ivy HN, Ng-Margaret H L, Lee-Joseph C K,et al.Transcriptional silencing of the p16 gene in human myelo ma-derived cell lines by hyper methylation[J].Br J Haematol,1998,103(1):168-175.
[6]Par kin DM,Laara Z,Muir CS.Esti mates of the world wild frequency of sixteen maior cancer in 1980[J].Int J Cancer,1988,41(2):184-185.
[7]Yazici H,Terry MB,Cho YH,et al.Aberrant methylation of RASSF1Ain plas ma DNA before breast cancer diagnosis in the breast cancer family registry[J].Cancer Epidemiol Bio mar kers Prev,2009,18(10):2723-2725.
[8]Yanagawa N,Ta mura G,Oizu mi H,et al.Pro moter gyper methylation of RASSF1Aand RUNX3genes as an independent prongostic prediction mar ker in surgically resected non-s mall cell lung cancers[J].Lung Cancer,2007,58(1):131-138.
[9]Nagasaka T,Tanaka N,Cullings HM,et al.Analysis of fecal DNA methylation to detect gastrointestinal neoplasia[J].J Natl Cancer Inst,2009,101(18):1244-1258.
[10]Huang KH,Huang SF,Chen IH,et al.Methylation of RASSF1A,RASSF2A,and HIN-1 is associated with poor outcome after radiotherapy,but not surgery,in oral squa mous cell carcino ma[J].Clin Cancer Res,2009,15(12):4174-4180.
