HPLC法快速检测记忆缺失性贝毒软骨藻酸
2012-07-19周秀锦周向阳邵宏宏王淑娜
周秀锦,周向阳,郑 斌,邵宏宏,王淑娜
(1.舟山出入境检验检疫局,浙江舟山 316000;2.浙江省海洋开发研究院,浙江舟山 316100)
贝类毒素是有毒有害赤潮生物产生的生物活性物质的总称,又被称为赤潮生物毒素。贝类毒素不仅严重破坏海洋渔业资源和水产养殖,恶化海洋环境,还可以通过食物链的传递,危害人类健康,造成人体中毒甚至死亡。在世界范围内,由赤潮毒素引起的人员中毒和死亡事件屡见不鲜。
首次报道记忆缺失性贝类毒素事件是在1987年加拿大爱德华王子岛发生因食用养殖紫贻贝而引起的食物中毒。随后加拿大国立大西洋研究中心的QUILLIAM等从当地居民食用的养殖贝类体内分离出了一种被称为软骨藻酸(Domoic Acid,DA)的活性物质,确认它为引起中毒的化学物质,并肯定该物质来源于经常在加拿大东海岸形成赤潮的一种硅藻[1]。1996年,墨西哥Baja地区,成百上千只海鸟因食用体内富集高浓度DA的螃蟹、凤尾鱼、沙丁鱼中毒死亡[2]。1998年美国加利福尼亚州中部沿海发生400多头海狮中毒死亡事件,存活的海狮中有神经功能失调症状,从海狮的体液中检测出了高浓度DA[3]。由DA引起的中毒症状包括恶心、呕吐、腹痛、腹泻等,同时有昏眩、昏迷等类似神经性中毒症状,一段时间内丧失部分记忆是此类中毒的典型特征,因此这类毒素被称为记忆缺失性贝类毒素[4]。软骨藻酸是记忆缺失性贝类毒素的最常见生物毒素,是由硅藻门Bacillariophyta、羽纹硅藻纲Pennatae、管壳缝目Aulonoraphidinals、菱形藻科Nitzschiaceae中的拟菱形藻属Pseudo-nitzschia和菱形藻属Nitzschia中硅藻的某些种产生的一种兴奋性神经毒素。软骨藻酸是一种溶于水具有强烈神经毒性、与红藻酸(2-梭基-3-异丙稀基脯氨酸)相关的兴奋性非蛋白氨基酸类物质[5]。软骨藻酸是长链羽状硅藻Nitzschia pseudodelicatissima的代谢物[6],热稳定,熔点为223~224℃。易溶于水、稀酸和碱溶液中,微溶于甲醇和乙醇,不溶于石油醚和苯,紫外光谱最大吸收波长为242 nm。水中的贝类和鱼类对DA有较强的耐受力,它们可以富集藻类产生的DA,再经食物链的传递对所在地区的生态环境造成影响,人类食用被DA污染的海产品后即可引起中毒。1998年被英国作为贝类动物的常规检测项目,规定DA<20 mg/kg的贝类才可以食用。
笔者根据软骨藻酸贝类毒素的性质,建立一种快速简便的高效液相色谱分析方法。
1 材料与方法
1.1 方法原理
试样中的记忆缺失性贝类毒素经适当甲醇水提取,经过阴离子柱净化,用高效液相色谱仪进行检测;外标法定量。
1.2 试剂和材料
实验所用试剂应无干扰峰,除另有特别说明外,所用试剂均为分析纯,实验用水应符合GB/T 6682一级水的要求。
1.2.1 试剂
甲醇、乙腈,色谱纯;三氟乙酸,优级纯;冰乙酸,盐酸,氢氧化钠,氨水,甲酸铵,乙酸铵,磷酸氢二钠,磷酸二氢钠,磷酸铵,磷酸氢二铵,庚烷磺酸钠。标准品:软骨藻酸(DA)购自加拿大海洋局,Lot#20071205。
1.2.2 仪器
高效液相色谱仪:配紫外-可见光检测器(岛津LC-20A);电子天平(梅特乐公司CP124S):感量0.000 1 g;离心机(西格玛公司 3-18K):10 000 r/min;微孔滤膜:0.45 μm;组织均质器(IKA 公司 T25BASIC);旋转蒸发仪(LABOROTA-4003);旋涡混合器(IKA 公司 MSI)。
1.3 样品处理
取样:用清水清洗外壳,开壳,清水淋洗除去泥沙等外来杂质,取可食用部分用作检测,匀质。
提取:称取试样5.0 g,于50 mL离心管中,加入10 mL甲醇水溶液,旋涡混匀,超声波提取5 min,以4 000 r/min离心5 min,移取全部上清夜至50 mL离心管中。
柱净化:取阴离子交换柱,依次用6 mL甲醇,3 mL水,3 mL 50%甲醇水溶液过柱活化,然后取提取液5.0 mL,以1滴/s的速度过柱,再用1 mL甲醇洗涤,弃去流出液,挤干,最后用2 mL冰乙酸+甲醇(25+75)洗脱,收集洗脱液。45℃水浴,N2吹干。准确移取1 mL乙腈+水(1+9)溶解残留物,转移到5 mL离心管,加入1 mL正己烷萃取,静置1 min,弃上层液体,下层过0.45 μm微孔滤膜,供高效液相色谱仪检测。
1.4 色谱条件
色谱柱:Venusil ASB C8,4.6×250 mm;流动相:乙腈+0.1%三氟乙酸+0.02%庚烷磺酸钠;流速:1.0 mL/min;检测条件:紫外检测器,检测波长242 nm;进样量:20 μL;柱温:室温。
1.5 标准工作曲线
以乙腈+水(1+9)稀释标准储备液分别配成为含软骨藻酸 0.1、1.0、2.5、10.0、25.0 μg/mL 的标准溶液,按样品处理柱净化步骤进行,高效液相色谱仪测定,得出标准工作曲线。测量保留时间和峰面积,用峰面积和含量作图,绘制标准曲线。
1.6 计算
样品中软骨藻酸的残留量按下式计算。
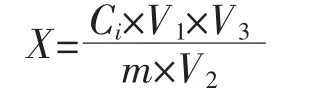
X/mg·kg-1为样品中软骨藻酸的残留量;Ci/μg·mL-1为标准曲线上查出试样溶液中软骨藻酸的浓度;V1/mL提取液总体积;V2/mL为净化用提取液体积;V3/mL为洗脱液体积;m/g为样品重量。
2 结果与讨论
2.1 提取时间的选择
设计超声波提取时间分别为2、3、5、7、10 min,经检测发现提取5 min时,提取接近完全,延长提取时间意义不大,故选取提取时间为5 min。
2.2 离子交换柱类型以及过柱条件的选择
(1)柱子类型:分别自行生产的I、II、III型阴离子交换柱,取适量提取液过柱净化洗涤后,用2 mL冰乙酸甲醇溶液洗脱;处理洗脱液后上高效液相色谱检测,以检验离子交换柱的净化效率,结果见表1,I型阴离子交换柱净化效果最佳。

表1 DA在不同离子交换柱的净化效果Tab.1 DA is purified by different anion exchange cartridges
(2)柱pH:用氨水调节提取液pH为7、9、11、14,过柱后收集洗脱液上机检测;结果表明:随着pH的升高,柱子上保留的杂质量也相应升高,严重影响检测。
(3)过柱体积:设定过柱的提取液体积分别为3、5、8、10、15 mL,过柱后收集洗脱液上机检测;试验发现:过柱提取液的体积过高或过低,都影响柱子的保留效率,体积过低及过高还会导致部分杂质保留在柱体上,影响检测结果。
(4)洗脱液的体积:试验表明,2 mL洗脱液基本能将柱子上吸附的目标物质完全洗脱下来,增加洗脱液的体积意义不大。
2.3 色谱条件的优化
配制了乙腈+0.1%三氟乙酸+0.02%庚烷磺酸钠、0.1%三氟乙酸+乙腈+甲醇和0.1%三氟乙酸+乙腈+0.5%庚烷磺酸钠溶液三种流动相,后2种峰形和分离度较差,因此采用乙腈+0.1%三氟乙酸+0.02%庚烷磺酸钠作为实验的流动相。
2.4 方法的精密度、线性关系
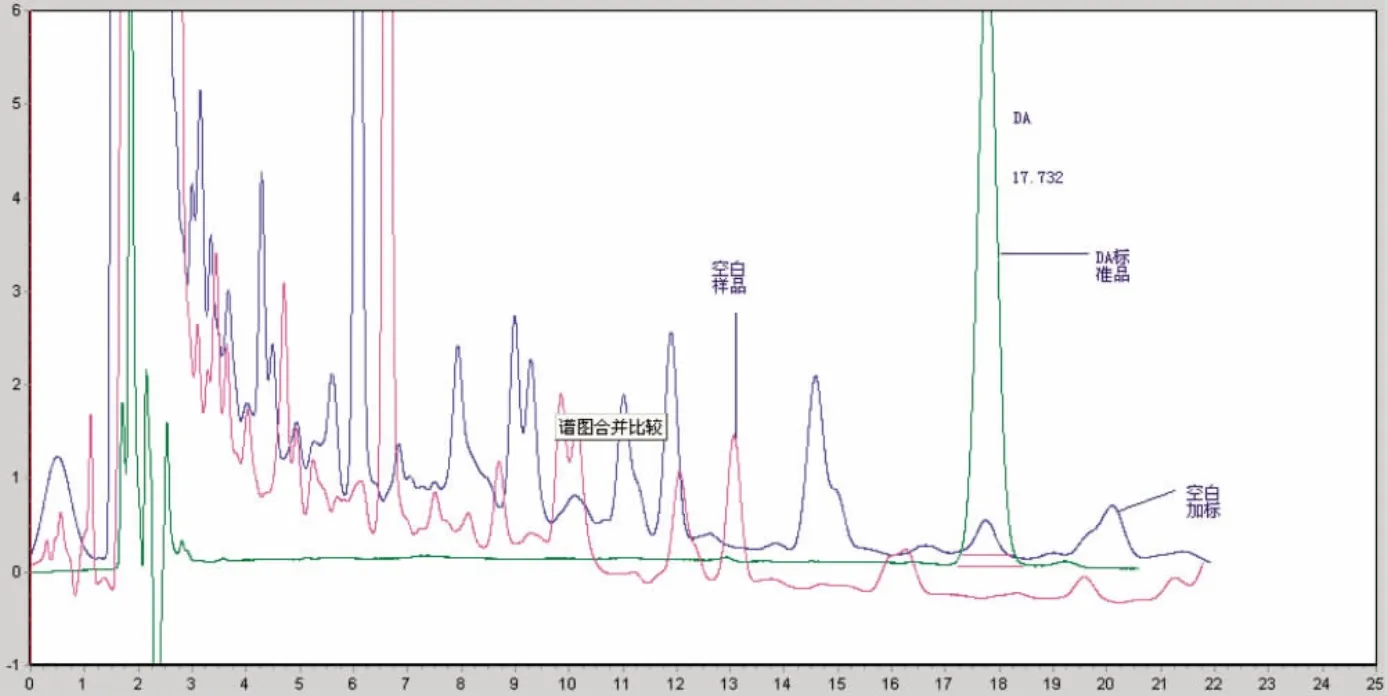
图1 软骨藻酸标品、空白样品、加标样品的高效液相色谱图,保留时间17.732 minFig.1 Chromatogram of DA standard,blank sample,spiked ample by HPLC,RT=17.732 min
配成浓度为0.1、1.0、2.5、10.0、25.0 μg/mL 的软骨藻酸标准溶液系列,进样20 μL,软骨藻酸的保留时间约为17.732 min,测量峰面积,计算平均值,求得回归方程Y=0.010 975 x+0.009 456,r=0.999 9,相对标准偏差分别为6.3%、4.8%、5.7%、3.9%、5.9%,平均为5.3%。
2.5 样品测定回收率试验
称取两批贝肉,在其中加入不同浓度的软骨藻酸标准品。各称取5.0 g,按照1.3样品处理中步骤进行,高效液相色谱仪检测定量。检测4组不同添加浓度的贝肉,计算测定方法回收率、精密度和检测下限,结果见表2。DA标准溶液、空白样品、空白样品添加色谱图如图1所示。

表2 样品中添加回收率及方法的精密度试验(n=5)Tab.2 Results of recovery test and precision of the method from fortified samples(n=5)
3 结论
综上所述,为检测贝类产品中的记忆缺失性贝类毒素软骨藻酸,采用甲醇水溶液进行提取,经过阴离子交换柱净化,正己烷萃取等处理,使用高效液相色谱仪进行检测。前处理时间短,处理后的样品中杂质少,该方法可达到下限200 μg/kg,准确度和精密度等性能指标符合相关要求,适用于贝类食品的检测。
[1]BERMAN F W,MURRAY T F.Domoicacidneurotoxicity in cultured cerebellar ganule neuronsis med-iated predominately by NMDA reactivated as a consequence of excitatoryreceptors that a amino acid rele-ase[J].Journal of Neurochemistry,1997,69:693-703.
[2]虞秋波,高亚辉.拟菱形藻软骨藻酸研究进展[J].海洋科学,2003,27(8):26-29.
[3]SCHOLIN C A,GULLAND F,DOUCETTE G J,et al.Mortality of sea lions along the central calif-arnia coast linked to a toxic diatom bloom[J].Nature,2000,403:80-84.
[4]XI D,RAMSDELL J S.Glutamate receptors and calcium entry mechanisms for domoic acid in hippo-campal neurons[J].Neuroreport,1996,7:1 115-1 120.
[5]BERMAN F W,MURRAY T F.Domoicacidneurotoxicity in cultured cerebellar granule neuronsis media-ted predominately by NMDA receptors that a reactivated as a consequence of excita-tory amino acid rele-ase[J].Journal of Veurochemistry,1997,69:693-703.
[6]BERMAN F W,LEPAGE K T,MURRAY T F.Domoic acid neurotoxicity in cultured cerebellar granule neurons is 21 controlled preferentially by the NMDA receptor Cainflux pathway[J].Brain Research,2002,924:20-29.
