电势降落对DNA分子器件电荷输运的影响
2012-07-13康大伟孙孟乐尤景汉姬江涛
康大伟,孙孟乐,尤景汉,姬江涛
(1.河南科技大学a.物理与工程学院;b.车辆与动力工程学院,河南 洛阳471003;2.洛阳理工学院 数理部,河南 洛阳471023)
0 前言
随着器件小型化和电路高集成度的发展,传统的集成电路将走到其物理极限。为了克服这一难题,一门新的多领域交叉学科——分子电子学应运而生。分子电子学是利用组装和合成工艺直接从分子尺度上“从下到上”的设计电路。脱氧核糖核酸(DNA)作为一种生物大分子,由于其独有的自组装和自识别特性,特别适合分子电子学的要求,DNA分子中的电荷输运性质已经成为生命科学、化学、物理学等多个交叉学科的研究热点。随着纳米技术的发展,近年来有很多实验直接将单个或一束DNA分子连接到金属电极间,来测量它的电导。这些实验可以更直接的揭示DNA的导电性质,也为DNA作为分子器件的可能性进行了直接的实验验证[1]。这类实验的结果比较复杂,揭示DNA分子可能是绝缘体、半导体、导体甚至超导体[2-7]。导电性的多样结果一是源于DNA本身的性质,DNA的多种序列和分子形态;二是来源于外界环境的影响:温度,溶液中的离子,电极与DNA分子的接触[8-11]。在直接测量实验中,金属电极与DNA分子界面处的良好接触是实验可重复性的一个重要因素,因此有必要研究界面的影响。DNA分子与电极间的连接是实验结果可重复性的一个关键因素,降低界面处的接触电阻是提高器件导电特性的一个有效途径。最近的实验中[12],DNA分子器件中出现了负微分电导现象,实验结果发现通过DNA分子的电流随着电压的升高反而出现了下降的趋势。在以前的研究中,往往假设电势全部降落在DNA分子与电极的界面处,而在DNA分子上电势降落为零。如果考虑DNA分子上有电势降落,负微分电导的出现是否与界面处的电势降落有关需要进一步的研究。本文拟采用格林函数方法和Landauer-Büttiker公式来研究不同的界面电势降落情况下DNA分子器件中的电荷输运性质。
1 模型和方法
对于金属电极连接的DNA分子器件(见图1),选取1个螺旋周期(包含11个基对)的Poly(G)-Poly(C)DNA分子。整个体系的哈密顿可以用下式来表示
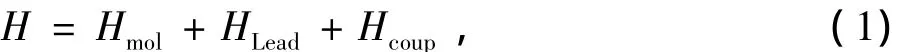
其中Hmol描述了Poly(G)-Poly(C)DNA分子的π轨道。

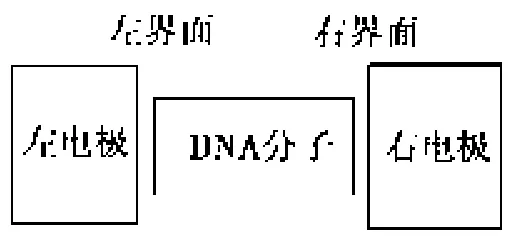
图1 DNA分子器件示意图
金属电极的哈密顿由下式给出
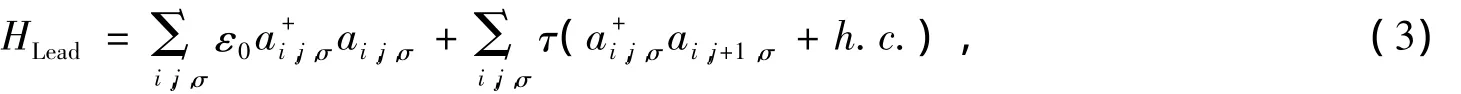
其中,ε0和 τ分别是电极的在位能和相邻格点的跃迁积分是电极中在格点(i,j)位置上产生或消灭一个自旋为σ的电子的算符。
Hcoup描述了电极与DNA分子间的耦合,这个耦合只发生在金属电极和DNA分子的接触界面上
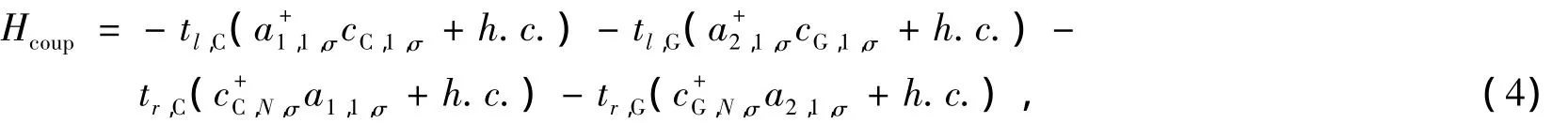
其中假定界面耦合是自旋非相关的。
通过体系的电流就可以通过Landauer-Buttiker公式给出,
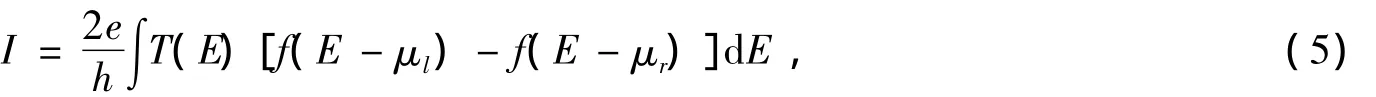
其中,h是普朗克常数;T(E)是电子从左电极到右电极的透射系数
是电极中的费米分布函数,其中μl(r)是左(右)电极的化学势,kB是玻耳兹曼常数,T是温度。透射系数T(E)可以通过Fisher-Lee关系从体系的晶格格林函数得出,


其中I是单位矩阵算符。
本文中参数的选取如下:对于Poly(G)-Poly(C)DNA分子,将其最低占据能级(LUMO)设为在位能:εG=1.14 eV,εC=-1.06 eV。一条链上相邻碱基间的跃迁积分设为tG(C)=0.45 eV,链间的互补碱基间的跃迁积分设为t⊥=0.60 eV,这些都是在参数选取的合理区间。金属电极参数的选取为:τ=1.50 eV。电极的费米面选在DNA带隙的中间。界面耦合设为自旋非相关的,取值为0.40 eV。本文选取的温度为室温T=300 K。
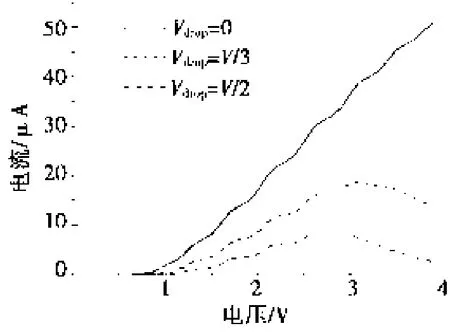
图2 DNA分子器件在不同的电势降落下的电压电流曲线
2 结果与讨论
在金属电极连接的DNA分子器件电荷输运性质的直接实验测量中,分子与电极间良好的界面接触是实验数据可重复性测量的必要条件。当DNA分子与金属电极形成良好的接触后,在金属电极施加外加偏压,这时候左右两个电极处在高低两个不同电势下。在以往的研究中,往往假设电势对称的降落在DNA分子与金属电极的界面处,具体情况为左右两个界面处各降落V/2。这种情况下系统的输运性质如图2中所示。当电压比较小时,体系的电流基本为零,此时金属电极的费米面处于DNA分子禁带内,因此没有分子轨道进入导电窗口。当电压大于0.7 V时,电流开始显著增大,对应着DNA分子的导电能级开始进入导电窗口。随着电压的进一步增大,更多的导电分子能级进入导电窗口,这导致电流进一步增大。因此,此时的电压电流曲线呈现出非线性的单调递增的趋势。由电流随着电压的上升趋势可以看出:在某个导电能级进入导电窗口时,电流上升趋势很快;当电极费米面处在两个导电能级间时,电流随着电压的上升趋势较缓。体系通过的电流在电压为4 V时达到了50 μA,此结果与最近的实验[12]符合。
在实际的实验中,如果分子与电极的界面处电势降落小于电极上施加的电压,则有部分电压会降落在DNA分子上。电势降落不只是发生在界面处的情况下,图2的虚线和点划线分别给出了DNA分子中的电势降落达到总电势降的1/3和1/2两种情况下的电压电流曲线。由图2可以看出:DNA分子上的电势降落压制了通过其中的电流。在低电压下,电流将小于无电势降落的情况。而且随着电压的继续升高,当电压大于3 V时电流反而出现了下降的情况,即出现了负微分电导现象。当DNA分子上的总电势降落所占的比重更大时,即电势有一半降在分子上时,电流进一步降低,而且在电压大于2.6 V时就开始出现负微分电导现象。所以在DNA分子上的电势降落越大,体系的电流越小。而在相同的电势降落下,随着电压的升高,都会出现负微分电导现象。对于DNA分子中电压降落Vdrop=V/3这种情况,当电压达到3 V左右时,电流开始随着电压的升高而降低。而当Vdrop=V/2时,当电压达到2.5 V左右时,电流就会随着电压的升高而降低。可见,随着电势降落在DNA分子上的比例的升高,其负微分电导出现的电压值越低。
为了具体分析产生负微分电导的原因,画出了在不同的电势降落下,LUMO能级(最低未占据能级)对应的波函数的形状。如图3a所示,其中纵坐标为波函数的数值,横坐标为DNA分子碱基对应的坐标。当DNA分子中不存在电压降落时,LUMO能级对应的波函数是扩展在整个分子中的,而扩展的分子轨道可以提供较大的电子透射几率,此时通过体系的电流较大。当 DNA分子中存在电势降落时,如图3b所示,LUMO能级对应的波函数局域在DNA分子的右端,局域轨道阻碍了电子的隧穿,从而降低了通过体系的电流。负微分电导的出现可以解释为:随着偏压的增大,DNA分子上的电势降落持续增大,因而各个导电的分子轨道倾向于局域化,这个效应是减少电流的趋势。另一方面,电压增大导致更多的导电通道进入导电窗口,这是电流增加的趋势。当两方面的因素相互达到平衡时,电流随着电压的升高开始出现拐点,当电压继续增大时,分子轨道局域化的效应开始压制更多导电通道进入导电窗口的效应,因此,电流开始随着电压的升高而下降。
如果电压降落在DNA分子上的比例相对于降落在界面处的比例很小时,波函数的局域效应较弱,而随着电压升高更多的导电通道进入导电窗口,这个效应占主要,所以电流随着电压升高会持续上升。在早期的DNA分子器件导电实验中[13-15],是通过物理吸附将DNA分子与电极连接,DNA分子与金属电极间的连接不是化学连接,所以接触电阻较大。此时,电势将主要降落在界面处。如果界面处接触很好,电压将被迫降落到DNA分子上,当电压降的比例升高到一定程度,就会出现负微分电导的现象。
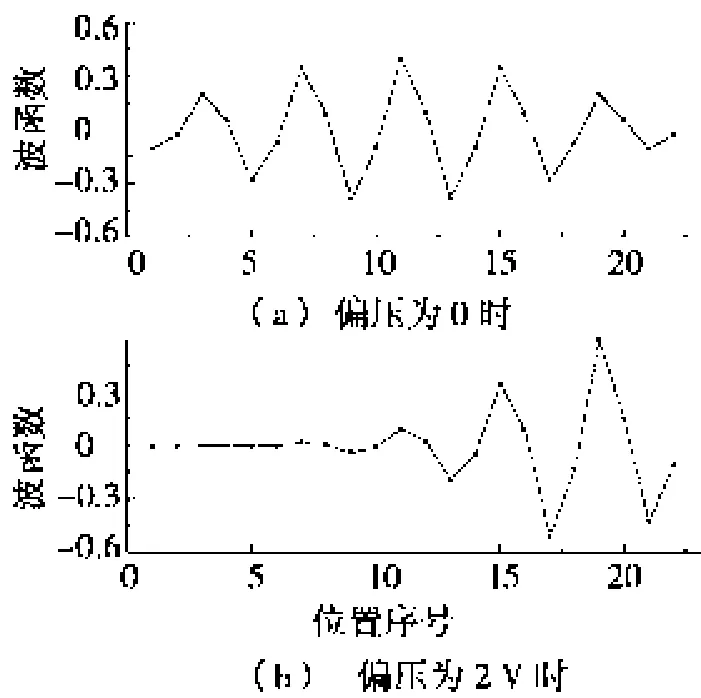
图3 LUMO能级的波函数
3 结论
研究了DNA分子器件中电势降落分布对电荷输运性质的影响。当电势降落全部在界面时,电流随着电压升高是持续上升的;当电势开始降落在DNA分子上时,电流相比DNA分子上没有电势降落的情况会有所降低,而且开始出现负微分电导的现象;当电势降落在DNA分子上的比例进一步提高时,负微分电导出现时对应的电压值更小,而且下降的趋势更明显。分析了产生负微分电导的原因,发现电势降落引起的分子轨道的局域是主要因素,电势降落越大,分子局域现象越明显,这就进一步促使了负微分电导的出现。
[1]Endres R G,Cox D L,Singh R R P.Colloquium:The Quest for High-conductance DNA[J].Rev Mod Phys,2004,76:195 -214.
[2]Fink H W,Schonenberger C.Electrical Conduction Through DNA Molecules[J].Nature,1999,398:407 -410.
[3]Porath D,Bezryadin A,Vries S de,et al.Direct Measurement of Electrical Transport Through DNA Molecules[J].Nature,2000,403:635 -638.
[4]Roy S,Vedala H,Roy A D,et al.Direct Electrical Measurements on Single-molecule Genomic DNA Using Single-walled Carbon Nanotubes[J].Nano Lett,2008(8):26 - 30.
[5]Song B,Elstner M,Cuniberti G.Anomalous Conductance Response of DNA Wires Under Stretching[J].Nano Lett,2008(8):3217-3220.
[6]Xu B Q,Zhang P M,Li X L,et al.Direct Conductance Measurement of Single DNA Molecules in Aqueous Solution[J].Nano Lett,2004(4):1105 -1108.
[7]Yoo K H,Ha D H,Lee J O,et al.Electrical Conduction Through Poly(dA)-Poly(dT)and Poly(dG)-Poly(dC)DNA Molecules[J].Phys Rev Lett,2001,87(19):198102.
[8]Cuniberti G,Craco L,Porath D,et al.Backbone-induced Semiconducting Behavior in Short DNA Wires[J].Phys Rev B,2002,65:241314.
[9]Guo A M,Xiong S J.Effects of Contact and Efficient Charge Transport in G4-DNA Molecules[J].Phys Rev B,2009,80:035115.
[10]Maciá E,Triozon F,Roche S.Contact-dependent Effects and Tunneling Currents in DNA Molecules[J].Phys Rev B,2005,71:113106.
[11]Wang X F,Chakraborty T.Charge Transfer Via a Two-Strand Superexchange Bridge in DNA[J].Phys Rev Lett,2006,97:106602.
[12]Ning K,Artur E,Elke S.Observation of Negative Differential Resistance in DNA Molecular Junctions[J].Appl Phys Lett,2010,96:023701.
[13]Cohen H,Nogues C,Naaman R,et al.Direct Measurement of Electrical Transport Through Single DNA Molecules of Complex Sequence[J].Proc Nat Acad Sci,2005,102:11589.
[14]Ullien D,Cohen H,Porath D.The Effect of the Number of Parallel DNA Molecules on Electric Charge Transport Through‘Standing DNA’[J].Nanotechnology,2007,18:424015.
[15]Nogues C,Cohen S R,Daube S,et al.Sequence Dependence of Charge Transport Properties of DNA[J].J Phys Chem B,2006,110:8910.1a21a1b
