苯酚在实验红鲫C1HD系体内富集的实验研究
2012-07-05董先辉张朝晖梁世杰高丽君朱晓娟吴端生
董先辉,张朝晖,梁世杰,高丽君,朱晓娟,吴端生
1.南华大学药学与生命科学学院,湖南衡阳 421001
2.南华大学公共卫生学院,湖南衡阳 421001
苯酚是重要的有机化工原料,用它可制取酚醛树脂、己内酰胺、双酚A、水杨酸、苦味酸、五氯酚、2,4-D、己二酸、酚酞n-乙酰乙氧基苯胺等化工产品及中间体,在化工原料、烷基酚、合成纤维、塑料、合成橡胶、医药、农药、香料、染料、涂料和炼油等工业中有着重要用途[1]。
在中国苯酚作为产品或中间产物的大量使用,使其成为地表水中的第一大类水体污染物,对水生生态环境存在一定的生态风险[2]。苯酚属细胞原浆型毒物,低质量浓度下可使蛋白质变性,高质量浓度时使蛋白质凝固,为神经性毒剂。水体环境中的苯酚对水生生物尤其是鱼类危害严重,不仅可造成鱼虾发生急性中毒死亡,而且易在水生生物体内富集影响水产品的品质[3],富集的苯酚随食物链迁移将存在危害人体健康的风险。为了寻找检测水环境毒物毒性水平的新方法,探讨实验红鲫作为模式动物用于水环境污染物检测和化学品毒性试验的可行性,本文观察了苯酚在实验红鲫C1HD系体内的富集和解富集过程。
1 试验材料及仪器
1.1 苯酚
苯酚(C6H6O,phenol)又名石碳酸,羟基苯,分子式为C6H5OH,呈弱酸性,熔点为43℃,沸点为181.9℃,相对密度为1.0576,常温下微溶于水,易溶于有机溶剂,腐蚀性极强,在空气中易被氧化而常呈粉红色[4];本实验用分析纯苯酚购于湖南汇虹试剂有限公司。
1.2 其他药品或试剂
三氯甲烷、氯化铵、氨水,分析纯,均购于湖南汇虹试剂有限公司;4-氨基安替比林,分析纯,购于天津市光复精细化工研究所;铁氰化钾,分析纯,购于长沙市分路口试剂化工厂。
1.3 主要仪器
250ml分液漏斗,功率可调电热炉。250ml全玻璃蒸馏器,紫外可见分光光度计(SHIMADZU UV2450),10mm光程比色皿。
1.4 实验动物
实验红鲫C1HD系,为本实验室培育并提供。
2 方法
2.1 实验红鲫饲养方法
试验用水为曝气3d的自来水pH值6.54、溶氧量6.21mg/L、水温(20±4)℃。水中不含苯酚。试验用鱼为驯养2周以上,7d内死亡率为0%。采用半静态式饲养方式,每天定时换入一半体积新鲜饲养用水。清除阶段将在吸收试验所用红鲫放置在无酚水中继续饲养。空白对照组,一直饲养在无酚水中。试验期间不进行喂食及增氧泵增氧。每天定时测定饲养环境温度、pH值及溶氧量等参数。每隔四天从各浓度组平衡样中随机抽取2尾摘取内脏组织,用于分析。
2.2 96h LC50测定及试验浓度分组
96hLC50试验方法参考文献[5]。根据96 h LC50设置LC50/10、LC50/100两个苯酚浓度组及空白对照组,各浓度组设置两个平行样。
2.3 苯酚的提取及浓度测定
解剖红鲫摘取内脏,无酚水清洗去除杂质,滤纸擦干后称重,匀浆器混合研磨内脏组织(肠、心、肝胰脏等)至匀浆状态,无酚水定容至100mL。水中苯酚提取及测定参考中华人民共和国国标GB7490-87:水质挥发酚的测定采用蒸馏后4-氨基安替比林分光光度法[6,7]。
2.4 统计学分析
数据用平均数±标准差表示,分组之间用t检验。
3 结果
3.1 苯酚对红鲫的96 h LC50
实验得到各苯酚浓度组红鲫致死情况如表1所示。直线内插法求得96hLC50为37.02mg/L。以此设置两个实验浓度组LC50/1000.3702mg/L和LC50/103.702mg/L。
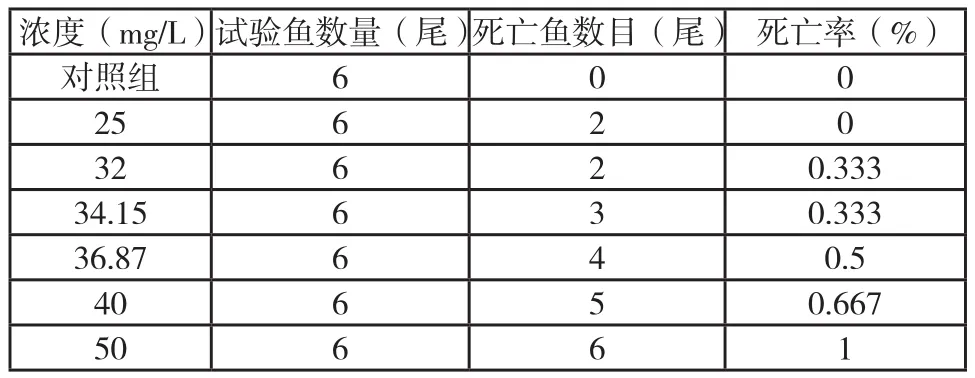
表1 红鲫96 h死亡情况
3.2 苯酚在红鲫体内的富集含量
苯酚在红鲫体内的富集动态变化见表2。32d时LC50/100和LC50/10浓度组富集稳定态苯酚含量分别为0.7998±0.0088mg/g,1.4095±0.0039mg/g。LC50/100浓度组要比LC50/10提前进入富集稳定态。LC50/100和LC50/10浓度组苯酚吸收速率常数K1分别为0.03333mg/gd,0.04405mg/gd。富集达到稳定态一半浓度需要时间分别为11.39d,10.71d。经t检验试验期最终稳定态含量,两组内脏组织苯酚含量差异显著(P<0.05),这表明内脏组织内苯酚含量随水中浓度升高而升高。

表2 苯酚在红鲫内脏组织的积累(X±SD)
BCFss稳定态生物富集系数(steaty state bioconcentration factor)=单位质量组织含酚量/水酚浓度;T:富集至稳定态受试物含量50%所用时间;K1=吸收速率常数(uptake rate constant)。
3.3 苯酚从红鲫体内的解富集过程
苯酚的解富集动态变化如表3所示。按Renfro(1973)方法[9]得LC50/100和LC50/10浓度组内脏组织内苯酚24d的残留量分别为23.13%,13.57%;释放率分别为76.87%,86.43%;解富集生物半衰期分别为:10.72d,10.14d;清除速率系数K2分别为:0.02851mg/gd,0.05638mg/gd。

表3 苯酚在红鲫内脏组织的解富集(X±SD)
4 讨论
近年来,国内外关于酚类物质对于鱼类急性毒性作用及分子毒理学方面的研究有较多的报道,但较少有酚类物质在鱼类体内富集的实验研究的报道。1977年湖北长江水产研究所做过酚在鱼体内积聚及消除的研究[10]及2001年魏爱泓等研究过鲤对酚的积累、分配和释放[3]。后者设置0.005mg/L,0.025mg/L,0.05mg/L3个浓度组,分别对应的在肌肉组织内的富集浓度为0.3982±0.063mg/kg,0.7531±0.081mg/kg,1.0921±0.39mg/kg, 与本实验结果相差较大,主要在于不同的处理浓度。这也说明在鱼体内的最终富集含量与鱼生存的水环境苯酚的浓度直接相关,水环境中苯酚含量越高最终富集稳定态苯酚含量越高。根据魏爱泓的研究,在解富集的过程,生物半衰期随着水环境苯酚浓度的增加逐渐延长,分别为5.52d,8.03d,13.90d,比较本实验的高浓度组为10.14d和低浓度组为10.72d,也相差较大,分析原因可能是鱼体内不同组织解富集的方式有很大的区别,且与富集含量相关性较高。一方面,内脏组织的解富集在本实验设置的浓度范围内生物半衰期相差不大,这可能是由于内脏组织代谢较旺盛且与水环境更加贴近从而更利于富集化学品的清除,至于在更宽的浓度范围是否生物半衰期有所改变,还需要进一步实验验证;另一方面,内脏组织生物半衰期相比较肌肉组织较长,分析可能是在较高富集含量时,鱼自身防御能力提高新陈代谢,致使清除苯酚能力提高,降低了生物半衰期,即在一定范围内生物半衰期随苯酚富集含量的提高会有所降低。
全球苯酚需求的年均增长率将达到4%~5%,2006年苯酚需求量就达到了800万t。2004年,我国苯酚生产能力为74.0万t/a,产量约41.0万t,近年国内苯酚消费量以每年约9%的速度在递增[11]。本文通过探讨不同浓度苯酚在红鲫C1HD系体内的富集、解富集的规律,得出苯酚在鱼体内的动态富集稳定态含量、富集系数,解富集残留量,释放率及生物半衰期等参数,这将为渔业水质监测及水产品质量保证提供了参考数据。
水生动物中鱼类具有某些独特的生物学特性,可以用于胚胎学、遗传学等基础医学以及实验动物医学,比较医学,环境毒理学,化学品毒性检测等应用性研究[12]。作为实验鱼类,国外已有斑马鱼(Danio rerio)、青鳉(Oryzias latipes)等10余种。我国还没有本土标准化的实验鱼类正式注册。目前已培育出“准”标准化的实验鱼类仅仅只有中国水产科学院珠江水产所培育的实验剑尾鱼(Xiphophorus helleri)、中国科学院水生生物研究所培育的稀有鮈鲫(Gobiocypris rarus)和本实验室培育的实验红鲫(Carassius auratus red variety)。红鲫C1HD系用于环境毒理学研究,一方面,其体型比国际通用实验斑马鱼较大而更有利于富集含量较低,污染物浓度较低或检测限较高化学品的检测;另一方面,其生长生存能力较强,更利于毒性较强化学品或污染程度较高水域毒性研究。这些独特的优势表明实验红鲫是一种很有开发价值的毒理学实验动物。
[1]国家环境保护总局:水和废水监测分析方法.北京:中国环境科学出版社,2002:725-729.
[2]Qu J, Fan M: The current state of water qua1ity and techno1ogy deve1opment for water po11ution contro1 in China.Critica1 Reviews in Environmenta1 Science and Techno1ogy,2010,40(6):519-560.
[3]魏爱泓,徐虹,朱毅.鲤对酚的积累、分配和释放研究.水产科学,2001,20(1):12-14.
[4]Young JA: Pheno1.Journa1 of Chemica1 Education 2007,84(5):755-759.
[5]M.Y.Garakouei ZP, M.Tatina,H. Khara: Median Letha1 Concentration (LC50) for Suspended Sediments in Two Sturgeon Species, Acipenser persicus and Acipenser ste11atus Finger1ings. Journa1 of Fisheries and Aquatic Science 2009,4(6):285-295.
[6]国家环境保护总局: 水质挥发酚的测定,蒸馏后4-氨基安替比林分光光度法.中华人民共和国国标GB7490-87,1987:130-137.
[7]Zhang PP, Shi ZG, Feng YQ: Determination of pheno1s in environmenta1 water samp1es by twostep 1iquid-phase microextraction coup1ed with high performance 1iquid chromatography.Ta1anta,2011,85(5):2581-2586.
[8]国家质量监督检验检疫总局:化学品 生物富集 半静态式鱼类试验. 中华人民共和国国家标准GB/T 21858-2008,2008.
[9]Renfro: Radio cadmiam exchange with seawater by fundu1us betero c1itus.J.Fish Bio1,1974,6,6:601-612.
[10]湖北省长江水产研究所资源捕捞室污水研究组:酚在鱼体内积聚及消除的研究.环境科学,1977(4):41-43+64.
[11]焦凤茹,庞振涛.苯酚国内外市场分析.化工技术经济,2005(9):21-24.
[12]江千秋,刘冬娥,田智,吴端生.鱼类实验动物的生物学特性及应用.湖南环境生物职业技术学院学报,2006(2):129-132.
