枸杞功能性成分的提取及其组成的液相色谱分析
2012-07-01王茂山荀其宁
王茂山 荀其宁
(济南大学酒店管理学院,济南 250001) (山东非金属材料研究所,济南 250031)
枸杞功能性成分的提取及其组成的液相色谱分析
王茂山 荀其宁
(济南大学酒店管理学院,济南 250001) (山东非金属材料研究所,济南 250031)
对枸杞子中的水溶性多糖成分进行了分离提取及组成分析。采用水提、醇沉等方法提取枸杞子中的多糖成分,用Sevage 法除去蛋白质后,用凝胶色谱法进行多糖的纯化,制备3-甲基-1-苯基-2-吡唑啉酮(PMP)衍生物进行液相色谱分析。结果表明,枸杞多糖由鼠李糖、阿拉伯糖、木糖、葡萄糖、半乳糖5 种单糖组成,其含量分别为5.28%,17.87%,38.29%,17.82%,20.74%。
枸杞多糖;液相色谱;单糖组成
枸杞具有滋补肝肾,益精明目的作用。现代药理学认为枸杞多糖是枸杞中主要有效成分之一。枸杞多糖是一种非特异性免疫增强剂,具有增强免疫力、抗癌、抗氧化[1]、防衰老、增加造血功能、防止遗传损伤等作用[2,3]。因此枸杞多糖可作为第3代功能性食品的功能因子,并且具有很好的开发前景[4]。
近年来,随着人们生活水平的提高,由以治病为主向防病为主的观念转变,为功能性食品的开发带来了良好机遇。功效明确的枸杞多糖符合新一代功能性食品的要求,枸杞多糖的研究将推动枸杞产品向更高层次发展。目前对枸杞多糖含量的测定方法主要有紫外–可见分光光度法[5–8],如硫酸–苯酚法、硫酸–蒽酮法,3,5-二硝基水杨酸比色法(测定总糖)。笔者采取一种新的提取工艺得到枸杞多糖精品,即采用3-甲基-1-苯基-2-吡唑啉酮(PMP)在碱性条件下与单糖定量缩合生成单糖PMP 衍生物,用常规的紫外检测器和C18烷基键合柱,建立适于多糖单糖组成测定的高效液相色谱法。该法灵敏、快速、准确,可用于在线大批量样品分析。
1 实验部分
1.1 主要仪器与材料
高效液相色谱仪:1260型,配有紫外及蒸发光检测器,C18烷基键合柱,美国安捷伦公司;
电子天平:AB135–S型,瑞士梅特勒公司;
真空冷冻干燥机:LGJ–10型,北京松原华兴科技发展有限公司;
循环式真空水泵:SHZ–3型,上海越众仪器设备有限公司;
旋转蒸发器:RE52–3型,金坛市中正仪器制造有限公司;
低速离心机:TDZ5–WS型,长沙湘智离心仪器有限公司;
电子恒温水浴锅:80–1型,江苏省金坛市环宇科学仪器厂;
自动分步收集器:BAZ–100型,天津市琛航科技仪器有限公司;
电脑恒流泵:DHL–A型,苏州江东精密仪器有限公司;
枸杞子:宁夏枸杞的干燥成熟果实,购于药店;
95%乙醇、三氟乙酸、3-甲基-1-苯基-2-吡唑啉酮(PMP)、氢氧化钠、无水乙酸酐、氯仿等试剂:分析纯;
鼠李糖、阿拉伯糖、木糖、葡萄糖、半乳糖标准单糖:色谱纯。
1.2 枸杞多糖的制备及分析条件的选择
(1)枸杞多糖粗品的制备
称取枸杞样品5 g,粉碎后加入约10倍体积的蒸馏水,调节溶液至pH 11,于100℃水浴提取2 h,重复4次;合并滤液,于60℃真空浓缩至一定体积,以体积分数95%的乙醇沉淀,过滤;滤渣加5倍体积的丙酮–石油醚混合液(体积比1∶1),于50~60℃水浴浸提1 h,过滤,得沉淀,于60℃真空干燥1 h,再于90~105℃干燥箱中烘干,得灰白色枸杞多糖粗品。
(2)脱蛋白多糖的制备
取多糖粗品,加蒸馏水充分溶解,用Sevage法脱蛋白[9],离心,取上清液对流水透析48 h,再对蒸馏水透析24 h,无水乙醇沉淀,抽率得沉淀,真空冷冻干燥,即得脱蛋白多糖。
(3)多糖精品的制备
取适量脱蛋白多糖,加蒸馏水充分溶解,上Sephadex G–75凝胶色谱柱,用蒸馏水洗脱,自动分步收集(4.5 mL/管),苯酚-硫酸法检测,合并主峰收集管液,60℃真空浓缩,冷冻干燥,得精制的枸杞多糖。
(4)多糖水解
称取10 mg精制的枸杞多糖样品于安瓿瓶中,加入2 mL 2 mol/L的三氟乙酸[10,11],封管后置于120℃干燥箱中水解,2 h后取出冷却,离心后取上清液,真空浓缩至干,得单糖样品置于干燥箱中备用。
(5)标准单糖的衍生化
称取鼠李糖、阿拉伯糖、木糖、葡萄糖、半乳糖各约10 mg,分别加入物质的量为上述单糖2倍的3-甲基-1-苯基-2-吡唑啉酮(PMP),调节pH值使溶液成碱性,充分振荡溶解,于60℃水浴反应30 min,取出,冷却到室温,真空浓缩蒸干,即可进行液相色谱分析。
(6)样品单糖的衍生化
在上述备用的枸杞多糖水解产物中,分别加入物质的量为2倍的3-甲基-1-苯基-2-吡唑啉酮(PMP),调节pH值成碱性,充分振荡溶解,于60℃水浴反应30 min,取出,冷却至室温,真空浓缩蒸干,即可进行液相色谱分析。
1.3 液相色谱分析条件
色谱柱:C18色谱柱(4.6 mm×250 mm);紫外检测器;检测波长:250 nm;柱温:室温;进样量:20μL;流动相:溶剂A为15%乙腈–20 mmol/L乙酸铵水溶液,溶剂B为40%乙腈–20 mmol/L乙酸铵水溶液,流速为1.2 mL/min;梯度洗脱程序见表1。
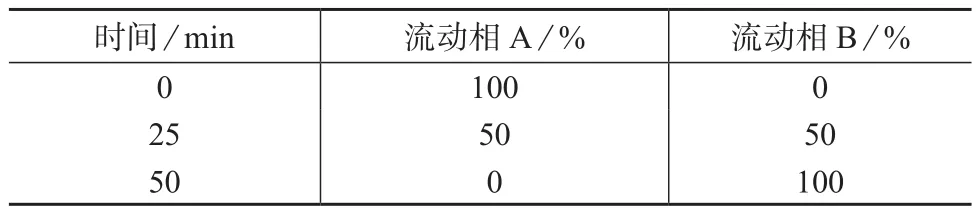
表1 梯度洗脱程序
2 结果与讨论
2.1 样品提取时水料比
水料比对提取效果影响较大,随着水料比升高,多糖得率增加。试验结果表明,水料比由15∶1增到20∶1时,多糖得率仅增加0.14%,多糖得率的增加幅度下降,同时考虑到水量过大,多糖溶液被稀释,反而加大后序过程的难度,增加能耗,因此确定水料比为(10~15)∶1。
2.2 多糖水解时用酸
多糖的水解常用硫酸,其用量不易控制,过多会导致多糖样品的炭化而产生杂质峰;过少又会水解不完全。本法采用三氟乙酸可较好地实现多糖的水解。
2.3 标准单糖分析
将不同产地的枸杞多糖按照相同方法制备供试品溶液,分别进样记录色谱图。比较各产地枸杞中提取的枸杞多糖,确定了共有的指纹峰,并通过对照品的色谱图,确定了主要的指纹峰。采用国家药典委员会制定的中药色谱相似度评价系统计算软件分析,将全谱导入后,经谱图处理,以软件自动生成的对照图谱为参照图谱,通过多点校正将谱峰进行比较,得到相似度结果,查看各样品的相关性和区别。
2.4 样品多糖中各组分的定性分析
根据各色谱峰与标准单糖的保留时间对照,可知枸杞多糖水解物液相色谱图中各峰代表的单糖分别为鼠李糖、阿拉伯糖、木糖、葡萄糖、半乳糖,分析结果见图1及表2。
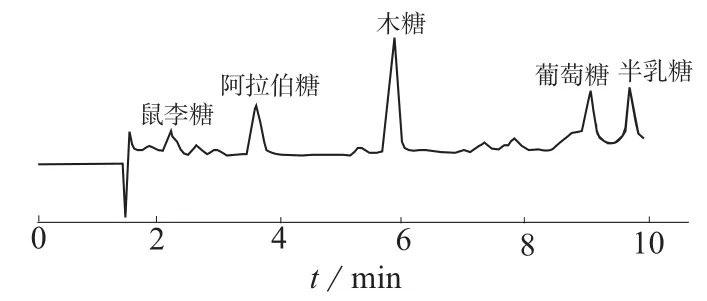
图1 枸杞多糖水解产物的液相色谱图
2.5 枸杞多糖中各单糖组分含量的测定
组成枸杞多糖的各单糖组分含量的测定依据液相色谱面积归一化方法,由液相色谱检测结果可知,枸杞多糖由鼠李糖、阿拉伯糖、木糖、葡萄糖、半

表2 各单糖的出峰时间
乳糖5种单糖组成,其含量测定结果见表3。
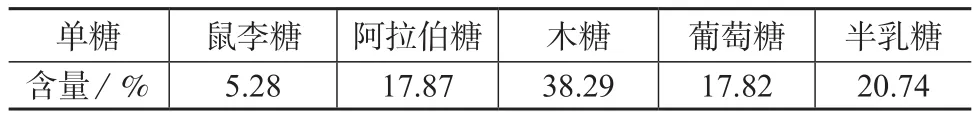
表3 枸杞多糖的单糖含量
3 结论
(1)PMP与糖类物质衍生时反应条件温和,产物无立体异构。两分子PMP与一分子单糖缩合,生成的衍生物与各单糖的定量关系明确,线性关系良好,检测灵敏度较高,可同时检测醛糖、酮糖及糖醛酸。PMP衍生物在254 nm处有强烈的紫外吸收,克服了单糖本身没有紫外吸收的特点,同时使用紫外检测器克服了示差检测器灵敏度低,不适用于梯度洗脱的缺点。
(2)采用PMP衍生物液相色谱法进行枸杞多糖的组成分析,结果表明,该方法能较好地实现枸杞多糖水解产物的衍生,其衍生物制备简便、试剂易得,且每种单糖均可得到单一的色谱峰。
[1] 张静丽,王宏勋,张雯,等.灵芝、枸杞多糖复合抗氧化作用[J].食品与机械,2004,20(6): 11–13.
[2] 田庚元.枸杞子糖缀合物的结构与生物活性研究[J].世界科学技术-中医药现代化,2003,5(4): 22–30.
[3] 王涛,赵谋明.多糖的研究进展[J].现代食品科技,2007,23(1): 103–106.
[4] 宋国安.枸杞籽的药用保健价值与开发前景[J].中国食物与营养,2005(7): 26–28.
[5] 唐琍萍,王强,刘红宁,等.紫外分光光度法测定枸杞中多糖含量[J].亚太传统医药,2008,4(1): 30-31.
[6] 段昌令,乔善义,王乃利,等.枸杞子活性多糖的测定[J].药学学报,2001,36(3): 196–199.
[7] 钱士辉.枸杞多糖注射中间体总多糖含量测定[J].中国野生植物资源,1995(2): 43-44.
[8] 甘璐,张声华.枸杞多糖纯度与四个级分含量的测定.食品科学,1999(1): 52-53.
[9] 李卫旗,何国庆,李志昂.金耳水溶性多糖JP–2的分离及化学结构的研究[J].中国食品学报,2003,3(3): 13-17.
[10] 张惟杰.复合多糖生化研究技术[M].2版.杭州:浙江大学出版社,1999: 38–40.
[11] 何碧烟,戴民汉,曹莉,等.气相色谱法分析海洋沉积物中多糖的组成[J].海洋与湖沼,2003,34(3): 233–240.
Extraction of Lycium Barbarum L Functional Components and Analysis by Liquid Chromatography
Wang Maoshan
(Hotel Management College of Jinan University, Jinan 250001, China )
Xun Qining
(Shandong Nonmetallic Material Institute,Jinan 250031, China)
Water-soluble polysaccharide was isolated and extracted from Lycium barbarum L. The components of the water-soluble polysaccharide were identified and quantified by liquid chromatography(LC).The polysaccharide was extracted by water and deposited by ethano1, then the extract was deproteinated by Sevage method and further puri fi ed by Sephadex G–75 column. The results showed that the Lycium barbarum polysaccharide(LBP) contained rhamnose,arabinose,xylose,glucose,galactose,and their content were 5.28%,24.87%,31.29%,17.82%,20.74%,respectively.
Lycium barbarum polysaccharide; liquid chromatography; component
O657.7
A
1008–6145(2012)03–0075–03
10.3969/j.issn.1008–6145.2012.03.020
联系人:荀其宁;E-mail: xunqining@163.com
2012–03–14
