液相色谱法测定番茄制品中链霉素和双氢链霉素的残留量*
2012-07-01巩志国苏敏员丽娟李世雨季新成
巩志国,苏敏,员丽娟,李世雨,季新成
(新疆出入境检验检疫局技术中心,乌鲁木齐 830063)
液相色谱法测定番茄制品中链霉素和双氢链霉素的残留量*
巩志国,苏敏,员丽娟,李世雨,季新成
(新疆出入境检验检疫局技术中心,乌鲁木齐 830063)
建立了测定番茄制品中链霉素和双氢链霉素残留量的净化方案。样品中的残留物用磷酸盐缓冲液(pH 4)提取,经分散固相萃取法初步净化后,再经串联双柱固相萃取净化,用RP C18(Symmetry Shield)色谱柱在梯度洗脱下分离待测物,外标法定量。链霉素的线性范围为0.05~0.8 mg/L,相关系数r>0.999 8。方法的回收率为71%~95%,定量限(S/N=10)为0.1 mg/kg,测定结果的相对标准偏差为2.6%~10.5%。该方法操作简便,净化效果好,灵敏、准确,检测成本低,适用于检测和分析番茄制品中链霉素和双氢链霉素的残留量。
番茄;链霉素;双氢链霉素;串联双柱净化;液相色谱
链霉素(Streptomycin)属于氨基糖苷类抗生素中的常用药物,对多种植物细菌性病害有良好的防治效果,如可以有效地防治西红柿青枯病和黄瓜细菌性角斑病等。但是,该抗生素对人体有一定的毒副作用,如果食品中残留过量的链霉素,则会对人体造成严重危害,链霉素还具有潜在的致畸、致突变和致癌作用[1]。日本肯定列表中对于番茄中链霉素和双氢链霉素总量的限量为0.3 mg/kg[2]。目前,我国是世界第一大番茄制品出口国,番茄制品是我国重要的农产品出口品种之一。番茄制品中链霉素残留量检测方法的建立,对提高我国番茄制品检测技术水平,促进我国农产品对外出口具有重要意义。
国内外针对链霉素和双氢链霉素残留的检测技术已有大量的研究,常用的检测方法有酶联免疫法[3]、分光光度法[4]、液相色谱法[5]和液相色谱串联质谱法[6]等。文献报道的相关方法前处理比较复杂,有时需要经过两次固相萃取小柱的净化,耗时长,试剂消耗量大,净化效果也不理想。
笔者采用分散固相萃取初净化和串联双柱固相萃取净化相结合的前处理方法,建立了优化的番茄中链霉素和双氢链霉素残留量的液相色谱检测技术,该法的检出限为0.1 mg/kg,能够满足日本肯定列表对于番茄中链霉素和双氢链霉素的限量标准要求。
1 实验部分
1.1 主要仪器与试剂
液相色谱仪:Waters 2695型,美国沃特斯公司,配有荧光检测器,美国沃特斯公司;
涡旋仪:MS3型,德国IKA公司;
超声仪:SK8200LH型,上海科导超声仪器有限公司;
高纯水发生器:Milli-QⅡ型,美国密理博公司;
离心机:T–124型,瑞士KONTRON公司;
固相萃取装置:20孔,美国安捷伦公司;
氮吹仪:N–EVAP112型,美国Organomation公司;
链霉素和双氢链霉素标准品:德国Dr. Ehrenstorfer Gmb H公司;
甲醇、乙腈:色谱纯,美国Fisher公司;
反相固相萃取柱:200 mg/6 mL,美国菲罗门公司;
弱阳离子交换柱:200 mg/6 mL,美国菲罗门公司;
硅藻土:分析纯,上海化学试剂厂;
有机系滤膜:0.2 µm,美国安捷伦公司;
番茄及制品样品:市售;
所用其它试剂均为优级纯;
实验用水为二次净化水。
1.2 溶液的配制
1.2.1 标准溶液
准确称取适量链霉素和双氢链霉素标准品,分别用0.3%(体积分数)的甲酸水溶液配制成100 mg/L标准储备液,储存于–18℃冰箱,保存期18个月。根据实验需要,用0.3%甲酸水溶液稀释标准储备液,配成适当浓度的标准工作溶液。
1.2.2 样品提取液
磷酸盐缓冲溶液的配制:称取1.36 g的KH2PO4溶解到950 mL水中,用1 mol/L的HCl调节至pH 4,加入0.15 g的Na2EDTA·2H2O,充分溶解,最后用水定容至1 000 mL。
1.3 色谱条件
液相色谱柱:Symmetry Shield RP C18(美国沃特斯公司);流动相:0.01 mol/L庚烷磺酸钠–乙腈(体积比为78∶22);流速:0.7 mL/min;柱温:35℃;激发波长:263 nm;发射波长:447 nm。
柱后衍生条件:0.6 mmol/L 1,2-萘醌-4-磺酸钠溶液,0.2 mol/L氢氧化钠溶液,流速为0.4 mL/min,衍生柱温为50℃。
1.4 样品前处理
1.4.1 样品的提取
称取5.0 g样品,加入样品提取液,并定容到20 mL。涡旋仪上涡旋1 min,超声30 min,以8 000 r/min离心10 min,离心后的上清液待后续净化。
1.4.2 初净化
取7.0 mL上述离心后的上清液于15 mL离心管中,同时往离心管中加入0.8 g的硅藻土,充分涡旋1 min,超声10 min,以4 000 r/min离心10 min,离心后的上清液待再净化。
1.4.3 串联双柱再净化
依次用5.0 mL甲醇、5.0 mL水分别活化反相固相萃取柱和弱阳离子交换固相萃取柱,待上述活化溶液全部流出后,用固相萃取柱转接头串接好反相固相萃取柱(在上部:柱1)和弱阳离子交换固相萃取柱(在下部:柱2),取1.4.2中待净化的上清液4.0 mL加入柱1中,控制流速约为1.0 mL/min通过两串接的固相萃取柱。待净化液全部流出后,再加入6.0 mL提取液于柱1中。等待柱1中淋洗液全部流出后,从上部去除柱1,在柱2中依次加入6.0 mL水和1.0 mL甲醇淋洗柱2,柱2中淋洗液全部流出后,抽干3.0 min,用6.0 mL的甲醇(含体积分数3%的甲酸)溶液洗脱柱2中的待测物,用10 mL试管接收洗脱液,洗脱液于50℃水浴下氮气吹干,用0.5 mL的乙腈–水溶液(含0.2%甲酸,70∶30)溶解残渣,充分涡旋1 min,超声2 min,过0.2 µm的有机系滤膜,滤液供高效液相色谱测定。
1.5 色谱图
在1.3色谱条件下,0.1 mg/L链霉素标准品溶液的色谱图见图1。

图1 0.1 mg/L链霉素标准溶液的色谱图
2 结果与讨论
2.1 色谱柱的选择
参考待测物的性质和文献[7],选择反相C18色谱柱分离待测物。由于链霉素和双氢链霉素的极性均较强,在反相色谱柱上几乎没有保留,需要离子对试剂才能使待测物在反相柱上有保留。本实验选择了庚烷磺酸钠作为离子对试剂。
2.2 提取液的选择
链霉素和双氢链霉素常用的提取液有磷酸溶液和磷酸盐的缓冲溶液。实验发现,用磷酸溶液提取和净化后,测定待测物的峰型和灵敏度均较差;而用磷酸盐的缓冲溶液提取和净化后效果较好。在磷酸盐的缓冲溶液中加入少量的乙二胺四乙酸钠能维持溶液的稳定性,同时能与一些阳离子形成稳定的水溶性络合物,这或许能减少对弱阳离子交换柱净化的干扰。
2.3 净化条件的选择
因番茄成分复杂,单一固相萃取柱对番茄中干扰杂质净化效果不佳,因此需要多重净化的方法去除番茄中干扰杂质。本实验采用分散固相萃取初步净化和两个串联固相萃取柱再净化的方法来去除番茄中影响链霉素测定的干扰杂质。
分散固相萃取初净化主要利用一些吸附剂(如佛罗里硅土、硅藻土和活性炭)来去除样品中的极性或非极性干扰物。实验了佛罗里硅土、硅藻土和活性炭等吸附剂,结果表明,硅藻土能较好地吸附番茄中一些色素和酸类等物质而又不会吸附待测物。
再净化的目的是去除一些极性、非极性物质和初净化未去除的色素和酸类物质。本实验利用固相萃取柱(SPE)再净化。SPE柱通常有两种使用方式,一种是利用SPE 柱保留住待测物;另一种是利用SPE 柱保留住一些干扰物质。文献中有利用反相柱和离子交换柱分两次净化[6],此操作需要离子对试剂,且洗脱试剂的用量大,操作繁琐费时。笔者利用反相柱(上部:柱1)和离子交换柱(下部:柱2)串接起来同时净化样品。考虑到待测物极性较强,在柱1中几乎无保留,以弱酸性缓冲溶液为提取试剂,待测物在溶液中以离子化方式存在,提取溶液通过柱1时,一些非极性杂质主要被保留在柱1中,而待测物则无保留地通过柱1进入柱2中。柱2是弱阳离子交换柱,主要保留离子化合物,待测物被保留在柱2中,而一些非离子化的物质在柱2中没有保留。为了避免反向柱中有残留的待测物,用提取液再淋洗双柱,淋洗不仅洗脱了柱1中残留的待测物于柱2中,同时也洗脱掉了柱2中残留的杂质。用水和甲醇淋洗柱2,除去易溶于水相和有机相的杂质。最后用酸化的有机相洗脱液洗脱柱2中的待测物供后续处理。双SPE柱串联起来同时净化比用单一SPE柱[5]和分别用两个SPE柱净化[6]可节省大量溶剂,且具有操作简单快速、净化效果好、回收率高等优点。
2.4 检出限和定量限
采用阴性番茄样品作为空白基质,配制不同浓度的基质标准溶液,链霉素的浓度分别为0.05,0.2,0.4,0.6,0.8 mg/L。链霉素的线性回归方程为Y=1.49×104X+2.85×105,相关系数为0.999 8,线性范围为0.05~0.8 mg/L,检出限为0.05 mg/kg (S/N>3),定量检测限为0.1 mg/kg(S/N>10)。
2.5 回收率和精密度试验
利用空白番茄样品进行3个添加水平的回收试验,每个水平重复5次。链霉素的添加量均为0.1,0.4,0.8 mg/kg 3个水平,回收率和精密度的试验结果见表1。
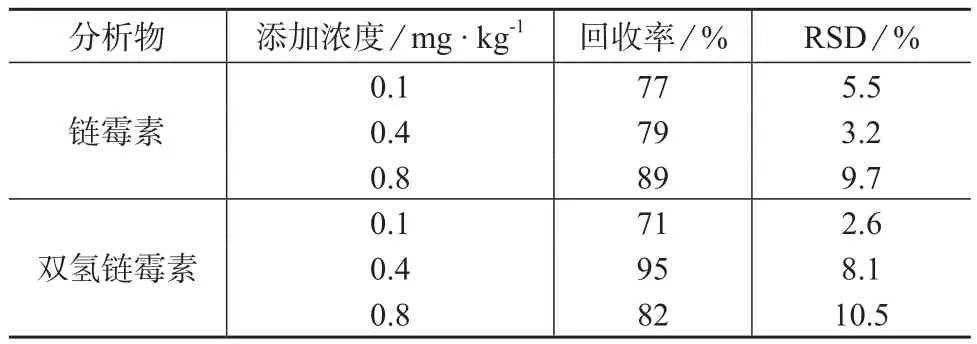
表1 番茄酱中的回收率及精密度试验结果(n=5)
2.6 样品测定
将本方法用于实验室中24个番茄样品的分析,对样品中的链霉素和双氢链霉素的残留量进行测定,根据化合物的色谱保留时间来鉴别样品。所测定的样品中均未定量检出链霉素和双氢链霉素的残留(低于0.1 mg/kg)。
3 结论
采用磷酸盐缓冲溶液提取番茄制品中链霉素和双氢链霉素,分散固相萃取和双柱串联同时净化(双柱串联同时净化的方法为首次采用),净化效果好。本方法不仅可用于番茄和番茄制品中链霉素或双氢链霉素残留量的液相色谱测定,也可适用于蔬菜和水果中链霉素或双氢链霉素残留量的测定。
[1] 胡昌勤.链霉素的免疫学[J].国外医药: 抗生素分册,1989,10(1): 39–42.
[2] 食品安全网.农残限量标准[EB/OL].[2011–03–28]. http:// www.tbt-sps.gov.cn/foodsafe/xlbz/Pages/pesticide.aspx.
[3] 范国英,王建华,王自良,等.链霉素残留快速检测阻断ELISA试剂盒的研制及其性能测定[J].中国兽医杂志,2008,44(1): 82–84.
[4] 李英娇,罗小玲,罗瑞峰,等.荧光分光光度法测定番茄中链霉素残留[J].食品工业,2008(5): 69–71.
[5] 陈晓红,刘小莉,董明盛,等.高效液相色谱法测定蜂产品中链霉素残留量[J].分析实验室,2004,23(10): 30–32.
[6] 刘晓茂,赵淑军,张进杰,等.蜂蜜中链霉素与双氢链霉素残留量的液相色谱串联质谱法测定[J].分析测试学报,2008,27(12): 1 351–1 354.
[7] 孙雷,张骊,黄耀凌,等.牛奶中链霉素与双氢链霉素残留检测的液相色谱–串联质谱法研究[J].分析测试学报,2008,27(11): 180–186.
Determination of Streptomycin and Dihydrostreptomycin Residues in Tomato Products by HPLC
Gong Zhiguo, Su Min , Yun Lijuan, Li Shiyu, Ji Xincheng
(Technique Center of Xinjiang Entry-Exit Inspection and Quarantine Bureau, Ürümqi 830063, China)
The method was speci fi cally developed for optimizing the puri fi cation method of determination of streptomycin and dihydrostreptomycin residues in tomato products. The residues were extracted from the samples with phosphate buffer solution (pH 4). The clean-up was performed by the way of dispersive solid-phase extraction and tandem dual solidphase extraction column. The RP C18column(Symmetry Shield) was used to complete the separation of the analytes under gradient elution. The external standard calibration curves were used for the quantitative determination. The linear range was from 0.05 to 0.8 mg/L with a good linear relationship (r>0.999 8). The limits of quanti fi cation (LOQ) were 0.1 mg/kg for streptomycin and dihydrostreptomycin. The recovery ranges were from 71% to 95% with the relative standard deviations (RSD) between 2.6% and 10.5%. It was indicated that this method is easer, more sensitive and has a better puri fi cation effect. The method was accurate and speci fi c to monitor and analyze streptomycin and dihydrostreptomycin residues in tomatoes and its products.
tomato; streptomycin; dihydrostreptomycin; tandem dual solid-phase extraction column clean up; liquid chromatography
O657.7
A
1008–6145(2012)03–0035–04
10.3969/j.issn.1008–6145.2012.03.010
* 新疆出入境检验检疫局科研项目(2010xk0048)
联系人:季新成; E-mail: xjciqgong@163.com
2012–03–30
