TBX2和PAX9在甲状腺乳头状癌中的表达及临床意义探讨
2012-06-30张卫东李弘江虹
张卫东 李弘 江虹
甲状腺癌是头颈部的常见恶性肿瘤之一,其中甲状腺乳头状癌(PTC)约占甲状腺癌的60%~70%[1]。目前甲状腺癌的发生机制尚不清楚,其发生、发展可能与众多癌基因、抑癌基因有关。TBX2基因是T-BOX基因家族的成员之一, 参与多种生物的发育调控,属于发育调控相关转录因子基因。PAX9基因是PAX基因家族的新成员,是胚胎发育中不可或缺的调控基因。近年来研究发现,TBX2和PAX9在多种肿瘤的发生、发展中起重要作用[2-7],但目前国内外有关TBX2和PAX9在甲状腺癌中的研究极少。本研究运用免疫组化和RT-PCR的方法检测TBX2和PAX9在甲状腺乳头状癌中的表达,并分析其与肿瘤临床病理学意义,进而探讨TBX2和PAX9在甲状腺乳头状癌发生、发展中的作用。
1 资料与方法
1.1 标本来源 选取2009年8月~2011年8月在某医院乳腺外科手术切除的60例新鲜甲状腺乳头状癌病例手术标本及癌旁正常甲状腺组织标本20例。所有患者术前均未接受放、化疗及其他免疫治疗。将所取得的标本分为两部分,一部分置于中性福尔马林内固定以备行免疫组化检查,另一部分迅速置液氮内冷冻,-80℃低温贮存,以备行RT-PCR。 60例患者(男14例,女46例),平均年龄(58.17±6.29)岁。经术后病理检查确诊,TNM分期(2002年国际抗癌联盟最新标准):Ⅰ期8例,Ⅱ期28例,Ⅲ期20例,Ⅳ期4例;淋巴结转移阳性37例,阴性23例。
1.2 试验方法
1.2.1 主要试剂 一抗兔抗人TBX2多克隆抗体、兔抗人PAX9多克隆抗体购于Santa Cruz公司,免疫组化染色超敏试剂盒(S-P法)和DAB显色试剂盒均购自北京中山生物公司,Trizol试剂购自GIBOC公司。
1.2.2 免疫组织化学染色 采用免疫组化SP法。所有标本均经福尔马林固定,常规脱水,石蜡包埋的组织制成5μm的连续切片,染色过程按试剂盒说明书进行,抗体稀释至1:100,取已知阳性组织作阳性对照,PBS代一抗作阴性对照。二氨基联苯胺染色,苏木精复染,中性树胶封片。每张切片至少观察5个视野,每个高倍视野至少观察100个细胞。结果判定:由两位高年资病理科医生双盲阅片,避开肿瘤坏死区域和边缘区域。采用半定量分析法,阳性结果的判断标准:TBX2与PAX9以胞质出现棕黄色颗粒为阳性。按阳性细胞百分比积分:(1)1分:0~25%;(2)2分:26%~50%;(3)3分:51%~75%;(4)4分:76%~100%。按染色强度的深浅积分:(1)0分:无染色;(2)1分:弱阳性(浅棕色);(3)2分:强阳性(深棕色)。最后按阳性细胞百分比积分X染色强度的深浅积分计算最终积分:(1)积分1~2分为阴性;(2)3~8分为阳性。
1.2.3 半定量逆转录-聚合酶链反应(RT-PCR)采取Trizol试剂提取甲状腺乳头状癌组织及正常甲状腺组织,经紫外分光光度计检测OD260、OD280,纯RNA样本OD260/OD280比值为1.8~2.0,低于此值表示存在蛋白质污染,1%琼脂糖凝胶电泳示5S、18S和28S清晰RNA荧光条带,说明RNA完整无降解。引物设计:TBX2:上游序列:5′CACTCGCTTGACCGAACCC 3′,下游序列:5′CGCACTGTCTGTCTGCACCA 3′,预扩增片断为211Bp;PAX9:上游序列:5′TGCTGGACATGGGTGGCA 3′,下游序列:5′AGGCAGAAGGGTTGGAGGG 3′,预扩增片断为246Bp;GAPDH:上游序列:5′GGGTGATGCTGGTGCTGAGTATGT 3′,下游序列:5′AAGAATGGGAGTTGCTGTTGAAGTC 3′,预扩增片断为616Bp。经过94℃变性1min,56℃退火40s,72℃延伸30s,30个循环后,72℃再延伸10min。电泳成像系统扫描分析,计算GRP78mRNA的相对表达水平。
1.3 统计学方法 所有数据采用SPSS 17.0统计学软件进行处理,计量数据以均数±标准差(±s)表示,数据比较采用χ2检验和t检验,相关性分析采用Spearman等级相关分析,P<0.05差异有统计学意义。
2 结果
2.1 免疫组化染色结果 免疫组化染色结果显示(如图1),60例甲状腺乳头状癌组织中46例TBX2蛋白表达阳性,14例表达阴性,阳性率76.67%;20例正常甲状腺组织中,4例TBX2蛋白表达阳性,16例表达阴性,阳性率为20.00%;TBX2蛋白在甲状腺乳头状癌组织中阳性表达明显高于正常甲状腺组织,两者存在差异有统计学意义(P<0.01),见表1。
免疫组化染色结果显示(如图2),60例甲状腺乳头状癌组织中48例PAX9蛋白表达阳性,12例表达阴性,阳性率80.00%;20例正常甲状腺组织中,5例PAX9蛋白表达阳性,15例表达阴性,阳性率为25.00%;PAX9蛋白在甲状腺乳头状癌组织中阳性表达明显高于正常甲状腺组织,差异有统计学意义(P<0.01),见表1。
2.2 逆转录聚合酶链反应(RT-PCR)结果 根据RTPCR结果显示(如图3~4),甲状腺乳头状癌组织中TBX2 mRNA及PAX9 mRNA的相对表达水平明显高于正常甲状腺组织组织,甲状腺乳头状癌组织中TBX2 mRNA为(1.17±0.24),正常甲状腺组织组织为(0.12±0.03),差异有统计学意义(P<0.01),见表1。甲状腺乳头状癌组织中PAX9 mRNA为(1.09±0.19),正常甲状腺组织组织为(0.17±0.05),差异有统计学意义(P<0.01),见表2。

图1 TBX2在甲状腺乳头状癌组织中的阳性表达(SP×200)
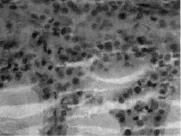
图2 PAX9在甲状腺乳头状癌组织中的阳性表达(SP×200)
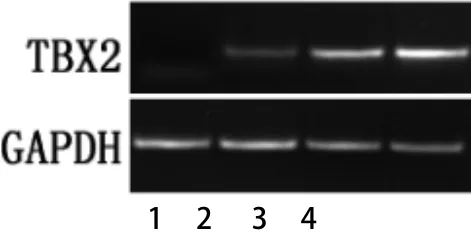
图3 TBX2 mRNA的表达
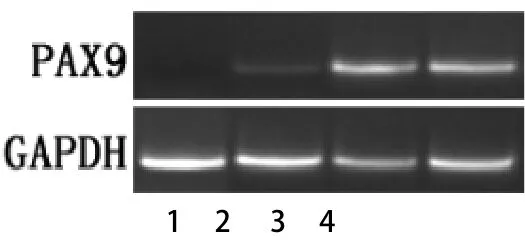
图4 PAX9 mRNA的表达
2.3 TBX2和PAX9的表达与甲状腺乳头状癌患者临床病理特征的关系 甲状腺乳头状癌组织TBX2和PAX9的蛋白及mRNA表达均与TNM分期、分化程度及淋巴结转移密切相关(P<0.05),而与患者年龄、性别无关(P≥0.05),见表1~2。
2.4 TBX2蛋白和PAX9蛋白在甲状腺乳头状癌组织中表达的相关性 经Spearman等级相关分析显示,TBX2蛋白和PAX9蛋白表达呈正相关(r=0.471,P<0.05)。
3 讨论
TBX2基因是发育调控相关转录因子基因,属于转录因子T-box家族成员之一,其通过特有的T-box区域参与多种生物的发育调控,是T-box基因家族成员中仅有的两个转录抑制基因之一。TBX2在各种组织和器官的胚胎发育中起着重要的调控作用。近年来研究发现,TBX2在多种肿瘤中高表达,并且与细胞的凋亡、恶性转化及细胞增殖有着密切关系[2,6]。本研究发现,TBX2在甲状腺乳头状癌组织中表达明显高于正常甲状腺组织,并且随着甲状腺乳头状癌临床分期的增加、分化程度的降低、淋巴结转移,TBX2的表达明显增加,说明TBX2在促进甲状腺乳头状癌进一步演变恶化中起着重要的作用。

表1 TBX2蛋白和PAX9蛋白表达与甲状腺乳头状癌患者临床病理特征的关系
表2 TBX2 mRNA和PAX9 mRNA表达与甲状腺乳头状癌患者临床病理特征的关系(±s)
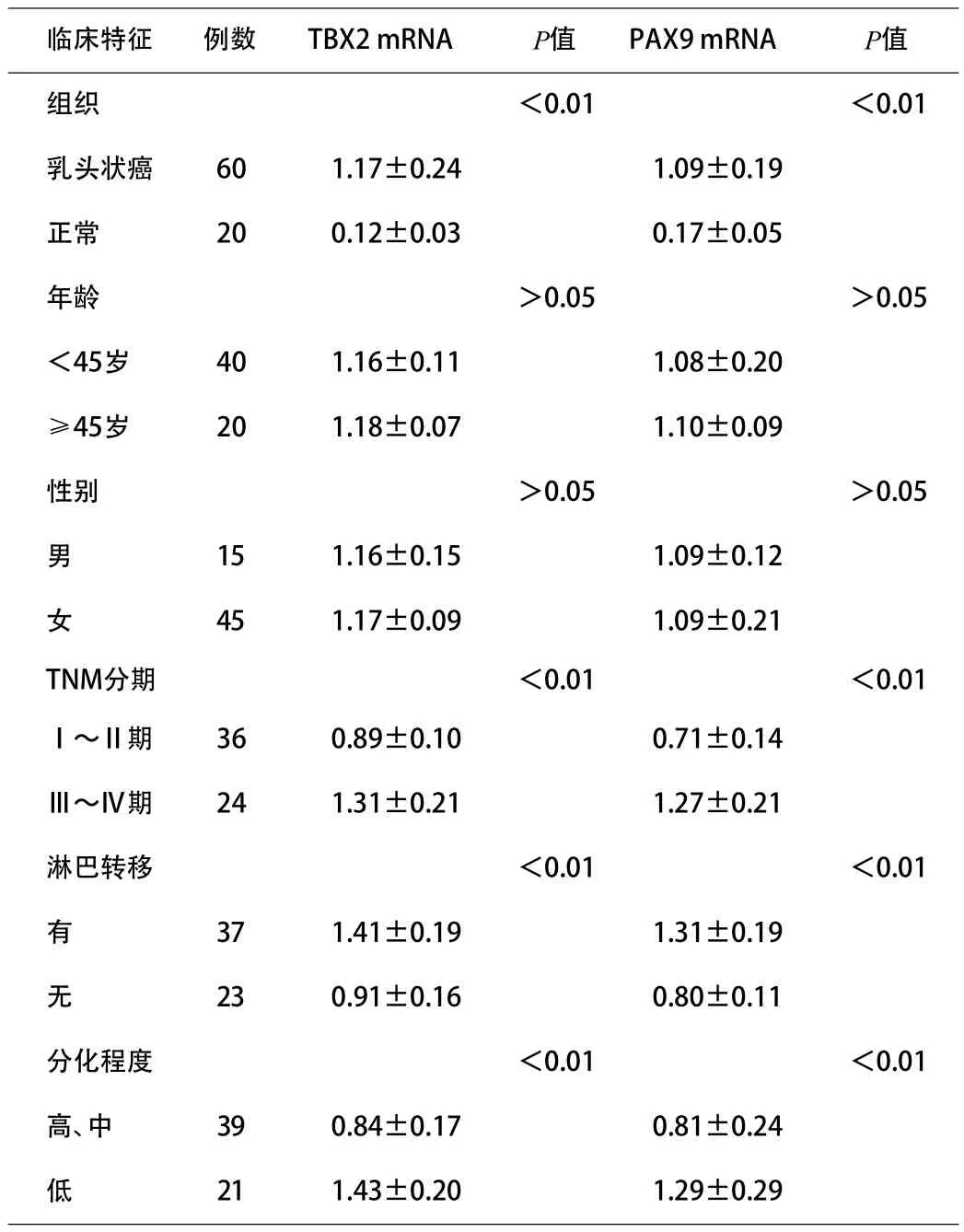
表2 TBX2 mRNA和PAX9 mRNA表达与甲状腺乳头状癌患者临床病理特征的关系(±s)
临床特征 例数 TBX2 mRNA P值 PAX9 mRNA P值组织 <0.01 <0.01乳头状癌 60 1.17±0.24 1.09±0.19正常 20 0.12±0.03 0.17±0.05年龄 >0.05 >0.05<45岁 40 1.16±0.11 1.08±0.20≥45岁 20 1.18±0.07 1.10±0.09性别 >0.05 >0.05男15 1.16±0.15 1.09±0.12女45 1.17±0.09 1.09±0.21 TNM分期 <0.01 <0.01Ⅰ~Ⅱ期 36 0.89±0.10 0.71±0.14Ⅲ~Ⅳ期 24 1.31±0.21 1.27±0.21淋巴转移 <0.01 <0.01有37 1.41±0.19 1.31±0.19无23 0.91±0.16 0.80±0.11分化程度 <0.01 <0.01高、中 39 0.84±0.17 0.81±0.24低21 1.43±0.20 1.29±0.29
PAX9基因是PAX家族新发现成员,广泛参与了脑、胸腺、甲状旁腺等器官的胚胎发育,是胚胎发育中不可缺少的调控基因。目前有关PAX9基因的研究主要集中在其与牙齿发生、分化的关系方面[8],仅有少量有关PAX9基因在肺癌、食管癌及口腔鳞状细胞癌等方面的研究[3-5],尚未有PAX9在甲状腺癌方面的报道。本研究证实PAX9在甲状腺乳头状癌组织中表达明显高于正常甲状腺组织,并且其表达与临床分期、分化程度及淋巴结转移有着密切的关系。
已有研究表明TBX2可以使p53表达水平下降从而降低caspase-3的生物学活性,促进细胞凋亡的发生[9]。PAX9能够在转录水平上降低caspase-3的表达,促进肿瘤的发生及进展[5,10]。研究中笔者还发现,TBX2蛋白和PAX9蛋白表达呈正相关,说明TBX2和PAX9在甲状腺乳头状癌的发生及进展中可能起着协同作用,可能共同通过对caspase-3的表达的影响共同促进肿瘤的生物学行为。
综上所述,TBX2和PAX9在甲状腺乳头状癌中的表达明显增强,并且与甲状腺乳头状癌的侵袭、转移相关,TBX2和PAX9有望成为甲状腺乳头状癌新的生物学标记和肿瘤基因治疗的新的靶点,为甲状腺癌的诊疗提供新的方向。
[1]Singh N,Rogers P,Atwood CW,et al.Short-course empiric antib iotic therapy for patients with pulmonary infiltrates in the intensiv e cane unit[J].Am J Respir Crit Care Med,2000,162(2):505-511.
[2]Teng H,Parker M I,Prince S.Functional characterization of cisactingelements involved in basal transcription of the human TBX2 gene:a new insightinto the role of Sp1 in transcriptional regul ation[J].Gene,2008,423(1):8-13.
[3]Harris T,Pan Q,Sironi J,et al.Both gene amplification and allelic loss occur at 14q13.3 in lung cancer[J].Clin Cancer Res,2011,17(4):690-699.
[4]Kendall J,Liu Q,Bakleh A,et al.Oncogenic cooperation and coamplification of developmental transcription factor genes in lungCancer[J].Proc Natl Acad Sci USA,2007,104(42):16663-16668.
[5]Lee J C,Sharma M,Lee Y H,et al.PAX9 mediated cell survival in oral squamous carcinoma cell enhanced by c-myb[J].Cell Bioch em Funct,2008,26(8):892-899.
[6]Liu W K,Jiang X Y,Zhang Z X.Expression of PSCA,PIWIL1,and TBX2 inendometrial adenocarcinoma[J].Onkologie,2010,33(5):241-245.
[7]苗雷英,李祥伟,刘超,等.涎腺肿瘤中PAX9基因的表达及意义[J].口腔医学研究,2006,22(1):8-11.
[8]赵计林,陈扬熙,鲍朗,等.中国先天性缺牙患者PAX9基因的新突变[J].中华口腔医学杂志,2005,40(4):266-269.
[9]Dobrzycka K M,Kang K,Jiang S,et al.Disruption of scaffold attachment factor B1 leads to TBX2 up-regulation,lack of p19ARF induction,lack of senescence,and cell immortalization[J].Cancer Res,2006,66(16):7859-7863.
[10]Seoane J,Le H V,MassaguéJ.Myc suppression of the p21(Cip1)Cdk inhibitor influences the outcome of the p53 response to DNA damage[J].Nature,2002,419(6908):729-734.
