溶胶-凝胶法制备正极材料磷酸铁锂的研究进展
2012-06-29刘丽英张海燕翟玉春
刘丽英,张海燕,陈 炼,翟玉春
(1.广东工业大学材料与能源学院,广东 广州 518006;2.东北大学材料与冶金学院,辽宁 沈阳 110004)
现代社会中锂离子电池的用量迅猛增加,特别是电动汽车对锂离子电池提出了更高的要求。正极材料一直是制约锂离子电池发展的瓶颈,研制出环境友好、原料资源丰富、综合电化学性能优异的正极材料至关重要。最早商业化使用的LiCoO2价格较高,有一定的毒性,且Co资源有限[1];LiNiO2具有与LiCoO2相似的层状晶体结构,但制备难,电化学性能与预期差距较大[2];LiMn2O4高温性能不好,且容量衰减较大[3]。Padhi等[4]于1997年发现LiFePO4能够可逆地嵌入/脱出Li+,原料丰富、价廉、环境友好、安全性和循环稳定性好。经十年左右的努力,LiFePO4材料迅速进入实用化阶段。由于受自身结构的限制,LiFePO4存在电子电导率和离子扩散速率低的缺陷,致使其快速充放电及倍率性能难以满足新一代锂离子动力电池的要求。解决途径主要集中在改变合成方法和掺杂改性[5]两方面。目前报道的合成方法包括固相法[6]、水热法[7]、微波法[8]、共沉淀法[9]、超声波喷雾干燥法[10]和溶胶-凝胶法[11]等。固相反应法难以保证物料混合均匀,产物粒度偏大,能耗高,但工艺简单。溶胶-凝胶法能够克服固相反应法的缺点,在一定程度上改善了产物的电化学性能而受到广泛关注。
本文综述了LiFePO4的晶体结构及电化学特征,着重介绍采用溶胶-凝胶法合成LiFePO4的研究进展,评价已经取得的研究成果,并指出今后的研究方向。
1 LiFePO4的结构特点及充放电过程的电化学特征
LiFePO4在自然界中以磷铁锂矿的形式存在,具有有序的橄榄石结构,属于斜方晶系。在LiFePO4中,氧原子近似于六方紧密堆积,P处于氧四面体的4c位,形成PO4四面体。铁原子、锂原子分别在氧八面体的4c位和4a位。在b-c平面上,相邻的FeO6八面体共用一个氧原子,从而互相链接形成Z字形的FeO6层。在FeO6层之间,相邻的LiO6八面体通过b方向上的两个氧原子链接,形成了与c轴平行的Li+连续直线链,从而Li具有二维可移动性,使之在充放电过程中可以脱出和嵌入[12]。强的P-O共价键形成离域的三维立体化学键,削弱了Fe-O键的强度,降低了Fe+/Fe电对的能级,使LiFePO4具有很强的热力学和动力学稳定性。
在充放电过程中,参与电化学反应的是LiFePO4和FePO4两相,这两相的结构具有极大的相似性,从LiFePO4变化为FePO4时密度增加2.59%,体积只减少6.81%。因此LiFePO4具有优异的循环性能[13]。
其充放电反应机理如下[14]:
充电反应:
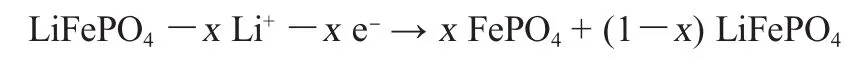
放电反应:

LiFePO4是一种典型的聚阴离子化合物,结构中存在许多可以容纳锂离子的空位,这些空位为容纳更多的锂离子奠定了基础,使得材料具有较高的容量和较大的比能量。LiFePO4正极材料的放电电压平台大约在3.5 V(vs.Li+/Li)左右,电化学曲线非常平坦。
2 以柠檬酸为络合剂和碳源
柠檬酸是一种重要的有机酸,常用作络合剂。柠檬酸阴离子非常适合与锂、过渡金属阳离子制备前驱体,热解时产生的气体有助于细小、多孔产物的形成,具有较大的比表面积,且热解残留的碳能够改善材料的电子导电性。
Kuei-Feng Hsu[15]等人将LiNO3、铁粉加入到柠檬酸溶液,与10 mL饱和NH4H2PO4溶液混合,缓慢加热、搅拌4 h,干燥后于惰性气氛中850℃加热2 h。研究发现,当柠檬酸与金属离子总数比为1∶0.75时,所得材料的容量最高,在3.0~4.0 V电压区间,0.025 C时首次比容量为151 mAh/g,循环10次后保持在143 mAh/g。
R.Dominko[16]等人将柠檬酸铁与柠檬酸用去离子水溶解,然后与等摩尔LiH2PO4溶液混合,60℃干燥24 h,研磨后置于氩气中700℃热处理10 h。产物具有多孔结构,表面粗糙,电子电导率达到5×10-4S/cm。小倍率测试条件下LiFePO4/C的可逆比容量为160 mAh/g,接近于理论容量。随着放电倍率提高,比容量逐渐下降,5C时放电比容量仍然有120 mAh/g。
采用柠檬酸为络合剂,通过溶胶-凝胶合成LiFePO4研究较多,柠檬酸兼具络合剂和导电添加剂的作用,工艺相对简单。
3 以柠檬酸与其它有机物为络合剂和碳源
Jae-Kuang Kim[17]等人将化学剂量比的Li2CO3、FeC2O4、NH4H2PO4溶于去离子水,加入柠檬酸溶液和蔗糖,充分搅拌形成凝胶,干燥后700℃加热10 h。产物的晶体尺寸比未添加蔗糖时小,碳包覆层厚2.4~4 nm。结果表明,加入蔗糖提高了LiFePO4/C的氧化还原效率,多孔结构改善了Li+的扩散能力和电解液的动力学性能。作者认为加入蔗糖使第一步热解过程中磷酸盐的结晶得到了抑制,从而有利于橄榄石结构形成。
Xu Zhihui等人[18]将 H3PO4、Fe(NO3)3、CH3COOLi和柠檬酸溶于去离子水,添加适量聚乙二醇,用氨水调解pH值至8.5~9.5之间,热处理干凝胶后获得LiFePO4/C产物。当(摩尔比)聚乙二醇∶柠檬酸=1∶1时材料的电化学性能最好,以15 mA/g的电流进行充放电时首次充放电比容量为167/162 mAh/g。聚乙二醇分子中的亲水氧原子通过氢键很容易和胶体颗粒表面的自由羟基相连,从而阻止胶体颗粒团聚,在随后的热处理过程中转化为包覆碳阻止颗粒长大,形成球状产物,从而提高材料的电化学性能。Zhang Yong等人[19]同时添加柠檬酸和聚乙二醇作为络合剂和碳源,也得到了相近的结果。
采用柠檬酸和聚丙烯酸等为原料通过溶胶-凝胶法制备的LiFePO4首次比容量也达到160 mAh/g,且循环性能稳定。
4 以其他有机物作为络合剂和碳源
Li Xueliang[20]等人将FeCl2和LiCl·H2O溶于乙醇,搅拌条件下缓慢加入H3PO4,然后将溶于乙醇的聚乙二醇和D-果糖加入到上述混合溶液,加热直到形成溶胶。干燥后,N2中350℃预处理4 h,研磨后700℃热处理8 h。同样方法还制备了以聚乙二醇和1-十六醇、聚乙二醇和肉桂酸为络合剂及碳源的LiFePO4材料。添加果糖和聚乙二醇制备的材料0.2C比容量157.7 mAh/g,50次循环保持在153.6 mAh/g。复合添加剂制备的材料具有多孔微观结构,粒径较小。
Y.Sundarayya 用乙二醇、Yan Cui[21]用草酸、D.Arumugam[22]添加琥珀酸、Daiwon Choi加入月桂酸和乙二醇、M.A.E.Sanchez加入丁醇都采用溶胶-凝胶法成功地制备出了LiFe-PO4材料。
对比研究发现,添加短链有机物作为络合剂和碳源时材料的性能总体上较好。因为短链有机分子的分解温度低于长链有机分子,随着有机物分解温度的升高,添加剂形成碳网络结构的能力就会降低。
5 不单独添加络合剂和碳源
Miran Gaberscek等人将适量Li3PO4和H3PO4溶于水,与柠檬酸铁溶液混合,60℃干燥24 h,经过热处理制得LiFePO4正极材料。粒径约20 μm,多孔结构,孔径分布从微米到纳米级,表面积大。孔隙率可以通过调整合成工艺条件控制。
Sabira Beninati[23]等人将柠檬酸铁、H3PO4、Li3PO4按摩尔比1∶1∶1溶解,混合液溶经微波加热几分钟形成凝胶。Ar(含5%H2)气氛中700℃加热1 h制得LiFePO4材料。小电流测试时比容量为150 mAh/g,20C时为80 mAh/g。对于磷酸铁锂来说如此高的倍率仍有80 mAh/g的比容量已经很高了。
6 结论
LiFePO4是以磷酸根聚阴离子为基础的第三代锂离子电池正极材料,因其在动力电池中巨大的应用潜能而备受关注。虽然经过10几年的努力,LiFePO4已经实现工业化生产,但产品性能低于实验室研发成果,尤其是倍率性能、快速充放电性能制约动力电池性能的进一步提高。溶胶-凝胶法产物综合电化学性能优于固相法产物,主要缺点是合成时间长,工序繁多,干燥收缩大及粉体材料烧结性不好。探索适合工业化生产的新方法以及对现有方法进行优化仍然是未来研究的重点和方向。寻找一种易操作、流程短、经济环保的溶胶-凝胶法并向生产转化,值得深入研究。
[1]王洪,祝纶宇,陈呜才.锂离子电池正极材料LiCoO2的包覆改性[J].应用化学,2007,24(5):556-560.
[2]常照荣,齐霞,吴锋,等.熔融盐法合成锂离子电池正极材料LiNiO2的研究[J].功能材料,2006,37(6):896-897.
[3]PARK S B,LEE S M,SHIN H C,et a1.An alternative method to improve the electrochemical performance of a lithium secondary battery with LiMn2O4[J].Journal of Power Sources,2007,166(1):219-225.
[4]PADHI A K,NANHUNDASWAMY K S,GOODENOUGH J B.Phospho-olivines as positive-electrode materials for rechargeable lithium batteries[J].Electrochem Soc,1997,144(1):1188-1194.
[5]WANG D Y,LI H,SHI S Q,et a1.Improving the rate performance of LiFcPO4by Fe-site doping[J].Elctrochcm Acta,2005,50:2955-2958.
[6]TAKAHASHI M,TOHISHIIMA S,TAKEI K.Characterization of LiFePO4as the cathode material for rechargeable lithium batteries[J].Power Sources,2001,97-98:508-511.
[7]庄大高,赵新兵,曹高劭.水热法合成LiFePO4的形貌和反应机理[J].中国有色金属学报,2005,15(12):2034-2039.
[8]李发喜,仇卫华,胡环宇,等.微波合成锂离子电池正极复合材料LiFePO4/C电化学性能[J].北京科技大学学报,2005,27(1):86-89.
[9]PARK K S,SON J T,CHUNG H T,et al.Synthesis of LiFePO4by co-precipitation and microwave heating[J].Electrochemistry Communications,2003,5(10):839-842.
[10]YANG M R,TENG T H,WU S H.LiFePO4/carbon cathode materials prepared by ultrasonic spray pyrolysis[J].Journal of Power Sources,2006,159(1):307-311.
[11]HSU K F,TSAY S Y,HWANG B J.Synthesis and characterization of nano-sized LiFePO4cathode materials prepared by a citric acid-based sol-gel route[J].Journal of Materials Chemistry,2004,14(17):2690-2695.
[12]YAMADA A,HOSOYA M.Olivine-type cathodes:achievements and problems[J].J Power Sources,2003,l19-121:232-238.
[13]ANDERSSON A S.Lithium extraction/insertion in LiFePO4:an X-ray diffraction and Mossbauer spectroscopy study[J].Solid State Ionices,2000,130(1/20):41-52.
[14]ZHU X J,LIU Y X,GENG L M,et al.Synthsis and characteristics of Li3V2(PO4)3as cathode materials for lithium-ion batteries[J].Solid State Ionics,2008,179:1679-1682.
[15]HSU K F,HU S K,CHEN C H,et al.Formation of LiFePO4/C composite powders investigated by X-ray absorption spectroscopy[J].Journal of Power Sources,2009,192(5):660-667.
[16]DOMINKO R,BELE M,GABERSCEK M,et al.Porous olivine composites synthesized by sol-gel technique[J].Journal of Power Sources,2006,153:274-280.
[17]KIM J K,CHOI J W,GHANSHYAM S,et al.Enhancement of electrochemical performance of lithium iron phosphate by controlled sol-gel synthesis[J].Electrochimica Acta,2008(53):8258-8264.
[18]XU Z H,XU L,LAI Q Y,et al.A PEG assisted sol-gel synthesis of LiFePO4as cathodic material for lithium ion cells[J].Materials Research Bulletin,2007(42):883-891.
[19]ZHANG Y,FENG HUI,WU X B,et al.One-step microwave synthesis and characterization of carbon-modified nanocrystalline LiFePO4[J].Electrochimica Acta,2009,54:3206-3210.
[20]LI X L,WANG W D,SHI C W,et al.Structural and electrochemical characterization of LiFePO4/C prepared by a sol-gel route with long-and short-chain carbon sources[J].Solid State Electrochem,2009,13:921-926.
[21]CUI Y,ZHAO X L,GUO R S.Improved electrochemical performance of La0.7Sr0.3MnO3and carbon-coated LiFePO4synthesized by freeze-drying process[J].Electrochimica Acta,2009,55(3):922-926.
[22]ARUMUGAM D,KALAIGNAN G P,MANISANKAR P.Synthesis and electrochemical characterizations of nano-crystalline LiFe-PO4and Mg-doped LiFePO4cathode materials for rechargeable lithium-ion batteries[J].Solid State Electrochem,2009,13:301-307.
[23]BENINATI S,DAMEN L,MASTRAGOSTION M.Fast sol-gel synthesis of LiFePO4/C for high lithium-ion batteries for hybrid electric vehicle application[J].Journal of Power Sources,2009,194:1094-1098.
