他克莫司血药浓度监测中质控分析评价
2012-06-18郝堂娜聂维廷
郝堂娜,孙 玲,李 镇,张 宁,张 策,聂维廷
他克莫司(Tacrolimus,FK506)是日本藤泽研发的23元环状大环内酯类新型免疫抑制剂,通过拮抗相关多细胞因子的产生和表达来抑制T细胞活化[1-2],具有急性排斥反应发生率低、对类固醇激素相对无依赖性等优点。但其治疗窗窄,生物利用度个体差异大,同时存在很多不良反应[3-4],因此,对FK506进行治疗药物监测(TDM)非常必要[5-6]。本文采用酶联免疫吸附法(ELISA)进行血药浓度测定,并对2007年6月-2010年7月FK506血药浓度监测过程中的随行质控数据进行回顾性分析,确保他克莫司血药浓度测定结果的准确性。
1 仪器与试剂
1.1 试剂 PRO-TracⅡTMTacrolimus ELISA试剂盒(美国 Diasorin公司生产):①酶标板;②FK506单克隆抗体;③5×浓缩辣根过氧化酶储存液;④酶标稀释液;⑤标准品(浓度分别为:0.3、1.0、3.0、10、30 ng/mL);⑥低、高质控对照品1、2;⑦底物液;⑧终止液;⑨10×洗涤液;⑩消化液。
1.2 仪器 酶标仪(美国Universal Microplae Reader EL×800NB),Adoff管(江苏海门天星塑料制品厂),HH-W21-420S数显电热显温水温箱,SK-1快速混匀器(江苏医疗仪器厂),LG15-W 离心机(北京医用离心机厂),他克莫司定量测定试剂盒(酶联免疫法,美国Diasorin公司),低速自动平衡离心机 LDZ5-2(北京医用离心机厂),Stat Fax-2200孵育振荡仪(美国Awareness公司)。
2 方法
2.1 标准曲线的建立 建立5个点的标准曲线,标 准 品 浓 度 分 别 为 0.3、1.0、3.0、10.0、30.0 ng/mL,并随行两个浓度质控样品 2.0、15.0 ng/mL。取标准系列样品、质控对照样品各25μL放入1.5mL Adoff管,加入150μL 消化液,涡旋30 s,室温下静置15min,然后放入75℃水浴箱中静置15min。取出涡旋30 s,4500 r/min离心10min,分别取上清液100μL加入酶标板,除空白对照管外,每管加50μL FK506单抗,空白对照管加50μL酶标稀释液,用薄膜覆盖酶标板放入温育震荡器,(700±50)r/min置37℃震荡30min。取出加酶标液50μL(用酶标稀释液5倍稀释酶标浓缩液),震荡60min(条件同前)。取出洗板3次(用蒸馏水将洗涤缓冲液按1∶10稀释),然后每管加200μL底物液,震荡15min(条件同前)。再加入100μL终止液,在450/630 nm下测定吸光度,记录数据,绘制吸光度对浓度的标准曲线[7]。
2.2 FK506质控样品血药浓度测定 监测全血中FK506血药浓度,同时监测低、高两个质控样本浓度 C1、C2(ng/mL),测定方法同“2.1”项方法。
2.3 数据分析方法 采用SPSS 11.5统计学软件分别对2007年6月-2010年7月期间的质控数据进行统计学分析,并绘制质控曲线。
2.4 绘制质控图和设定控制限 在监测临床样品血药浓度同时随行质控测定,并记录结果。以2007年6月-2010年7月监测质控的单次测定结果为研究对象,对获得的FK506低、高浓度质控测定结果C1、C2(ng/mL)进行回顾性分析,计算出平均值(X)、标准差(SD)和相对标准偏差(RSD)。以X为靶值,SD的倍数为控制限,即质控品测定值在X±2SD之间为质控结果在控,以X±2SD为警告限、X±3SD为失控限。以靶值为中心线,以测定批次为横坐标,以浓度测定结果为纵坐标,标出各条控制限,绘制FK506血药浓度监测的Levey-Jennings质控图。
3 结果
3.1 标准曲线的绘制 以吸光度对浓度进行线性回归,得标准曲线 Y=1.9668/[1+(X/3.697)^1.381]+0.4602,r=0.9996,如图1 所示。FK506在0.3~30μg/mL的范围内,线性关系良好。
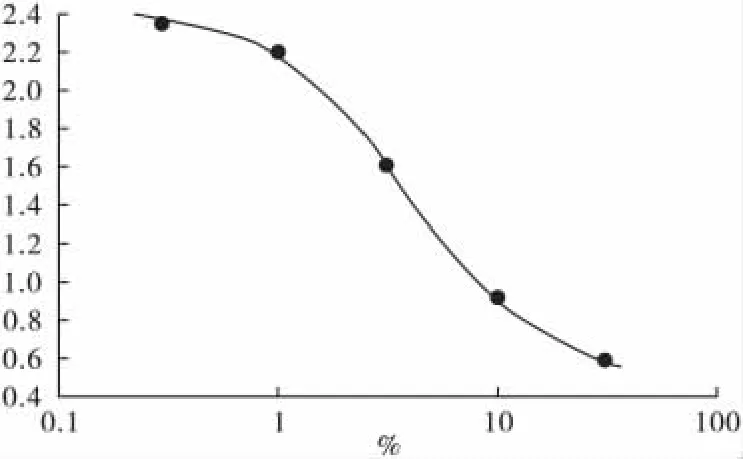
图1 酶联免疫吸附法测定FK506标准曲线
3.2 统计学分析结果 对2007年6月-2010年7月随行低、高质控的单次测定结果分别进行单向方差检验。结果表明,在不同时间段内对低质控的测定结果差异有统计学意义(P<0.05),而对高质控的测定差异无统计学意义(P>0.05),结果见表1。

表1 2007年6月-2010年7月高、低质控处理结果
3.3 levey-Jennings质控图分析结果 2007年6月-2010年 7月测得质控 269份,其中 C1(2.0 ng/mL)134份,C2(15 ng/mL)135份,质控周期内随行质控样本RSD分别为3.85%、4.89%、4.80%。绘制单浓度Levey-Jelmings质量控制图,测定结果均“在控”,结果见表2。低浓度质控误差允许范围(X±2SD)为1.15~3.29 ng/mL,测定值范围为1.72~2.63 ng/mL,而高浓度质控误差允许范围(X±2SD)为10.50~21.55 ng/mL,测定值范围为13.92~17.10 ng/mL,可见高、低质控均在质控警告限范围内,结果见图2、图3。
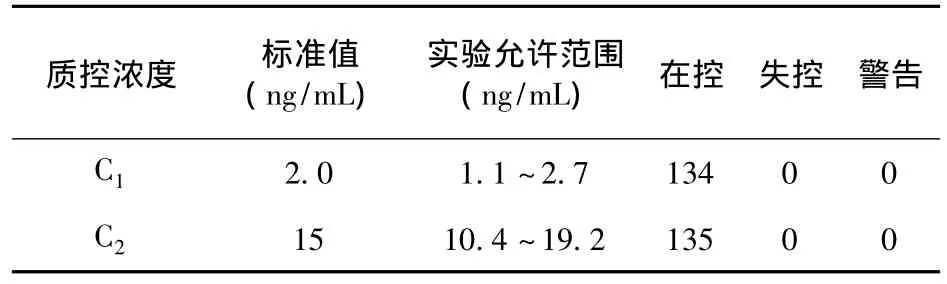
表2 Levey-Jelmings质控图与标准质控范围结果比较

图2 质控C1(ng/mL)浓度Levey-Jennings质控图

图3 质控C2(ng/mL)浓度Levey-Jennings质控图
4 讨论
4.1 FK506药物浓度监测方法的选择 FK506在全血中分布远远高于血浆,因此,测定FK506全血血药浓度检测灵敏度高,结果更可靠。目前,FK506全血血药浓度测定的常用方法有ELISA、微粒酶免疫分析法(MEIA)、高效液相色谱法(HPLC)法、高效液相色谱-质谱联用(HPLC/MS)法和酶增强免疫分析法(EMIT)[8]。本试验选择ELISA法,其灵敏度高,特异性好,设备简单,操作方便,结果易判断。试剂盒附带标准品和低、高两个质控品,测定时只需满足低、高质控样品“在控”,即可保证结果的准确性。尽管质控允许的误差范围比一般TDM质控允许误差范围大,但由于其测定过程中试验步骤多、周期长,测定人员不固定,测定结果易受温度等外界因素干扰,所以,仪器的维护和校准是保证结果准确的前提。此外,试剂盒、质控盒、标准曲线盒应置于冰箱保存,无变质、过期,从而保证为临床提供准确的测定结果,以制定合理的个体化给药方案。
4.2 FK506药物浓度监测随行质控分析 目前,常规FK506血药浓度监测质量控制采用定期或每次测定样本时随行测定质控样本,只要质控样本的测定结果落在说明书允许的误差范围内,则判断此测定结果可靠[9]。这种判断标准忽略了评价的连续性,不能及时发现影响测定准确性的潜在因素。此外,也有采用SPSS统计软件质控程序,其主要用于处理每日多点质控数据,对本实验数据的处理有一定局限性。本试验采用室内单值质控法,即Levey-Jennings质控法,通过回顾性计算均值及标准差,以X±2S为警告限,以X±3S为失控限,绘制指控图。每次仅需监测一次质控样品,用室内质控图对监测结果可靠性进行判断,即室内质控“失控”时未查明原因前监测结果不宜发出,室内质控“在控”时,方可发出监测结果[10]。在实际监测中及时绘制质控图,根据质控图对监测结果加以判断。若质控测定存在漂移、趋势性变化,则立即分析出现这种定向趋势的原因,排查误差并分析可能存在的影响因素并及时纠正,以确保提供准确可靠的血药浓度测定结果。本文回顾分析了近2年的质控监测结果,通过绘制质控图,发现低、高质控结果均在警告限范围内,且在中心线两侧规律波动,未出现定向改变的趋势,表明每次的TDM监测结果准确可靠,具有临床指导意义。
5 小结
本文对2007年6月-2010年7月FK506血药浓度监测过程中的随行质控数据进行了回顾性分析,对其进行单向方差分析,绘制Levey-Jennings质控图。结果表明,2007年6月-2010年7月随行的质控分析结果均“在控”,质控结果均在误差允许范围内,说明FK506血药浓度监测结果数据可靠,准确度高,具有较好的临床指导意义。
[1]李红梅,施向东.他克莫司治疗激素抵抗性肾病综合征[J].实用医学杂志,2009,25(22):3871-3873.
[2]张庆,刘世霆,许军.免疫抑制剂对合并或不合并移植术后的糖尿病肾移植患者自测健康的影响[J].中国药房,2010,21(10):941-944.
[3]王晨丹,李荣山.他克莫司与西罗莫司根据细胞周期序贯用药对阿霉素肾病大鼠的影响[J].中国医药,2011,6(5):561-564.
[4]刘宏,童俊容.他克莫司致严重贫血1例[J].实用医学杂志,2011,27(16):3018-3018.
[5]张弋,高仲阳,郑嫦云.他克莫司异常血药浓度成因初探[J].中国医院药学杂志,2005,25(8):746-747.
[6]逢晓云.他克莫司的药理作用及临床应用[J].中国药师,2006,9(5):462-463.
[7]张宁,吕慧怡,范广俊,等.酶联免疫法监测肝移植术后他克莫司血药浓度[J].大连医科大学学报,2006,28(5):419-420.
[8]杨志福,赵磊,高迎春,等.酶联免疫法与微粒子酶免疫法检测全血他克莫司浓度的比较[J].中国医院药学杂志,2002,22(6):346-348.
[9]储小曼.环孢素和苯妥因治疗药物监测内部质控联系性的评价[J].中国药房,2006,17(6):440-442.
[10]秦晓光.室内质控的主要工具-质量控制图[J].中华检验医学杂志,2003,26(11):710-712.
