丹参酮ⅡA诱导瘢痕疙瘩成纤维细胞凋亡及细胞周期阻滞的实验研究
2012-06-14陈刚梁奕敏李青峰
陈刚 梁奕敏 李青峰
瘢痕疙瘩是一种持续生长并超出原皮肤创缘的病理性瘢痕,以成纤维细胞的不断增殖及细胞外基质(特别是胶原)的过度沉积为特征,被视为人类独有的真皮成纤维细胞肿瘤[1-3],现有的治疗方法效果欠佳,复发率极高[4-5]。
近来的研究认为,丹参与黄芪的混合提取物(CASE)可通过调节TGF-β/Smad通路,抑制瘢痕疙瘩成纤维细胞增殖、侵袭及胶原合成[6]。但CASE具体成分不明,而丹参酮IIA是丹参的主要活性成分之一,具有诱导白血病THP-1细胞、人肝癌细胞、人宫颈癌细胞、人乳腺癌细胞和人结肠癌细胞凋亡的作用[7-13]。本实验尝试应用丹参酮ⅡA干预瘢痕疙瘩成纤维细胞,观察其对瘢痕疙瘩成纤维细胞的增殖,细胞凋亡及细胞周期的影响,以期为临床治疗瘢痕疙瘩提供新的思路。
1 材料与方法
1.1 主要试剂及仪器
丹参酮ⅡA(上海第一生化药业有限公司)、胎牛血清FBS(美国BD公司),DMEM高糖培养液(美国Gibco公司)、Ⅰ型胶原酶(美国Sigma公司)、CCK-8(日本Dojindo公司)、胰蛋白酶(美国Difco公司)、酶联免疫检测仪 (美国Thermo公司)、Annexin V-FITC/PI双染细胞凋亡检测试剂盒 (美国BD公司)、流式细胞仪(美国BD公司)。
1.2 人瘢痕疙瘩成纤维细胞培养
实验所用瘢痕疙瘩材料均来源于上海交通大学医学院附属第九人民医院整复外科 (术前经患者同意),术后病理证实与临床诊断一致。材料来源患者均无长时间外用瘢痕药物史,不伴有肿瘤及其他严重疾病。取材后以胰酶消化法培养瘫痕疙瘩成纤维细胞[14],第1~2代细胞用于实验。
1.3 实验分组
实验采用两因素析因设计分组,瘢痕疙瘩成纤维细胞以含有不同浓度丹参酮ⅡA的培养液进行干预,干预浓度分别为(0 μg/mL、50 μg/mL、100 μg/mL 和200 μg/mL),不同干预时间观察细胞增殖、凋亡及周期变化,以 0 μg/mL 组为对照组,50 μg/mL、100 μg/mL和200 μg/mL为实验组。各组至少重复3次。
1.4 CCK-8测定细胞增殖情况
取细胞浓度1.5×104cells/mL的对数生长期瘢痕疙瘩成纤维细胞接种于96孔培养板,每孔接种100 μL, 按分组进行相应干预,培养 24 h、48 h、72 h、96 h和120 h。按照CCK-8试剂盒操作说明,更换普通培养液后,每孔加入10 μL的CCK-8试剂,孵育2 h,酶联免疫检测仪在450 nm波长处测定其光吸收值,吸光值间接反映活细胞数量。根据公式求出增殖抑制率(IR)。

1.5 细胞凋亡检测
上述浓度细胞悬液接种于6孔培养板,每孔接种1 mL,分别培养24 h、72 h和120 h后,按照Annexin V-FITC/PI双染细胞凋亡检测专用试剂盒的操作说明书操作,收集细胞,PBS洗涤2次,加入Annexin V-FITC 试剂 5 μL,1× Annexin V Blanding Buffer 60 μL孵育10 min后, 加入 PI试剂 5 μL及1× Annexin V Blanding Buffer 120 μL,混匀,流式细胞仪检测,分析Annexin V阳性且PI阴性细胞所占百分比,即细胞早期凋亡率。根据公式求出早期凋亡增加百分比。

1.6 细胞周期检测
上述浓度细胞悬液接种于90 mm培养皿,每皿接种3 mL,培养24 h、72 h和120 h后收集细胞,70%乙醇固定,4℃保存过夜,PBS洗涤,加入20 μL RNase,37℃孵育30 min后,暗处加PI染液,冰浴30 min,染色后以300目筛网过滤。调整细胞浓度为1×109cells/mL,流式细胞仪检测分析,记录每例细胞样品的G0/G1期、G2/M期、S期细胞百分比。根据公式计算G0/G1期细胞增加百分比。

1.7 数据处理及统计学分析方法
用SPSS 13.0进行统计学分析,采用析因设计方差分析,两两比较采用LSD法,P<0.001为差异有统计学意义。
2 结果
2.1 丹参酮ⅡA对瘢痕疙瘩成纤维细胞增殖活性的影响
各实验组瘢痕疙瘩成纤维细胞的增殖活性受到不同程度抑制,其中200 μg/mL组干预72 h、96 h和120 h后抑制作用十分明显,其增殖抑制率(IR)分别为100%、76.29%和71.72%。析因设计方差分析结果显示,干预浓度对细胞活性的影响具有统计学意义(P<0.001),干预时间对细胞活性的影响具有统计学意义(P<0.001),干预浓度和干预时间的交互作用对细胞活性的影响也有统计学意义(P<0.001)。采用LSD方法两两比较,不同干预时间的细胞活性差异均有统计学意义(P<0.001),不同干预浓度的细胞活性差异均有统计学意义(P<0.001)(图1)。
2.2 丹参酮ⅡA诱导瘢痕疙瘩成纤维细胞凋亡的情况
各实验组瘢痕疙瘩成纤维细胞的早期凋亡率明显增高,其中200 μg/mL组早期凋亡率增高最为明显,干预120 h后,早期凋亡率达41.62%,早期凋亡增加百分比达1 030.98%。析因设计方差分析结果显示,干预浓度对早期凋亡率的影响具有统计学意义(P<0.001),干预时间对早期凋亡率的影响具有统计学意义(P<0.001),干预浓度和干预时间的交互作用对早期凋亡率的影响也有统计学意义(P<0.001)。采用LSD方法两两比较,不同干预时间的早期凋亡率差异均有统计学意义(P<0.001)。不同干预浓度的早期凋亡率差异均有统计学意义(P<0.001)(图2、3)。
2.3 丹参酮ⅡA对瘢痕疙瘩成纤维细胞周期的影响
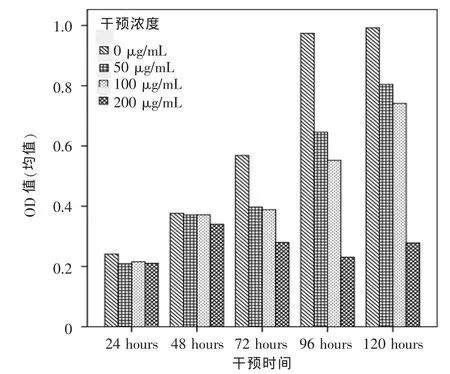
图1 CCK-8测定各组细胞增殖情况Fig.1 The cell proliferation of each group by CCK-8 examine

图2 流式细胞仪检测干预120小时后各组细胞凋亡情况Fig.2 Schematic diagram of the cell apoptosis 120 hours after arresting by flow cytometry examine
各实验组瘢痕疙瘩成纤维细胞的G0/G1期比例均不同程度增加,其中200 μg/mL组G0/G1期比例增加最为明显,干预120 h后,G0/G1期均值为94.16%,增加38.82%。干预浓度对G0/G1期比例的影响具有统计学意义(P<0.001),干预时间对G0/G1期比例的影响具有统计学意义(P<0.001),干预浓度和干预时间的交互作用对G0/G1期比例的影响也有统计学意义(P<0.001)。采用LSD方法两两比较,干预时间24 h与72 h、120 h的G0/G1期比例差异均有显著差异(P<0.001);干预72 h和120 h比较,G0/G1期比例无显著差异(P=0.07);200 μg/mL 组与 0 μg/mL组、50 μg/mL 组、100 μg/mL 组的 G0/G1 期比例差异均有统计学意义 (P<0.001),0 μg/mL 组与 50 μg/mL组、100 μg/mL组的G0/G1期比例差异均有统计学意义 (P<0.001),50 μg/mL 组与 100 μg/mL 组的G0/G1期比例的差异无统计学意义(P=0.937)(图 4、5)。

图3 流式细胞仪测得各组细胞早期凋亡情况Fig.3 The cell early apoptosis of each group by flow cytometry examine

图4 干预120 h后流式细胞术检测各组细胞周期情况Fig.4 Schematic diagram the cell cycle 120 hours after arresting at each group by flow cytometry examine
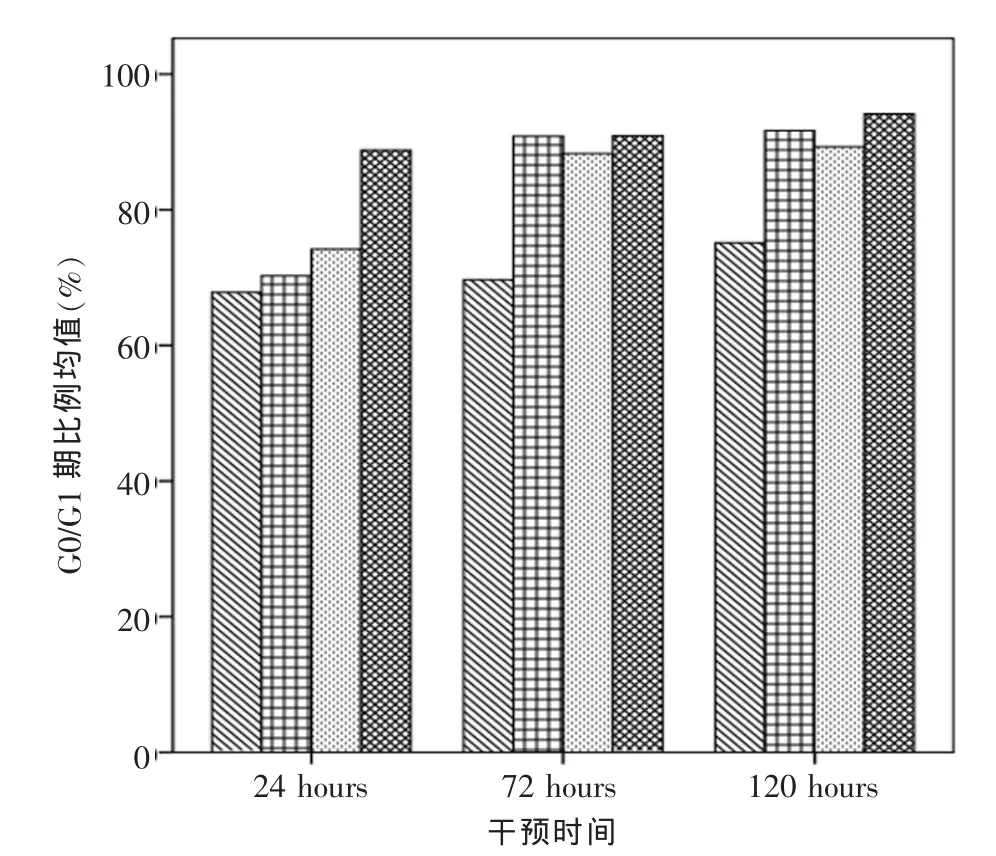
图5 流式细胞仪检测各组细胞周期G0/G1期比例情况Fig.5 The cell cycle G0/G1 phase ratio of each group by flow cytometry examing
3 讨论
瘢痕疙瘩是常见疾病,也是临床的治疗难点,其难治性和高复发率与瘢痕疙瘩的发病机制密切相关。瘢痕疙瘩成纤维细胞与正常成纤维细胞相比,其Ⅰ型胶原及纤维粘连蛋白过度表达且胶原多肽的降解降低,导致细胞外基质过度沉积;VEGF、TGF-β1、TGF-β2等生长因子及PDGF-α受体等生长因子受体过度表达,同时瘢痕疙瘩成纤维细胞对生长因子的刺激反应敏感;瘢痕疙瘩成纤维细胞增生及凋亡失衡,瘢痕疙瘩成纤维细胞的凋亡率要明显低于正常成纤维细胞[15-19]。常用的瘢痕疙瘩治疗方法中,5-氟尿嘧啶注射的治疗原理为诱导瘢痕疙瘩成纤维细胞凋亡和阻滞细胞周期[20],类固醇注射和放射治疗的原理之一也是增加瘢痕疙瘩成纤维细胞的凋亡率[15]。因此,寻找瘢痕疙瘩成纤维细胞凋亡缺陷机制,并有效诱导其凋亡,对瘢痕疙瘩的治疗具有重要意义[21-23]。
本实验中,我们发现丹参酮ⅡA干预体外培养的瘢痕疙瘩成纤维细胞后,实验组较对照组早期凋亡率明显升高,G0/G1期细胞比例明显升高。经两个因素析因设计方差分析显示,不同浓度丹参酮ⅡA干预和不同时间干预,对瘢痕疙瘩成纤维细胞的影响均具有统计学意义。高浓度的200 μg/mL组干预效果最明显,提示丹参酮ⅡA对抑制体外培养的瘢痕疙瘩成纤维细胞的增殖活性、诱导细胞凋亡和阻滞细胞周期等方面,均呈现干预浓度及干预时间的依耐性。CCK-8检测瘢痕疙瘩成纤维细胞活性时发现,200 μg/mL组干预72 h后,细胞增殖抑制率最高(100%);随后干预至96 h和120 h后,细胞增殖抑制率降低,分别为76.29%和71.72%,考虑增殖抑制率的这种下降趋势是由于干预至96 h和120 h后,出现接触抑制所致。
曾有研究将丹参酮ⅡA应用于兔耳增生性瘢痕模型中,发现丹参酮ⅡA对兔耳增生性瘢痕有明显的抑制作用[24]。另据报道,丹参酮ⅡA具有抑制胆管来源成纤维细胞增殖及胶原的分泌,并诱导MMP-9 mRNA的表达而促进胶原降解,抑制胆道瘢痕形成的作用[25]。由此可见,丹参酮ⅡA对瘢痕疙瘩和增生性瘢痕均有一定的抑制作用。有研究发现,在瘢痕疙瘩成纤维细胞中,凋亡抑制基因Bcl-2异常高表达[26],凋亡诱导基因P53表达异常[27],信号转导和转录激活蛋白3(STAT3)过度表达并且磷酸化[28],而丹参酮ⅡA已被证实可通过下调Bcl-2,激活P53,抑制STAT3,激活Caspase-3等多种途径,诱导多种肿瘤细胞的凋亡[13,29-31]。因此,考虑丹参酮ⅡA可能也是通过下调 Bcl-2,激活 P53,抑制 STAT3,激活 Caspase-3等途径对瘢痕疙瘩成纤维细胞产生干预作用,其具体机制尚有待于进一步的研究探讨。
[1]Shih B,Bayat A.Genetics of keloid scarring[J].Arch Dermatol Res,2010,302(5):319-339.
[2]Seifert O,Mrowietz U.Keloid scarring:bench and bedside[J].Arch Dermatol Res,2009,301(4):259-272.
[3]Tuan TL,Nichter LS.The molecular basis of keloid and hypertrophic scar formation[J].Mol Med Today,1998,4(1):19-24.
[4]Wolfram D,Tzankov A,Pulzl P,et al.Hypertrophic scars and keloids-a review of their pathophysiology,risk factors,and therapeutic management[J].Dermatol Surg,2009,35(2):171-181.
[5]Gupta S,Sharma VK.Standard guidelines of care:Keloids and hypertrophic scars[J].Indian J Dermatol Venereol Leprol,2011,77(1):94-100.
[6]He S,Yang Y,Liu X,et al.Compound astragalus and salvia miltiorrhiza extract inhibits cell proliferation,invasion and collagen synthesis in keloid fibroblasts by mediating TGF-β/Smad pathway[J].Br J Dermatol,2012,166(3):564-574.
[7]Liu J J,Zhang Y,Lin D J,et al.Tanshinone IIA inhibits leukemia THP-1 cell growth by induction of apoptosis[J].Oncol Rep,2009,21(4):1075-1081.
[8]Liu JJ,Lin DJ,Liu PQ,et al.Induction of apoptosis and inhibition of cell adhesive and invasive effects by tanshinone IIA in acute promyelocytic leukemia cells in vitro[J].J Biomed Sci,2006,13(6):813-823.
[9]Lee WY,Chiu LC,Yeung JH.Cytotoxicity of major tanshinones isolated from Danshen(Salvia miltiorrhiza)on HepG2 cells in relation to glutathione perturbation[J].Food Chem Toxicol,2008,46(1):328-338.
[10]Yuan SL,Wei YQ,Wang XJ,et al.Growth inhibition and apoptosis induction of tanshinone II-A on human hepatocellular carcinoma cells[J].World J Gastroenterol,2004,10(14):2024-2028.
[11]Zhou L,Chan WK,Xu N,et al.Tanshinone IIA,an isolated compound from Salvia miltiorrhiza Bunge,induces apoptosis in HeLa cells through mitotic arrest[J].Life Sci,2008,83(11-12):394-403.
[12]Wang X,Wei Y,Yuan S,et al.Potential anticancer activity of tanshinone IIA against human breast cancer[J].Int J Cancer,2005,116(5):799-807.
[13]Su CC,Chen GW,Kang JC,et al.Growth inhibition and apoptosis induction by tanshinone IIA in human colon adenocarcinoma cells[J].Planta Med,2008,74(11):1357-1362.
[14]Diao JS,Xia WS,Yi CG,et al.Trichostatin A inhibits collagen synthesis and induces apoptosis in keloid fibroblasts[J].Arch Dermatol Res,2011,303(8):573-580.
[15]Al-Attar A,Mess S,Thomassen JM,et al.Keloid pathogenesis and treatment[J].Plast Reconstr Surg,2006,117(1):286-300.
[16]Slemp AE,Kirschner RE.Keloids and scars:a review of keloids and scars,their pathogenesis,risk factors,and management[J].Curr Opin Pediatr,2006,18(4):396-402.
[17]Tsujita-Kyutoku M,Uehara N,Matsuoka Y,et al.Comparison of transforming growth factor-beta/Smad signaling between normal dermal fibroblasts and fibroblasts derived from central and peripheral areas of keloid lesions[J].In Vivo,2005,19(6):959-963.
[18]Luo S,Benathan M,Raffoul W,et al.Abnormal balance between proliferation and apoptotic cell death in fibroblasts derived from keloid lesions[J].Plast Reconstr Surg,2001,107(1):87-96.
[19]Marneros AG,Krieg T.Keloids-clinical diagnosis,pathogenesis,and treatment options[J].J Dtsch Dermatol Ges,2004,2(11):905-913.
[20]Huang L,Wong YP,Cai YJ,et al.Low-dose 5-fluorouracil induces cell cycle G2 arrest and apoptosis in keloid fibroblasts[J].Br J Dermatol,2010,163(6):1181-1185.
[21]Russell SB,Trupin KM,Rodriguez-Eaton S,et al.Reduced growthfactor requirement of keloid-derived fibroblasts may account for tumor growth[J].Proc Natl Acad Sci USA,1988,85(2):587-591.
[22]Fujiwara M,Muragaki Y,Ooshima A.Keloid-derived fibroblasts show increased secretion of factors involved in collagen turnover and depend on matrix metalloproteinase for migration[J].Br J Dermatol,2005,153(2):295-300.
[23]Bayat A,Walter JM,Bock O,et al.Genetic susceptibility to keloid disease:mutation screening of the TGF-beta3 gene[J].Br J Plast Surg,2005,58(7):914-921.
[24]张建华.应用丹参酮ⅡA磺酸钠抑制兔耳增生性瘢痕的实验研究[D].广西:广西医科大学,2010.
[25]战孝光,崔乃强,李忠廉,等.丹参酮IIA对兔胆管成纤维细胞的影响[J].中国中西医结合外科杂志,2010,16(3):326-330.
[26]Teofoli P,Barduagni S,Ribuffo M,et al.Expression of Bcl-2,p53,c-jun and c-fos protooncogenes in keloids and hypertrophic scars[J].J Dermatol Sci,1999,22(1):31-37.
[27]段红杰,高建华,沈光裕.瘢痕疙瘩成纤维细胞P53基因突变检测[J].中国临床康复,2002,6(22):3358-3359.
[28]Lim CP,Phan TT,Lim IJ,et al.Stat3 contributes to keloid pathogenesis via promoting collagen production,cell proliferation and migration[J].Oncogene,2006,25(39):5416-5425.
[29]Dong Y,Morris-Natschke SL,Lee KH.Biosynthesis,total syntheses,and antitumor activity of tanshinones and their analogs as potential therapeutic agents[J].Nat Prod Rep,2011,28(3):529-542.
[30]Kapoor S.Tanshinone IIA:a potent,natural anti-carcinogenic agent for the management of systemic malignancies[J].Chin J Integr Med,2009,15(2):153.
[31]Tang C,Xue HL,Huang HB,et al.Tanshinone IIA inhibits constitutive STAT3 activation,suppresses proliferation,and induces apoptosis in rat C6 glioma cells[J].Neurosci Lett,2010,470(2):126-129.
