基于mtDNA控制区新单倍型的斑背大尾莺种群遗传结构分析1)
2012-06-13赵雪琼张微微胡春芳丛日杰
赵雪琼 李 波 李 枫 张微微 胡春芳 丛日杰
(东北林业大学,哈尔滨,150040) (江西农业大学) (东北林业大学)
斑背大尾莺(Locustella pryeri)为东亚特有的鸟类,隶属于雀形目(Passeriformes)莺科(Sylviidae)蝗莺属(Locustella)[1]779-780,[2]。2010 年,IUCN 世界濒危物种红皮书和国际鸟盟将其列为易危物种(VU C1)[3]。目前,在我国发现斑背大尾莺有4个主要分布区域,即:江西南矶山、辽宁双台河口[4-5]、上海崇明岛[6]、黑龙江扎龙[7]。2010 年,对上海崇明岛保护区的斑背大尾莺巢址选择的研究表明,其鸟巢呈杯状,巢口朝上,上边由倒伏的枯互花米草覆盖。而南矶山、双台河口、扎龙地区的鸟巢呈椭圆形,巢口侧向下,位于芦苇和互花米草下面[8]。以上两者的巢形之间存在明显的区别,繁殖行为的不同,揭示了国内的斑背大尾莺种群发生了分化。
张微微等[9]对在扎龙自然保护区、双台河口自然保护区、江西南矶山自然保护区3个栖息地采集的斑背大尾莺样本(75个体)的线粒体控制区遗传多样性进行了分析,结果表明:分布在这3个栖息地的斑背大尾莺是属于同一个种群。由于该结果中缺乏上海崇明岛保护区斑背大尾莺的数据,仍然无法回答巢型相异与遗传学差异之间的关系问题。笔者旨在补充来自上海崇明岛的数据,并与其他3个栖息地的种群数据进行比较,以揭示上海崇明岛分布的斑背大尾莺种群是从属于指名亚种还是单独作为一个独立的种群,为制定有效的保护计划和策略提供依据。
1 材料和方法
1.1 羽毛样本采集和DNA提取
采集了16份斑背大尾莺羽毛样本,其中11份来自上海崇明岛自然保护区,5份来自辽宁双台河口自然保护区。获得的样品分析前-20°保存。羽毛样品DNA提取采用标准的苯酚—氯仿法,并使用AxyPrepTMDNA Kit(Axygen,杭州)进行纯化。
1.2 PCR扩增及扩增产物测序
斑背大尾莺mtDNA D_loop区扩增采用雀形目莺科通用引物H1248/L437[9]。PCR扩增反应体系为 10 μL:0.2 mmol·L-1dNTP、1.0×PCR buffer、0.2 μmol·L-1引物、0.5 U rTaqTM DNA 聚合酶(TaKa-Ra,大连),以及约10 ng的DNA模板。PCR反应条件为:94℃预变性4 min;94℃变性30 s,50℃退火45 s,72℃延伸1 min,35个循环;最后72℃延伸7 min。PCR产物用1.0%琼脂糖凝胶电泳分离后进行产物直接测序。测序由华大基因生物工程技术服务有限公司完成。
1.3 序列分析
测序获得的序列以及从GenBank下载的斑背大尾莺 mtDNA D_loop区序列(EU009402~EU009431;GU166299~GU166343)用 Clustal W 方法(MEGA 4.0)进行分析比对,然后用Kimura双参数法(MEGA 4.0)计算各群体单倍型之间的遗传距离。利用DNASP5.0软件统计单倍型及变异位点,计算单倍型多态性(Hd)及核苷酸多样性(Pi)。
单倍型间的系统发育关系利用MEGA 4.0和Network 4.5软件分析。利用Modeltest 3.7软件计算Gamma分布的参数为0.128 8,利用 UPGMA中Jukes-Canter方法(MEGA 4.0)构建系统发育树,分支置信度采用Bootstrap重复1 000次。并利用Network 4.5中Median-joining方法构建单倍型网图。
2 结果与分析
2.1 新单倍型序列的多态性
经琼脂糖凝胶电泳检测获得的mtDNA D_loop序列片段长度约为770 bp(图1)。测序后序列分析表明,从16个样品上检测出15个新的单倍型,其中,上海崇明岛10 个单倍型:C_1、C_3、C_4、C_5、C_6、C_7、C_8、C_9、C_10、C_11;辽宁双台河口 5 个单倍型:S_7、S_8、S_9、S_10、S_11(表1)。上海崇明岛种群单倍型中存在12个多态性位点,包括转换位点7个,颠换位点 7个,插入位点 2个,缺失2个。序列中不同的碱基在整个DNA的双链中所占的百分比平均为:A(腺嘌呤)32.6%,T(胸腺嘧啶)26.5%,C(胞嘧啶)11.8%,G(鸟嘌呤)29.1%。其中 A+T比为 59.1%,高于 G+C(40.9%)。
图1 控制区PCR扩增产物电泳结果(部分)

表1 斑背大尾莺控制区序列新单倍型的变异位点
2.2 种群遗传结构
在4个繁殖种群和1个越冬种群中,上海崇明岛种群的单倍型多样性(Hd=0.964)和核苷酸多样性(Pi=0.004 05)高于南矶山越冬种群、南矶山繁殖种群、双台河口种群、扎龙种群 (表2)。5个群体的遗传距离0.001 4~0.006 8(表3)。采用UPGMA中Jukes-Cantor方法构建单倍型系统发育树与Network单倍型网图结果一致(图2与图3)。不同地区的样本并没有单独聚集在一起而是交叉聚合,而且不同地区的样本还共享同一种单倍型(EU009402)。新定义的10个单倍型中,S_8与其他个体遗传学距离相距较远,为一独立分支(R);S_10、S_11聚为一支(W,置信度=99%),剩余单倍型聚为一支(F,置信度=56%)。依据控制区每百万年14.8%的进化速率[10],可以推测出 F—R 的分化发生在9.5~16.6万 a前(遗传距离 =0.019 3±0.005 2),F—W的分化发生在5.2~10.0万a前(遗传距离=0.011 3±0.003 5)。

表2 不同斑背大尾莺种群的单倍型多态性和核苷酸多态性
不同灰度代表不同的栖息地。圆点的大小与其在种群中所占比例呈正相关,线的长度与突变数量呈比例。
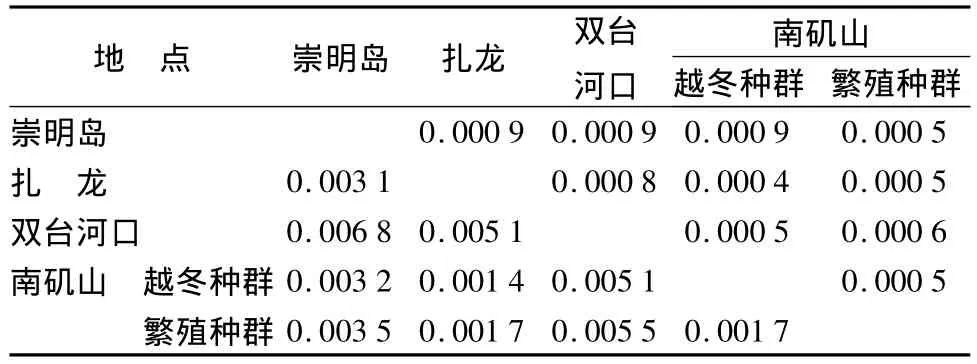
表3 斑背大尾莺种群间的遗传距离

图2 斑背大尾莺mtDNA控制区单倍型系统发育树
3 结论与讨论
斑背大尾莺属于典型的湿地鸟类,生性隐匿,对于生境要求比较严格,较难采集到试验样本。在新采集的16个样本中,检测出15个新的单倍型,其中上海分布区种群出现10个新的单倍型(表1)。4个栖息地的5个群体的遗传距离相距较近,遗传分化不明显。该结果与单倍型系统发育树和Network图结果相一致。虽然野外调查发现上海分布区的巢型与南矶山、双台河口、扎龙地区的巢型相异,但是mtDNA遗传分析表明,上海采集的样本与其他地区的没有发生遗传分化。由于mtDNA更能体现历史事件(如气候和地理因素)对种群遗传结构的影响,而巢型相异的问题可能与捕食的压力、当地特殊的环境等相关[11],因而二者间缺乏关联也是合理的。

图3 斑背大尾莺mtDNA控制区单倍型network图
通常认为,我国分布的斑背大尾莺属于汉口亚种(Locustella pryeri sinensis)[1]779-780,[9]。研究表明,单倍型EU009402是原始单倍型,其他的单倍型都是直接或者间接地由此发展演化形成的[9]。然而,双台河口新定义的3个单倍型与其他单倍型发生了明显的分化(图2和图3),其分支间的遗传距离显著大于各栖息地种群(约 10倍)。并且,通过2008—2010年3年的调查发现,双台河口斑背大尾莺种群在6月初开始营巢,而其他3个斑背大尾莺种群大概在4月末至5月初开始营巢。这似乎揭示了双台河口分布的斑背大尾莺部分发生了分化,或者后分化出的进化支(W,R)属于其他亚种或新亚种。目前由于斑背大尾莺指名亚种(Locustella pryeri pryeri)mtDNA数据缺乏,无法排除其飞越大洋来到大陆繁殖的可能性。
需要说明的是,本研究所采集和分析的样本数量有限,尚不能完全代表研究区域实际存在的斑背大尾莺种群数量和遗传结构。另外,mtDNA的母系遗传特性无法解决父系遗传的问题,使得该分子标记的使用效率受到了限制,如果能与核分子标记结合起来,则能更真实地体现种群的遗传结构[12],这些有待于后续的研究来解决。
致谢:本研究得到了上海崇明岛自然保护区、辽宁双台河口自然保护区、黑龙江扎龙自然保护区、江西南矶山自然保护区以及野生动植物检测中心的老师及同学的大力帮助,谨致谢忱!
[1]郑作新.中国鸟类区系纲要[M].北京:科学出版社,1987:779-780.
[2]约翰·马敬能,卡伦·菲利普斯,何芬奇.中国鸟类野外手册[M].长沙:湖南教育出版社,2000:361.
[3]IUCN.IUCN red list of threatened species[EB/OL].Gland:IUCN,2010.[2011-06-05].http://www.iucnredlist.org/.
[4]郑光美.中国鸟类分类与分布名录[M].北京:科学出版社,2005:294-317.
[5]郑作新.中国鸟类种和亚种分类名录大全[M].北京:科学出版社,2000:107-117.
[6]干晓静,章克家,唐仕敏,等.上海地区鸟类新记录3种:史氏蝗莺、斑背大尾莺、钝翅苇莺[J].复旦学报:自然科学版,2006,45(3):417-420.
[7]鲁长虎,李枫.黑龙江省鸟类新纪录种:斑背大尾莺[J].四川动物,1997,16(3):104.
[8]李枫,王强.斑背大尾莺sinensis亚种的繁殖生物学[J].动物学报,2006,52(6):1162-1168.
[9]Zhang Weiwei,Zhang Yuming,Wang Qiang,et al.Genetic diversity and population structure of Marsh Grassbird(Locustella pryeri sinensis)in China[J].Journal of Forestry Research,2010,21(3):361-366.
[10]Wenink P W,Baker A J,Rösner H-U.Global mitochondrial DNA phylogeography of holarctic breeding dunlins(Calidrk alpzna)[J].Evolution,1996,50(1):318-330.
[11]Zhao Liang,Zhang Xiaoai.Nest-site selection and competition coexistence of horned lark and small skylark[J].Zool Res,2004,25(3):198-204.
[12]Carlsson M,Söderberg L,Tegelström H.The genetic structure of adders(Vipera berus)in Fennoscandia:congruence between different kinds of genetic markers[J].Molecular Ecology,2004,13(10):3147-3152.
