不同基因缺失型酵母对全氟辛酸的灵敏性
2012-06-11金士威程巧红戴和平
金士威,程巧红, 戴和平
(1.武汉工程大学化工与制药学院,绿色化工过程教育部重点实验室,湖北 武汉 430074;2. 中国科学院水生生物研究所,淡水生态与生物技术国家重点实验室,湖北 武汉 430072)
0 引 言

酵母是最简单的高等真核生物,是真核生物研究的模式生物.酵母在三个不同水平上调节遗传毒性化学物在细胞内的累积:细胞壁、细胞膜的通透性以及细胞的多药抗性机制(PDR途径)[12].CWP1,CWP2基因编码细胞壁苷露糖蛋白,失活可明显提高酵母细胞壁通透性;SNQ1,SNQ2基因编码外排泵蛋白,失活可明显提高酵母内检测系统对不同分子量化学物的灵敏度;YAP1基因调控许多关键抗氧化基因的表达,失活可明显提高酵母检测系统检测DNA氧化损伤剂的能力[13].
由于全氟化合物的广泛使用和全球的普遍污染,越来越多的学者开始研究其在环境中的污染现状、致毒机理和对人体的健康威胁.采用基于细胞培养的离体生物方法评估环境污染物的毒理学效应,相比于鱼类、白鼠等活体动物实验,具有成本低、时间短、灵敏度高等优点,因此具有广阔的应用前景.酵母细胞属于单细胞生物,除了缺乏哺乳动物细胞复杂的受体系统外[14],还具有易培养、生长快、价格低等优点.本研究旨在筛选基因缺失型酵母来检测环境中的有毒污染物,以PFOA为污染物模型,探究其对不同缺失型酵母的毒性机理.
1 实验部分
1.1 实验试剂
本实验PFOA为纯度大于97%的固体,购买自Merck公司,标准储备液为1.0 mol/L,溶剂为二甲基亚砜(DMSO)、SD-Ura培养液.
SD-Ura培养液:酵母氮源无氨基无硫酸铵0.17%、硫酸铵 0.5%、腺嘌呤 0.2%、色氨酸 1%、组氨酸1%、亮氨酸1%、赖氨酸1%(以上百分数均为质量分数).
固体培养基加质量分数2%的琼脂粉,溶于蒸馏水中高压灭菌后,加入质量分数40%的葡萄糖致最终质量分数为2%.
1.2 实验器材
高压灭菌锅(LDZX-30KBS),上海申安医疗器械厂生产.摇床(THZ-C),江苏太仓实验设备厂生产.恒温培养箱,上海一恒科技有限公司生产.超净工作台(Ai Tech),苏州安泰空气技术有限公司生产.移液枪(eppendorf)、Ø90 mm培养皿、试管、三角瓶.
1.3 实验生物
本研究野生型酵母细胞BY4741和其4基因缺失型突变体(cwp1△cwp2△snq1△snq2△)、5基因缺失型突变体(cwp1△cwp2△snq1△snq2△yap1△)菌株均来自于中科院水生生物究所水生动物蛋白质工程学科组.
1.4 实验方法
实验前均将配制的SD-Ura培养液在高压灭菌锅中灭菌,把三种酵母(BY4741、4基因缺失型突变体、5基因缺失型突变体)接种到SD-Ura液体培养基中,30 ℃,200 r/min摇床过夜培养16 h.第二天用SD-Ura液体培养基将培养的酵母培养液稀释,分光光度计检测其OD值为0.11,继续30 ℃,200 r/min摇床培养2 h,测其OD值为0.14时开始染毒.染毒后的酵母培养液继续30 ℃,200 r/min摇床培养4 h.取出酵母细胞培养液在超净工作台用无菌水稀释105倍后,取100 uL涂SD-Ura固体培养基平板,30 ℃培养箱中培养两天,对长出的单克隆子进行统计计数.
2 结果与分析
2.1 DMSO溶剂对酵母生长的影响
生物实验常以DMSO为污染物的载体溶剂,本实验探索了不同的DMSO浓度对酵母生长的影响.由实验结果得知,当DMSO在培养液中的质量分数小于0.5%时,对3类酵母细胞的生长没有明显影响;而当DMSO质量分数为5%时,则产生明显的影响,特别是对5基因缺失型酵母突变体,影响更为显著,其存活率降为70%.故以后的实验中,培养液中DMSO的浓度不超过0.5%,以避免溶剂的影响.
2.2 染毒后酵母的培养时间与细胞生长量的关系
为了验证酵母细胞染毒后细胞生长量与培养时间的最佳关系,酵母细胞培养液在染毒后分别在30 ℃,200 r/min摇床分别培养0、2、4、6、8 h,随后分别在超净工作台用无菌水稀释105倍,分别取100 uL涂SD-ura固体培养基平板后,在30 ℃培养箱中培养两天后,对生长出的单克隆子计数,其结果如图1所示.染毒超过4 h后,酵母增殖上处于不增殖的状态,所以本实验酵母细胞培养液染毒后继续培养的时间定为4 h.
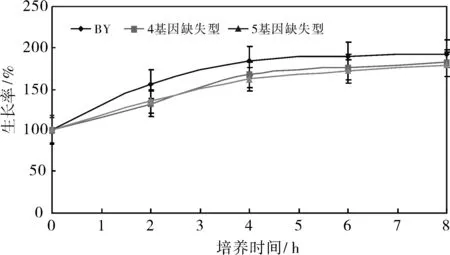
图1 酵母培养时间与酵母生长量的关系Fig.1 Effect of culture time on the growth of yeast
2.3 PFOA浓度对酵母生长的影响
酵母细胞培养液加PFOA后,30 ℃,200 r/min摇床继续培养4 h,在超净工作台用无菌水稀释105倍后涂SD-Ura固体培养基平板,30 ℃培养箱培养2 d后,对生长出的单克隆子计数,其结果如图2.由图2知,当PFOA浓度为0.6 mmol/L时,野生型酵母、4基因缺失型酵母突变体和5基因缺失型酵母突变体存活率分别为77.4%、69.7%和50.5%;当PFOA 浓度为1.2 mmol/L时,野生型酵母、4基因缺失型酵母突变体和5基因缺失型酵母突变体存活率分别为35.4%、15.2%、8.0%,4基因缺失型酵母突变体和5基因缺失型酵母突变体的存活率下降比较快;而当PFOA浓度大于1.2 mmol/L时,野生型、4基因缺失型酵母突变体和5基因缺失型酵母突变体存活率都为零(图中未显示).与野生型酵母相比,PFOA对4基因缺失型酵母突变体和5基因缺失型酵母突变体生长影响比较明显,而对5基因缺失型酵母突变体生长影响尤其明显.
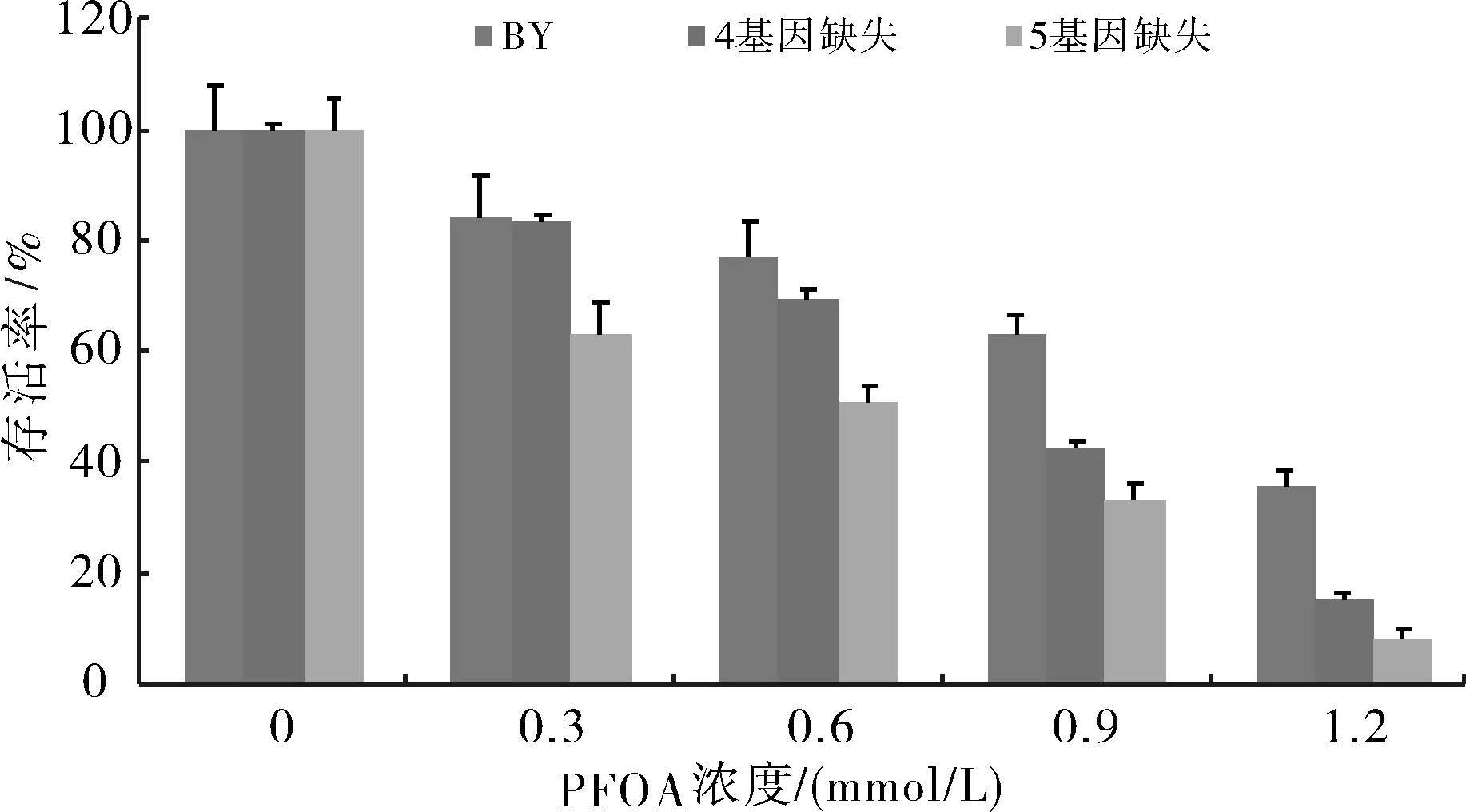
图2 PFOA对酵母毒性实验(n=4)Fig.2 Effect of the concentration of PFOA on the growth of yeast
由以上实验结果可知,PFOA对4基因缺失型酵母突变体和5基因缺失型酵母突变体的影响比野生型酵母细胞灵敏,可能因为4基因缺失型酵母突变体和5基因缺失型酵母突变体都缺失了编码细胞壁苷露糖和细胞外排泵蛋白的基因,从而对外界毒物抗性的抵御机制减少很多,能很灵敏的感受到外界环境的压力;而5基因缺失型酵母突变体比4基因缺失型酵母突变体又少了能调控许多关键抗氧化基因的表达的YAP1基因[12],缺失了YAP1基因的5基因缺失型酵母突变体比4基因缺失型突变体对PFOA的灵敏性更强,说明5基因缺失型酵母突变体受到外界环境压力的时候不能有效的防御细胞的氧化损伤.
综上,当缺失了编码细胞壁苷露糖和细胞外排泵蛋白的基因的酵母受到外界环境的压力或者毒物的胁迫时,毒物可能以分子的形式从细胞壁进入细胞[15],损害细胞的正常生理功能,进而致使酵母产生氧化损伤[13].

参考文献:
[1] 范英武, 郎朗, 季宇彬. 全氟辛酸毒性的研究现状[J]. 食品与药品, 2008, 10(7): 66-69.
[2] 贺志丽, 贺志霞, 陈瑞琴. 改性活性炭对水溶液中氟离子的吸附性能[J]. 武汉工程大学学报, 2012, 34(1): 43-47.
[3] 韩建, 方展强 .水环境PFOS和PFOA的污染现状及毒理效应进展[J]. 水生态学杂志, 2010, 3(2): 99-105.
[4] 刘健, 王海雁, 赵淑江. 全氟辛烷磺酰基化合物(PFOS)类物质水环境污染研究进展[J]. 海洋环境科学, 2011, 30(3): 451-456.
[5] Han X, Ermper K A, Jepson G W. Subcellular distribution and protein binding of perfluorooctanoic acid in rat liver and kidney [J]. Drug Chem Toxicol, 2005, 28(2): 197-209.
[6] 范轶欧, 金一和, 麻懿馨,等. 全氟辛烷磺酸对雄性大鼠生精功能的影响[J]. 卫生研究, 2005, 34 (1): 37-39 .
[7] 胡存丽, 仲来福. 全氟辛烷磺酸和全氟辛酸毒理学研究进展[J]. 中国工业医学杂志, 2006, 19(6): 354-358.
[8] 姚晓峰, 仲来福. 全氟辛酸对HepG2细胞的遗传毒性及氧化性DNA损伤[J]. 毒性学杂志, 2005, 19(3): 216-217.
[9] Lau C, Thibodeaux J R,Hanson R G, et al. Exposure to perfluorooctane sulfonate during pregnancy in rat and mouse.Ⅱ.Postnatal evaluation [J].Toxicological Sciences, 2003, 74: 382-392.
[10] Fenton S E,Reiner J L,Nakayama S E, et a1. Analysis of PFOA in dosed CD-1 mice.Part 2.Disposition of PFOA in tissues and fluids from pregnant and lactating mice and their pups[J]. Report Toxicol, 2009, 27(3-4): 365-372.
[11] Shix, Du Y, Lam P. Developmental toxicity and alte-ration of gene expression in zebra fish embryos exposed to PFOS[J]. Toxicological Sciences, 2008, 230(1): 23-32.
[12] Nguyen D T, Alarco A M , Raymond M. Multiple Yap 1 binding sites mediate induction of the yeast major facilitator FLR1 gene in response to drugs, oxidants and alkylating agents [J]. J Biol Chem. 2009, 276: 1138-1145.
[13] Min Zhang, Chao Zhang, Jia Li. Inactivation of YAP1 Enhances Sensitivity of the Yeast RNR3-lacZ Genotoxicity Testing System to a Broad Range of DNA-Damaging Agents[J]. Toxicological Sciences, 2011, 120(2): 310-321.
[14] Jork J A B, Butenhoff J L, Wallace K B. Multiplicity of nuclear receptor activation by PFOA and PFOS in primary human and rodent hepatocytess[J]. Toxico-logy, 2011,288:8-17.
[15] 汪琨, 徐峥, 汪倩雯,等. 肉桂醛特异性抑制酵母细胞壁合成的作用机理[J]. 食品与发酵工业, 2012, 38(3): 68-72.
[16] 孙学志,金军, 王英. 全氟辛烷磺化物及其环境问题[J]. 环境污染与防治, 2007, 3(29): 216-220.
[17] Yamada H, Taylor P H, Buck R C, et al. Thermal degradation of fluorotelomer treated articles and related materials[J]. Chemosphere, 2005,61(7):974-984.
[18] Nobuyoshi Y, Kurunthachalan K, Sachi T, et al. A global survey of perfluorinated acids in oceans[J]. Environ Sci Tec hnol, 2005, 50: 658-668.
[19] Kannan K, Corsolini S, Falandysz J, et al. Perfluor-ooctane sulfonate and Related Fluorinated Hydroca-rbons in Marine Mammals, Fishes and Birds from Coasts of the Baltic and the Mediterranean Seas[J]. Environ Sci Technol, 2002, 36(3): 210-216.
[20] Ehresman D J, Froehlich J W, Olsen G W, et al. Comparison of human whole blood, plasma and serum matrices for the determination of perfluorooctane sulfonate (PFOS), perfluorooctanoate (PFOA)[J]. Environ Res, 2007, 103(2): 176-184.
[21] Moriwaki H, Takatah Y, Arakawa R. Concentrations of perfluorooctane sulfonate (PFOS) and perfluoroo-ctanoic acid (PFOA) in vacuum cleaner dust collected in Japanese homes[J]. Environ Monit, 2003, 5: 753-757.
