先天性心脏病患儿22q11微缺失的临床研究
2012-06-08王凤羽马林先李聪敏常明秀丰慧根张金枝王玉伟刘治佑
王凤羽 马林先 李聪敏 常明秀 丰慧根 张金枝 孟 丽 王玉伟 刘治佑
1.河南省人口和计划生育科学技术研究院,河南省出生缺陷干预技术研究重点实验室(郑州,450002);2.新乡医学院生命科学技术系;3.河南省胸科医院
先天性心脏病(CHD)是胚胎在发育过程中由于心脏、血管发育障碍所致的心脏血管形态、结构、功能、代谢上的异常[1]。22q11.2微缺失综合征是迄今为止少数已明确的CHD病因之一。22q11微缺失区域位于 D22S427/1638和 D22S306/308之间,大小为1.5~3 Mb。目前普遍认为,缺失发生的原因是染色体减数分裂后重组时出现不对称和异常。Saita等[2]对20个DGS/VCFS家系22q11.2区域的3Mb片断进行了研究,结果发现单倍体重组时同源染色体近端内部交换现象极为普遍。此外,22q11区域的低重复拷贝序列(LCRs)间错误结合也可导致一对染色体重排,其中一条发生缺失。本研究运用多重链接依赖式探针扩增技术(MLPA)对CHD患儿进行22q11微缺失检测,了解其在CHD患儿中的发生情况,探讨 MLPA用于临床诊断22q11微缺失的应用价值,为CHD的优生咨询和产前诊断提供依据。
1 对象与方法
1.1 研究对象
随机选取2010年6月~2011年5月河南省胸科医院小儿心胸外科CHD患儿120例为研究对象。其中男性58例,女性62例;年龄6个月~12岁;相互之间均无亲缘关系。所有病例均经临床、心脏彩超、手术确诊,且采用细胞培养的方法进行染色体核型分析,未发现异常。本研究标本使用均得到患儿家属知情并同意。60例无CHD家族史的河南汉族正常儿童作为正常对照。
1.2 方法
1.2.1 基因组DNA提取与检测 用醋酸钾沉淀蛋白质,异丙醇沉淀基因组DNA,TE溶解。紫外分光光度计检测DNA浓度及质量,A260/A280=1.8,A260/A230>2,TE 溶液稀释至 50ng/μl的终浓度,-20℃备用。
1.2.2 MLPA检测 采用荷兰 MRC-Holland公司生产的MLPA P250试剂盒,共48个探针,其中29个位于22q11上,其余19个位于22q11以外,作为对照探针。22q11.2 LCR缺失核心区域探针共24个,分布见图1。所有的反应在热盖温度为105℃的聚合酶链反应(PCR)仪上进行。
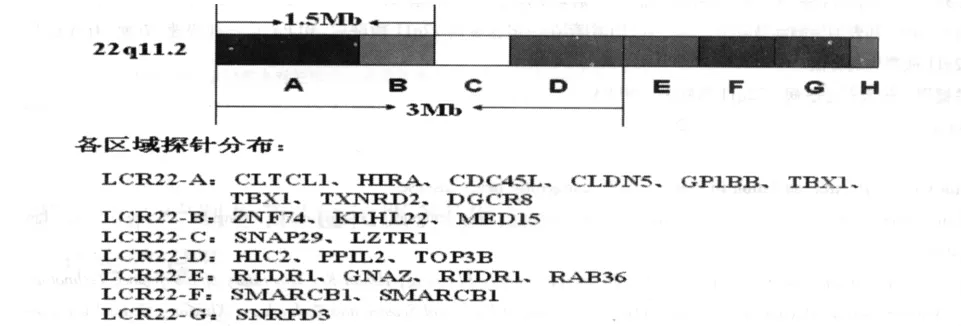
图1 22q11.2 LCR A-G区域的大小及探针分布情况
1.2.3 多重探针杂交 取待测DNA 150ng置于PCR管中,加H2O 至5μl,于PCR 仪上98℃变性5min,快速降温,25℃ 维持。取出PCR管,加入多重探针及MLPA 缓冲液各 1.5μl,充分混匀后,95℃ 变性1min,60℃杂交 16h,54℃维持。
1.2.4 多重探针链接 在上述PCR管内加入链接酶1μl及连接酶缓冲液 A、B各3μl,再加入 H2O 25μl。配成40μl反应体系,54℃ 反应 15min,随后98℃ 5min灭活链接酶。
1.2.5 多重PCR反应 取上述链接产物10μl,分别加入4μl SALSA PCR 缓冲液、26μl H2O,配成 40μl反应体系进行 PCR扩增,扩增条件为:95℃ 30s,60℃ 30s,72℃ 60s,35 个循环。72℃ 延伸 20min,15℃维持。
1.3 毛细管电泳检测
取2μl PCR 产物,分别加入32μl SLS,0.3μl D1maker,混匀,利用遗传分析仪(BECKMAN CEQ 8800)对扩增产物进行毛细管电泳和采集数据。
1.4 MLPA产物分析及结果判定
将CEQ System分析后的数据转换为Excel格式,所得数据通过Coffalyser v9.4软件(Holland-MRC公司)进行分析,得出基因相对拷贝数比值。根据试剂盒说明书,0.3﹤比值﹤0.7,表示该探针所检测基因片段存在杂合缺失;0.7﹤比值﹤1.3,表示该基因片段无缺失;0﹤比值﹤0.3,表示该探针检测的片段纯合子缺失;比值﹥1.3表示该检测区域存在重复片段。
2 结果
2.1 一般情况
本次研究的120例CHD患儿中,室间隔缺损占35.8%(43/120),法洛四联症占 19.2%(23/120),房间隔缺损占10%(12/120)。另外还有房室间隔缺损,室间隔缺损伴卵圆孔未闭,室间隔缺损伴肺动脉狭窄等其它复合类型。
2.2 检测结果
120例CHD患儿中,检出22q11缺失10例,占8.33%;检出 22q11重复 1例,占 0.83%;剩余 109例患儿未检测到异常,占90.84%。所有阳性标本均进行了3次重复实验,所得结果一致。见图2,表1。10例22q11缺失中,3Mb缺失9例,2Mb缺失1例,包括室间隔缺损3例,法洛四联症5例,肺动脉狭窄1例,右室双出口1例。另外,检测到小片段重复1例,CHD类型为肺动脉狭窄。见表2。
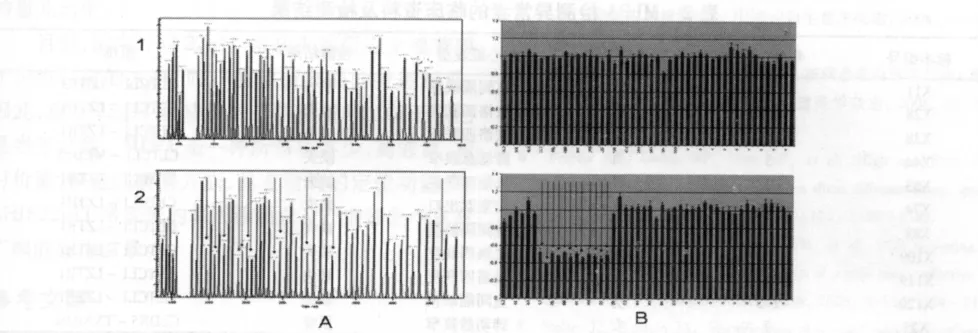
图2 MLPA P250试剂盒检测结果

表1 MLPA阳性病例的基因相对拷贝数比值
3 讨论
CHD占据了出生缺陷疾病的1/3,WHO统计资料显示,全球每年约有150万儿童出生时患DHD,在足月和活产的新生儿中CHD的发病率为4‰~8‰,在早产儿、死产或流产病例中发病率更高[3]。我国CHD患病率为2.24‰ ~13.8‰,较严重的CHD多伴有心外畸形及多种功能障碍,如腭裂、唇裂、免疫功能下降、语言障碍、身体和智力发育不良等。CHD患病率居高不下,已成为影响儿童身心健康及人口生存质量的重大公共卫生问题,给社会和家庭造成了严重的经济和精神等方面的负担。因此,研究CHD的病因,进一步开展CHD的优生咨询和产前诊断具有重要意义。
本研究应用MLPA,对120例不同表型的CHD患儿进行22q11微缺失检测,结果显示,120例CHD患儿中22q11微缺失10例(8.33%),涉及的CHD类型多样,其中室间隔缺损3例,法洛四联症5例,肺动脉狭窄1例,右室双出口1例。此外,还检测出1例22q11重复(0.83%),其表型为肺动脉狭窄。
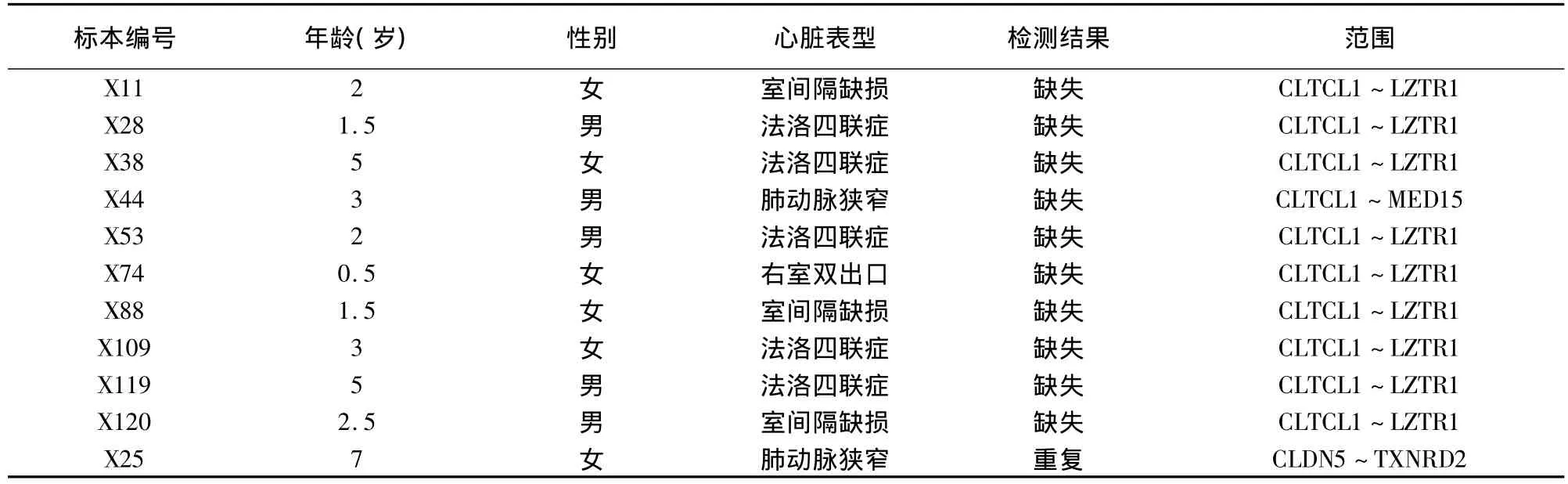
表2 MLPA检测异常者的临床资料及检测结果
22q11.2微缺失在CHD中的比率约为5% ~12%,最常见的表现为室间隔缺损和动脉导管未闭,房间隔缺损也很常见[4,5],这与本研究结果 8.33%基本一致。检测22q11微缺失的方法有很多。最早用染色体核型分析的方法进行诊断,但检出率较低。荧光原位杂交(FISH)方法既有分子杂交的高度特异性和敏感性,又能在染色体原位显色,定位准确,结果稳定。但由于DNA探针的高度特异性,不属于DNA探针范围之内的缺失可能会漏诊。此外耗时、昂贵等缺点使FISH检测在遗传学研究和临床诊断应用上受到一定限制。多重 PCR技术,即利用22q11区域的微卫星标记,进行22q11微缺失检测,结果发现82%的病例有不同的微卫星位点杂合性缺失[6]。该方法方便,成本低,检测时间短且比较可靠。但是,该方法必须要有父母的DNA样品做对照,并且对扩增产物为单一条带者,难以判别是否存在缺失。有时还必须选取更多的微卫星标记,增加成本和工作量。实时荧光定量PCR技术检测出22q11微缺失结果与 FISH的符和率达99.7%[7]。该技术快速,方便,但不能检测出染色体的嵌合现象和染色体的平衡易位。
MLPA是2002年由荷兰的Schouten等设计发明的,仅需50~200ng DNA,能在同一反应管中对40多个不同的待测核酸靶序列进行定性和半定量分析。其原理是:针对不同的目的基因序列分别设计一对上下游探针,若待测DNA样本中含有正常序列,上下游探针则可与其互补结合并通过链接酶链接成一条完整的探针,作为模板进行PCR反应;若目的基因有缺失,两条探针则不能链接,因而形成的模板减少,相应终产物的毛细管电泳峰高降低或峰面积减小;反之,目的基因有重复时则导致毛细管电泳峰高上升或峰面积增大。所以通过终产物电泳峰高或峰面积的变化可判定是否存在基因缺失或重复,如连续多个基因发生缺失或重复,则可判定为基因片段缺失或重复[8]。
通过对120例样本的检测,笔者体会到高密度探针MLPA检测染色体微缺失具有多种优势:①能精确定位缺失片段及判定其大小;②对FISH不能检测的远端缺失或重复有较强的检测能力;③设立的对照位点多,使结果更加可靠;④MLPA检测具有快速、价廉、自动化等特点。然而本方法也存在一些缺陷,由于变性不完全,盐离子浓度过高导致本研究中有2个样本需要重复实验。延长变性时间使变性更充分;用去离子水洗脱DNA降低离子浓度;对实验仪器和耗材严格消毒等手段可以增加实验的稳定性和成功率。另外发现,分析数据中存在个别染色体基因相对拷贝数比值低于设定范围的现象,可能是受实验室条件影响,有待进一步分析,以便优化实验条件,确保结果的真实性。
大多数学者认为,凡是 CHD患者均应进行22q11微缺失检测。因为对于患有染色体22q11微缺失的人来说,无论临床表现有否和轻重如何,都有一半几率将致病基因遗传给后代,而且通常也会伴有其他方面的缺陷。因此,如果发现患儿有22q11微缺失时,应对其父母进行同样检测,以便为他们生育第二胎提供遗传咨询,以有效避免有严重综合征的患儿出生。
目前,国内外对22q11微缺失的研究主要着眼于出生以后的人群,而产前诊断方面的报道鲜见。因此,建立22q11微缺失的产前诊断和二级干预已是当务之急。MLPA是一种所需样本少,高通量,相对价廉、快速的检测方法,具有精确的定位功能,在CHD 22q11微缺失的基因诊断以及产前诊断中具有广阔的应用前景。
1 Sadowski SL.Congenital cardiac disease in the newborn infant:past,present,and future[J].Crit Care Nuts Clin North Am,2009,21:37-48.
2 Saita SC,Harris SE,Gaeth AP,et al.A berrant interchromosomal exchanges are the predominant cause of the 22q11.2 deletion[J].Hum Mol Genet,2004,13(4):417-428.
3 高燕,黄国英.先天性心脏病病因及流行病学研究进展[J].中国循证儿科杂志,2008,3(2):213-222.
4 张志芬,韩维田,杨唤杰,等.先天性心脏病缺陷患者染色体22q11微缺失的检测[J].中国计划生育学杂志,2008,16(8):488-490.
5 许争峰,易龙,莫绪明,等.先天性心脏病患者染色体22q11微缺失检测及相关分析[J].中华医学遗传学杂志,2006,23(3):250-255.
6 Pereira AC,Correa RF,Mota GF,et al.High specificity PCR screening for 22q11.2 microdeletion in three different ethnic groups[J].Braz J Med Biol Res,2003,36(10):1359-1365.
7 Pereira LG,Pereira AC,Mesquita SM,et al.PCR screening for 22q11.2 micro-deletion:Development of a new cost-effective diagnostic tool[J].Clinica Chimica Acta,2006,11(5):114-118.
8 Stoller JZ,Epstein JA.Identification of a novel nuclear localization signal in Tbx1 that is deleted in DiGeorge syndrome patients harboring the delCmutation[J].Hum Mol Genet,2005,14(7):885-892.
