地塞米松和饲粮能量水平对肉仔鸡能量采食及神经肽Y基因表达的影响
2012-06-06磊宋志刚孔焦洪超
刘 磊宋志刚孔 雪 焦洪超 林 海
(山东农业大学动物科技学院,泰安 271018)
随着养殖业逐步向规模化、集约化发展,养殖过程中存在的诸多应激因素亦因之受到重视,如高温、拥挤、免疫接种、有害气体等。面对应激,机体会产生一系列生理及神经内分泌的应答反应,表现出食欲、能量存储以及体内能量流动模式的变化,动物的采食量及采食饲料的种类受到影响,最终造成生产性能及胴体品质的改变。研究应激对家禽食欲的影响机制对促进家禽生产和提高饲料效率意义重大。应激反应不仅降低了家禽生产性能,也影响到了能量的沉积和利用效率。皮质酮处理后的肉仔鸡能量利用效率显著降低[1],大量能量以脂肪形式被储存[2]。而高能饲粮能够缓解应激带来的一些不利影响,如高能饲粮显著提高了应激肉仔鸡的采食量和体增重[3]。Zulkifli等[4]发现应激能够激活家禽的下丘脑-垂体-肾上腺(HPA)轴,导致糖皮质激素的大量分泌,糖皮质激素与其受体结合后,能通过改变相关基因的转录和蛋白的表达来调控机体能量资源的重新分配。地塞米松(DEX)是一种人工合成的糖皮质激素,它能与糖皮质激素受体特异性的结合。相比其他人工合成的糖皮质激素而言,DEX作用时间较长,更能代表体内的糖皮质激素的作用模式[5]。Qi等[6]用1 mg/kg的 DEX注射大鼠,发现大鼠脂肪酸和葡萄糖代谢紊乱。本实验室在肉仔鸡上经过长期试验确定按2 mg/kg DEX对肉仔鸡进行长期(3~7 d)注射,可以成功诱导肉仔鸡的糖脂代谢发生改变[7-9]。
神经肽Y(NPY)广泛分布在中枢神经系统和外周组织,尤其在下丘脑弓形核(ARC)中高度表达,其促进摄食的功能不断受到人们的广泛关注。NPY神经元从ARC投射到腹内侧核(VMN)、背内侧核(DMN)和室旁核(PVN),形成了密集的NPY网络,此网络在摄食调控中起着重要的作用[10-11]。中枢注射 NPY 可提高鼠、鸡、羊和猪的采食量。糖皮质激素受体也在家禽的下丘脑中广泛的分布[12],而糖皮质激素是否会影响下丘脑中的NPY表达,尚未见报道。本试验通过腹部注射DEX来模拟应激模型,旨在研究肉仔鸡在应激状态下对不同能量水平饲粮的偏嗜性,同时初步研究应激影响家禽采食行为的作用机理。
1 材料与方法
1.1 试验设计
体重相近的180只23日龄的雄性爱拔益加(AA)肉鸡随机分成6组,每组3个重复,每个重复10只鸡。试验采用2×3析因设计,因素为DEX[处理(注射DEX 2 mg/kg)、未处理(注射等剂量生理盐水)]和饲粮能量水平[高能(HE)、低能(LE)以及高能、低能自由采食(H-LE)]。H-LE饲粮在1组中同时放2个料槽,分别盛有HE饲粮和LE饲粮。预试期5 d,正试期7 d,为28~34日龄,每天在08:00和10:00之间进行注射,期间所有的鸡自由饮水。DEX购自山东鲁抗辰欣药业有限公司,批号为H37021969,浓度为3.85 mg/mL。试验饲粮组成及营养水平见表1。
1.2 试验方法
1.2.1 数据记录和样品采集
每天记录肉仔鸡的体重和采食量,并计算采食量、体增重、耗料增重比和耗能增重比。34日龄注射后空腹2 h,每个重复随机选取3只鸡(每个处理 9只),翅下静脉窦采血,肝素抗凝,3 000 r/min离心10 min,分离血浆,-20℃保存待测;然后将肉仔鸡屠宰,剥取下丘脑,于液氮速冻后-80℃冰箱保存以备抽提总RNA;剥离腹脂和肠道(包括十二指肠、空肠和回肠,并去除肠道内容物),称重并计算腹脂率和肠道指数。
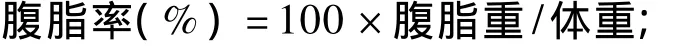

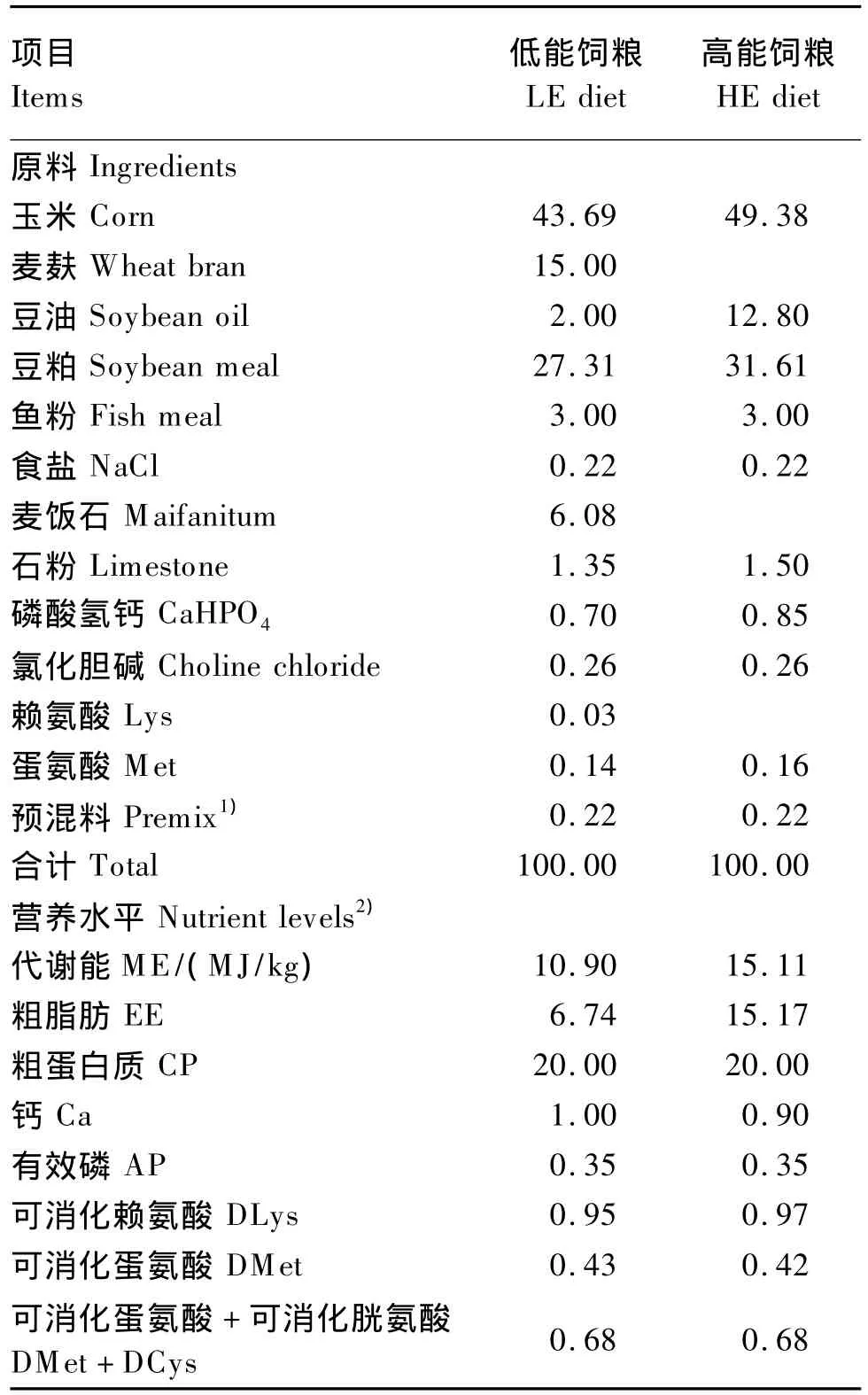
表1 试验饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experimental diets(air-dry basis) %
1.2.2 血浆指标的测定
血浆中葡萄糖、尿酸和甘油三酯浓度采用VITALAB MICRO半自动生化仪测定,试剂盒购自南京建成生物技术研究所。
1.2.3 下丘脑NPY基因表达量测定
下丘脑总RNA用异硫氰二胍盐法提取,利用琼脂糖凝胶电泳和生物分光光度计(Biophotometer plusone,德国Eppendorf)分别检测总RNA的质量和浓度。按照TaKaRa RNA PCR反转录试剂盒操作说明进行反转录。反应体系为:500 ng总RNA、5 mmol/L MgCl2、1 μL RT buffer、1 mmol/L dNTP、2.5 U 逆转录酶(AMV)、0.7 nmol/L oligo d(T)和 10 U Ribonuclease inhibitor,加 DEPC 水至10 μL。42 ℃反应 40 min,99 ℃ 灭活 5 min,降低到5℃ 5 min。
cDNA合成以后进行荧光定量PCR。磷酸甘油醛脱氢酶(GAPDH)(上游:5'-ACATGGCATCCAAGGAGTGAG-3', 下 游:5'-GGGGAGACAGAAGGGAACAGA-3')和NPY的引物(上游:5'-GAGGCACTACTCAACCTCATCAC-3',下 游:5'-TGTTTTCTGTGCTTTCCCTCAA-3')由上海生工生物技术有限公司合成。通过对混合样品进行标准曲线测定确定引物的质量及最佳的稀释浓度。反应体系为 20 μL:10 μL SYBR Premix Ex TaqTM(2 × )、上游和下游引物(10 μmol/L)各0.4 μL、0.4 μL ROX Reference Dye Ⅱ(50 × )、2 μL cDNA模板和6.8 μL去离子水。PCR反应程序为:95.0℃预变性10 s;95.0℃变性5 s,60℃延伸和退火34 s,40个循环。
参照 Livak 等[13]的方法用 2-ΔΔCt法定量目标基因相对表达量,以GAPDH作为参照基因进行校正[7]。
1.3 数据统计分析
试验数据用平均值±标准误表示,DEX和饲粮能量水平的互作效应采用SAS 9.1.3统计软件ANOVA进程进行双因子方差分析,以P<0.05为存在互作效应。差异显著者用Duncan氏法进行多重比较,以P<0.05为差异显著。
2 结果
2.1 DEX和饲粮能量水平对肉仔鸡生产性能的影响
由表2可知,DEX处理极显著降低了肉仔鸡的采食量和体增重(P<0.01),极显著提高了耗料增重比和耗能增重比(P<0.01)。饲粮能量水平对肉仔鸡的体增重(P<0.05)、耗料增重比(P<0.05)和耗能增重比(P<0.01)有显著影响;其中采用LE饲粮体增重显著低于其他2种饲粮(P<0.05),耗料增重比显著低于HE饲粮(P<0.05);采用HE饲粮耗能增重比极显著高于其他2种饲粮(P<0.01),采用LE饲粮极显著低于其他2组(P<0.01)。DEX、饲粮能量水平对耗料增重比(P <0.05)和耗能增重比(P <0.01)的影响存在显著的互作效应。
2.2 DEX和饲粮能量水平对肉仔鸡血浆生化指标的影响
由表3可知,DEX处理极显著提高了肉仔鸡血浆葡萄糖、甘油三酯和尿酸浓度(P<0.01),其中葡萄糖浓度提高了68.35%,尿酸浓度提高了208.47%;饲粮能量水平对血浆葡萄糖、甘油三酯和尿酸浓度影响不显著(P>0.05);DEX、饲粮能量水平对血浆葡萄糖、甘油三酯和尿酸浓度的影响无显著互作效应(P>0.05)。
2.3 DEX和饲粮能量水平对肉仔鸡肠道指数、腹脂率和下丘脑NPY基因表达量的影响
由表4可知,DEX处理显著提高了肉仔鸡的肠道指数(P<0.05),极显著提高了腹脂率(P<0.01)。饲粮能量水平对腹脂率有极显著影响(P<0.01),对肠道指数无显著影响(P>0.05);采用LE饲粮腹脂率极显著低于其他2种饲粮(P<0.01)。DEX、饲粮能量水平对肠道指数和腹脂率的影响无显著互作效应(P>0.05)。
DEX处理对肉仔鸡下丘脑NPY基因表达量的影响不显著(P>0.05)。采用H-LE饲粮NPY基因表达量显著高于LE饲粮(P<0.05)。DEX、饲粮能量水平对肉仔鸡下丘脑NPY基因表达量的影响无显著互作效应(P>0.05)。
3 讨论
3.1 DEX和饲粮能量水平对血浆生化指标的影响
家禽的肝脏是脂类生成的主要器官[14],DEX能够促进肝脏内的脂类合成[8],肝脏内合成的甘油三酯被运输到血液中,血液甘油三酯浓度得到提高。急性应激时,HPA轴通过与肾上腺素、胰高血糖素和交感神经系统的互作,提高血糖浓度,满足机体重要器官对葡萄糖的需求。在长期应激反应中糖皮质激素具有重要作用,其作用主要表现为脂肪和肌肉组织的动员和肝脏糖异生过程的加强,导致血糖浓度和游离脂肪酸浓度升高[15-16]。本试验结果表明,在DEX作用下,肉仔鸡体内的血糖浓度显著提高,增加了糖原的异生。Lin等[15]研究表明饲粮中添加30 mg/kg的皮质酮增强了肉仔鸡机体蛋白质的分解代谢;Menconi等[17]在大鼠和小鼠肌小管的体外试验中发现,DEX不仅抑制了蛋白质的合成代谢,还促进了它的分解代谢,在本试验中,DEX提高了血浆中的尿酸浓度,与前人的研究一致。DEX对生长后期的肉仔鸡处理7 d,血浆葡萄糖、甘油三酯和尿酸浓度都有相应变化,提示DEX已经改变了体内糖脂代谢过程。
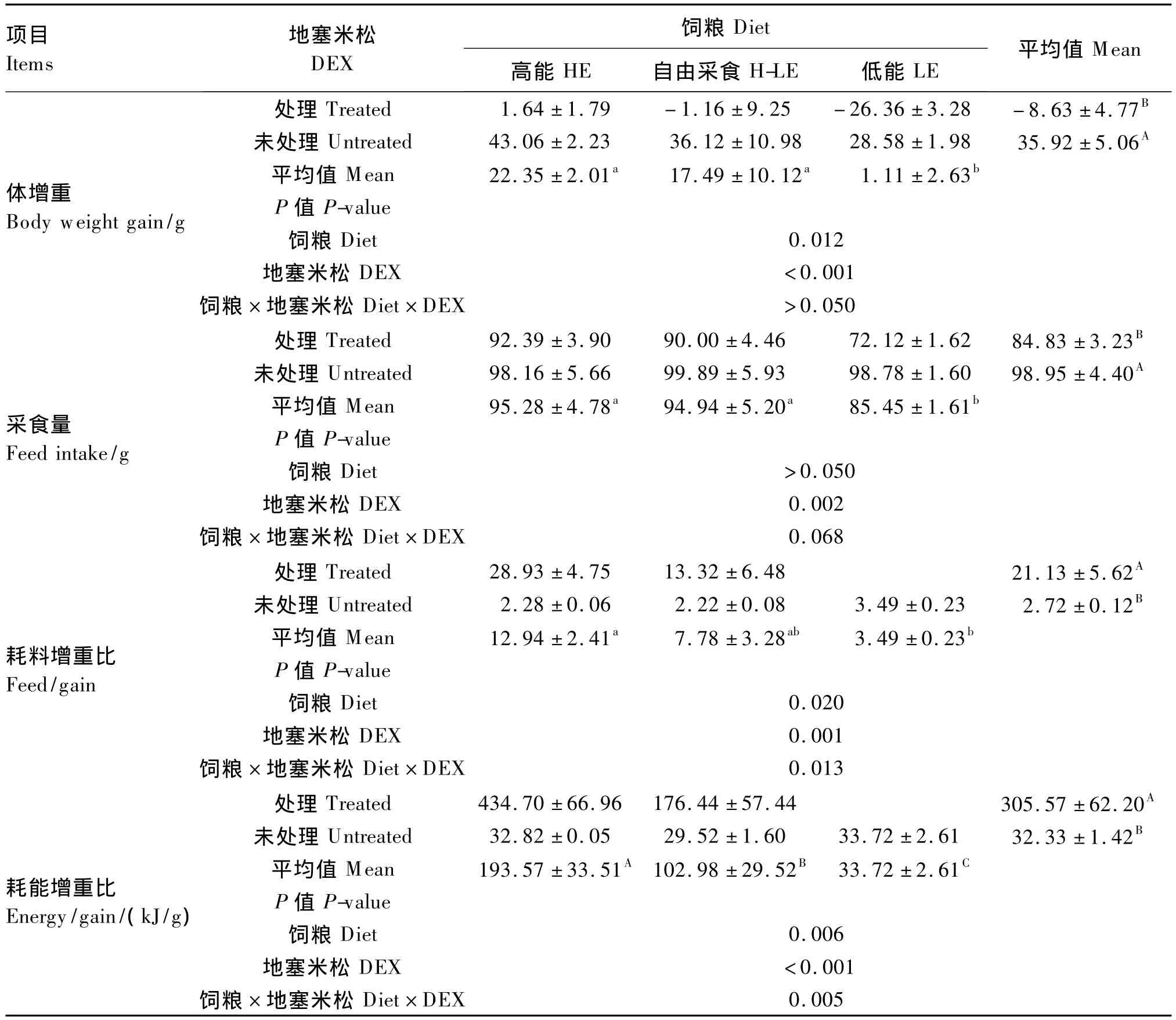
表2 DEX和饲粮能量水平对肉仔鸡生产性能的影响Table 2 Effects of DEX and dietary energy level on performance of broiler chickens

表3 DEX和饲粮能量水平对肉仔鸡血浆生化指标的影响Table 3 Effects of DEX and dietary energy level on plasma biochemical indices of broiler chickens
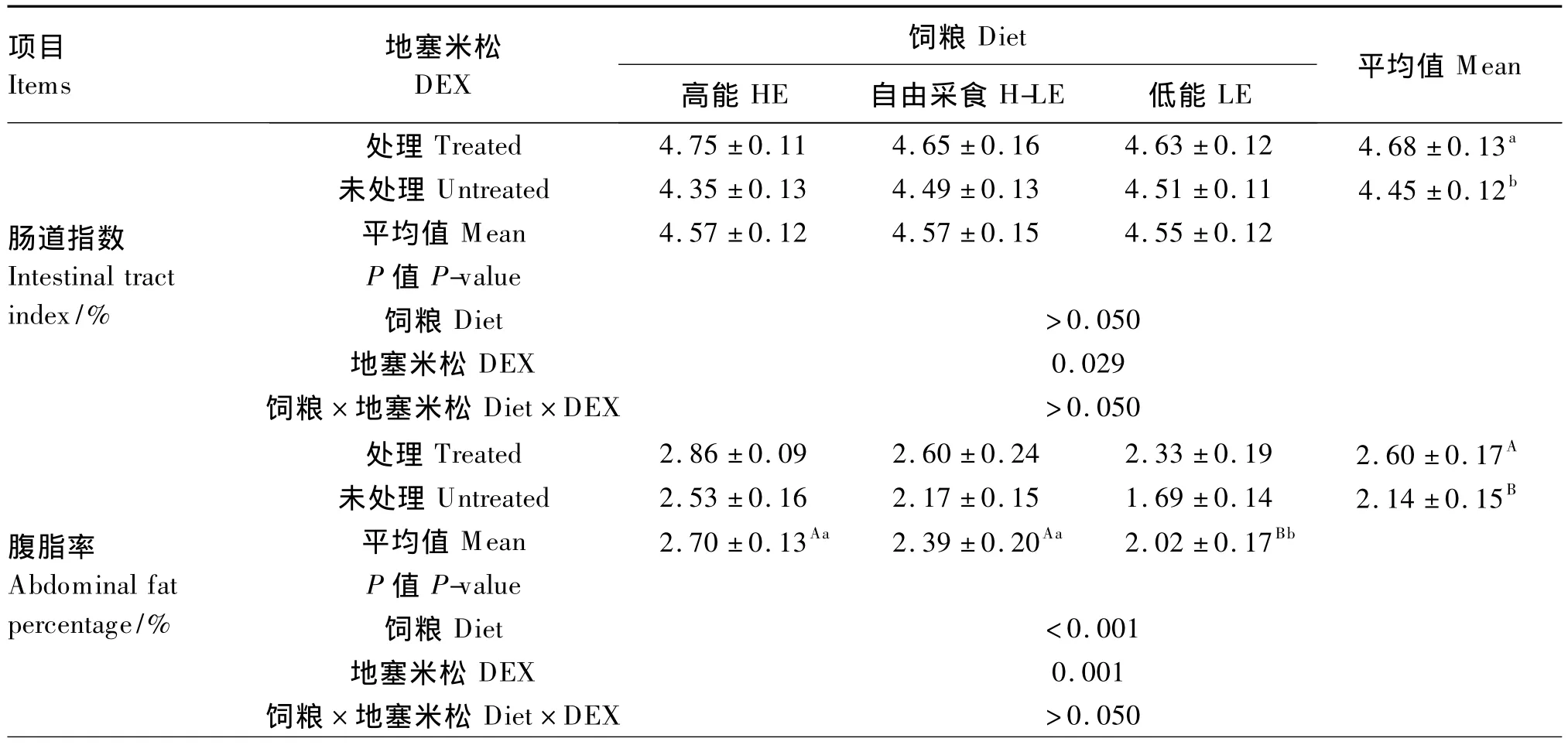
表4 DEX和饲粮能量水平对肉仔鸡肠道指数、腹脂率和下丘脑NPY基因表达量的影响Table 4 Effects of DEX and dietary energy level on intestinal tract index,abdominal fat percentage and gene expression level of NPY in the hypothalamus of broiler chickens

续表4
3.2 DEX和饲粮能量水平对能量采食的影响
机体通过控制采食量来调控机体的能量平衡,当应激或运动发生时,机体的能量消耗增加,采食量也随之增加,使得耗料增重比降低。用外源导入方式进行的研究已证实皮质酮可导致家禽体重和饲料利用率降低[15,18]。Bartov 等[19]研究发现高浓度的糖皮质激素会引起肉仔鸡负氮平衡,造成骨骼肌萎缩从而影响生长。Hayashi等[20]进一步研究发现糖皮质激素对肌肉生长的抑制作用归因于骨骼肌蛋白质合成率的降低或蛋白质降解率的增加,同样的结果也出现在本试验中,DEX处理的肉仔鸡体重不但不增加反而出现了降低的趋势。据报道,高水平的糖皮质激素可增强小鼠肠系膜区域的脂肪沉积[21]。本试验发现,DEX处理增强了肉仔鸡腹部脂肪沉积,这与前人的研究结果一致[18,22]。可能的解释是应激抑制了肌肉的发育并促进体内的脂肪沉积,从而表现为能量的分配由肌肉组织向脂肪组织转移,造成了能量的浪费,使能量利用效率和饲料利用效率显著降低。Elwinge等[23]已证明鸡脂肪沉积量受饲粮的影响。高脂肪饲粮引起的脂蛋白脂酶活性变化,具有组织特异性,能够提高脂肪组织脂蛋白脂酶的活性,并降低肌肉组织脂蛋白脂酶的活性,从而导致甘油三酯优先在脂肪组织沉积[24]。由此提示,HE饲粮可能会提高肉仔鸡脂肪组织脂蛋白脂酶的活性,从而促进肉仔鸡腹部等处的脂肪沉积,表现出耗能增重比低的现象。皮质酮处理后,家禽通过改变摄入食物类型或饲粮偏嗜性来试图缓解[25]。在哺乳动物上的研究显示,糖皮质激素可提高体内总能量的摄入量,并呈剂量关系;皮质酮处理使肾上腺切除后的小鼠采食更多的脂肪[26]。在本试验中,DEX、饲粮能量水平对采食量的影响无显著互作效应,但DEX注射下,动物对高能饲粮的采食量显著增加,与前人研究结果一致。
胃肠容积是哺乳动物和家禽采食量的一个限制因素[27],哺乳动物的食道、胃、小肠中均存在着牵张感受器,采食后能激活迷走神经,从而兴奋下丘脑饱感中枢,使动物停止采食。在本试验中,DEX对肠道指数的影响可能是因为DEX降低了体增重,或是DEX处理造成能量以脂肪形式储存,使机体对能量的需求增加,导致肠道的长度和重量增加以提高对营养物质和能量的摄取。
3.3 DEX和饲粮能量水平对下丘脑NPY基因表达量的影响
家禽的采食量是受多方面因素调控的,如体内一些激素(胰岛素和瘦素)、食欲因子(NPY、缩胆囊素和饥饿素等)、环境以及营养水平,这些信号在下丘脑的核团中进行整合,共同完成对摄食行为的调节[28]。糖皮质激素通过其受体参与采食和能量平衡的中枢调控[16]。有证据显示在NPY神经元上有糖皮质激素的受体,NPY的基因编码区上游也携带糖皮质激素的应答片段[29]。体外和体内研究结果表明,糖皮质激素能够激活NPY神经元的ARC-PVN路径,使NPY合成量增加,并对ARC神经元表达 NPY 受体起正调节作用[30-31]。糖皮质激素还可能直接影响NPY基因表达,从而增加NPY的合成。Shimizu等[32]通过体外试验发现糖皮质激素能增加下丘脑ARC中NPY的表达。在本试验中,DEX处理提高了肉仔鸡下丘脑NPY的表达量,但并没有达到显著水平,这可能是因为试验重复数太少,也可能是脑内的多耐药性糖蛋白作用,Meijer等[33]发现小鼠脑内的多耐药性糖蛋白能把进入脑内的DEX不断清除,这样对下丘脑食欲基因产生作用的DEX量减少,不足以引起NPY基因表达量的显著变化。但多耐药性糖蛋白在家禽中还未见有关报道,是否是多耐药性糖蛋白的作用结果还需进一步的研究。
另外,NPY也能感受能量信号,通过控制机体采食量,来协调动物采食量和能量的稳态平衡[32]。已有的研究对于高脂饲粮影响下丘脑NPY表达主要集中在哺乳动物上,结果并不一致。Giraudo等[34]研究发现,高脂饲粮降低了大鼠 ARC中NPY基因的表达;而Lin等[35]发现,饲喂1周高脂饲粮对大鼠下丘脑NPY基因表达的影响不显著。但在本试验中,肉仔鸡采食H-LE饲粮时下丘脑NPY基因表达显著增加,可能的解释是NPY对高脂饲粮的响应具有物种特异性,或是由于肉仔鸡可根据自己的需求而自由选择能量的采食,肉仔鸡体内的能量稳态处于一个相对稳定的动态过程,NPY感应到体内的能量状态,对HE或LE饲粮产生了食欲感。
4 结论
①DEX应激可使肉仔鸡血浆中葡萄糖、尿酸和甘油三酯的浓度升高。
②DEX应激和HE饲粮均能增加脂肪在腹部沉积,提高耗料增重比和耗能增重比。
③H-LE饲粮能上调肉仔鸡下丘脑NPY基因表达。
[1]孔雪.糖皮质激素调控家禽采食的机制[D].硕士学位论文.泰安:山东农业大学,2010:35-47.
[2]袁磊.应激对肉鸡采食量影响及其调节机制[D].硕士学位论文.泰安:山东农业大学,2007:31-45.
[3]姜克杰.应激和饲粮能量水平对肉鸡生长发育和脂肪代谢的影响[D].硕士学位论文.泰安:山东农业大学,2007:15-16.
[4]ZULKIFLIA I,SIEGE P B.Is there a positive side to stress?[J].World’s Poultry Science Journal,1995,51(1):63-76.
[5]FOUCAUD L,NIOT I,KANDA T,et al.Indirect dexamethasone down-regulation of the liver fatty acidbinding protein expression in rat liver[J].Biochimica et Biophysica Acta,1998,1391(2):204-212.
[6]QI D,PULINILKUNNIL T,AN D,et al.Singledose dexamethasone induces whole-body insulin resistance and alters both cardiac fatty acid and carbohydrate metabolism [J].Diabetes,2004,53(7):1790-1797.
[7]CAI Y,SONG Z,WANG X,et al.Dexamethasoneinduced hepatic lipogenesis is insulin dependent in chickens(Gallus gallus domesticus)[J].Stress,2011,14(3):273-281.
[8]CAI Y,SONG Z,ZHANG X,et al.Increased de novo lipogenesis in liver contributes to the augmented fat deposition in dexamethasone exposed broiler chickens(Gallus gallus domesticus)[J].Comparative Biochemistry and Physiology Part C:Toxicology&Pharmacology,2009,150(2):164-169.
[9]WANG X,LIN H,SONG Z,et al.Dexamethasone facilitates lipid accumulation and mild feed restriction improves fatty acids oxidation in skeletal muscle of broiler chicks(Gallus gallus domesticus)[J].Comparative Biochemistry and Physiology Part C:Toxicology&Pharmacology,2010,151(4):447-454.
[10]TOMASZUK A,SIMPSON C,WILLIAMS G.Neuropeptide Y,the hypothalamus and the regulation of energy homeostasis[J].Hormone Research in Paediatrics,1996,46(2):53-58.
[11]KALRA S P,HORVATH T L.Neuroendocrine interactions between galanin,opioids,and neuropeptide Y in the control of reproduction and appetite[J].Annals of the New York Academy of Sciences,1998,863(1):236-240.
[12]KOVACS K J,WESTPHAL H M,PECZELY P.Distribution of glucocorticoid receptor-like immunoreactivity in the brain,and its relation to CRF and ACTH immunoreactivity in the hypothalamus of the Japanese quail,coturnix coturnix japonica[J].Brain Research,1989,505(2):239-245.
[13]LIVAK K J,SEHMITTGEN T D.Analysis of relative gene expression data using rea1-time quantitative PCR and the 2‐ΔΔCtmethod[J].Methods,2001,25(4):402-408.
[14]HERMIER D.Lipoprotein metabolism and fattening in poultry[J].The Journal of Nutrition,1997,127(5):805S-808S.
[15]LIN H,DECUYPERE E,BUYSE J.Oxidative stress induced by corticosterone administration in broiler chickens(Gallus gallus domesticus):1.Chronic exposure[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2004,139(4):737-744.
[16]KITRAKI E,SOULIS G,GEROZISSIS K.Impaired neuroendocrine response to stress following a shortterm fat-enriched diet[J]. Neuroendocrinology,2004,79(6):338-345.
[17]MENCONI M,GONNELLA P,PETKOVA V,et al.Dexamethasone and corticosterone induce similar,but not identical,muscle wasting responses in cultured L6 and C2C12 myotubes[J].Journal of Cellular Biochemistry,2008,105(2):353-364.
[18]MALHEIROS R D,MORAES V M,COLLIN A,et al.Free diet selection by broilers as influenced by dietary macronutrient ratio and corticosterone supplementation.1.Diet selection,organ weights,and plasma metabolites[J].Poultry Science,2003,82(1):123-131.
[19]BARTOV I,JENSEN L S,VELTMANN,Jr.Effect of dietary protein and fat levels on fattening of corticosterone-injected broiler chicks[J].Poultry Science,1980,59(8):1864-1872.
[20]HAYASHI K,KAYALI A G,TOMITA Y.Reduction of corticosterone-induced growth impairment by testosterone and its mechanism[J].Journal of Animal Science and Technology,1992,63(10):1001 -1008.
[21]REBUFFE-SCRIVA M,WALSH U A,MCEWEN B,et al.Effect of chronic stress and exogenous glucocorticoids on regional fat distribution and metabolism[J].Physiology & Behavior,1992,52(3):583-590.
[22]LIN H,SUI S J,JIAO H C,et al.Impaired development of broiler chickens by stress mimicked by corticosterone exposure[J].Comparative Biochemistry and Physiology-Part A:Molecular&Integrative Physiology,2006,143(3):400-405.
[23]ELWINGER K.Performance and abdominal and carcass fat in broilers as influenced by strain and diet energy concentration[C]//Proceedings 6th European Poultry Conference. Hamburg: [s. n.],1980:256-263.
[24]MANTHA L,PALACIOS E,DESHAIES Y.Modulation of triglyceride metabolism by glucocorticoids in diet-induced obesity[J].American Journal of Physiology:Regulatory,Integrative and Comparative Physiology,1999,277(2):R455-R464.
[25]COVASAA M,FORBESA J M.Selection of foods by broiler chickens following corticosterone administration[J].British Poultry Science,1995,36(3):489-501.
[26]BLIGH M E,DOUGLASS L W,CASTONGUAY T W.Corticosterone modulation of dietary selection patterns[J].Physiology & Behavior,1993,53(5):975-982.
[27]DENBOW D M.Food intake control in birds[J].Neuroscience&Biobehavioral Reviews,1985,9(2):223-232.
[28]MAYER J,THOMAS D W.Regulation of food intake and obesity[J].Science,1967,156:328 -337.
[29]EDWARDS C M,ABBOTT C R,SUNTER D,et al. Cocaine-and amphetamine-regulated transcript,glucagon-like peptide-1 and corticotrophin releasing factor inhibit feeding via agouti-related protein independent pathways in the rat[J].Brain Research,2000,866(1/2):128-134.
[30]ZAKRZEWSKA J M,CHAUDHRY Z,NURMIKKO T J,et al.Lamotrigine(lamictal)in refractory trigeminal neuralgia:results from a double-blind placebo controlled crossover trial[J].Pain,1997,73(2):223-230.
[31]MATTERI R L.Overview of central targets for appetite regulation[J].Journal of Animal Science,2001,79(E-Suppl.):E148 - E158.
[32]SHIMIZU H,ARIMA H,OZAWA Y,et al.Glucocorticoids increase NPY gene expression in the arcuate nucleus by inhibiting mTOR signaling in rat hypothalamic organotypic cultures[J].Peptides,2010,31(1):145-149.
[33]MEIJER O C,DE LANGE E C,BREIMER D D,et al.Penetration of dexamethasone into brain glucocorticoid targets is enhanced in mdr1A P-glycoprotein knockout mice[J].Endocrinology,1998,139(4):1789-1793.
[34]GIRAUDO S Q,KOTZ C M,GRACE M K,et al.Rat hypothalamic NPY mRNA and brown fat uncoupling protein mRNA after high-carbohydrate or high-fat diets[J].American Journal of Physiology:Regulatory,Integrative and Comparative Physiology,1994,266:R1578-R1583.
[35]LIN S,STORLIEN L H,HUANG X F.Leptin receptor,NPY,POMC mRNA expression in the dietinduced obese mouse brain[J].Brain Research,2000,875:89-95.
