饲粮物理有效中性洗涤纤维和瘤胃可降解淀粉的平衡关系及其对奶牛瘤胃液pH和生产性能的影响
2012-06-06马燕芬王丽芳
马燕芬 王丽芳 高 民
(内蒙古农牧业科学院动物营养与饲料研究所,呼和浩特 010031)
保证饲粮物理有效中性洗涤纤维(physical effectiveness neutral detergent fiber,peNDF)的足量供给对于维持高产奶牛最佳瘤胃功能、降低代谢失调危害以及避免因纤维消化不足而引起的采食量、产奶量和乳营养成分下降等均具有重要作用。但是如果饲喂过量则会降低奶牛采食量,同时使瘤胃微生物蛋白的合成量降低,进而降低奶牛的饲料转化率[1]。对奶牛饲粮peNDF水平的评定到目前为止还是非常困难的,主要是由于peNDF水平取决于饲粮纤维含量、粗饲料粒度以及淀粉发酵能力等重要因素[2-3]。已有一些研究针对单一饲粮因素(如粗饲料粒度或粗饲料来源[4]、纤维水平[2]、谷物来源及其在瘤胃中有效降解率[5])对奶牛瘤胃内环境和产奶性能的影响,但是有关以上因素的相互作用影响奶牛瘤胃内环境和产奶性能的研究到目前为止还相当少。为降低饲粮对奶牛瘤胃失调的危害,寻找在不降低奶牛生产性能的前提下的最佳peNDF水平已势在必行。本文主要就饲粮peNDF和瘤胃可降解淀粉(ruminal degradable starch,RDS)的平衡关系及其对奶牛瘤胃液pH和生产性能的影响做一综述,以期为生产实践提供理论指导依据。
1 谷物饲料RDS、粗饲料peNDF及饲粮中二者的平衡关系
1.1 谷物饲料RDS
淀粉是高产奶牛最为重要的能量来源,也是合成瘤胃微生物蛋白的主要葡萄糖来源。Zebeli等[3]研究表明高产奶牛饲粮谷物中RDS含量为5.5% ~29.0%(干物质基础),RDS 摄入量为1.2~6.6 kg/d。不同研究所得的 RDS含量间的变化主要与谷物类型及所采用的加工处理方法有关。表1中总结了不同来源谷物采用多种加工处理方法得到饲料的淀粉有效降解率[6-7]。与玉米中淀粉相比,大麦、小麦胚乳中淀粉的慢速降解蛋白质较少,当对玉米谷物进行蒸汽压片(steamflaked)处理时,淀粉降解指数升高,而当对其进行蒸汽压轧(steam-rolled)处理时淀粉降解指数则下降。因此,不同加工处理方法主要通过改变淀粉颗粒糊化程度来改变淀粉降解程度。这对于玉米或高粱这类谷物饲料是非常重要的,主要因其淀粉更加具有抗性,而且淀粉的加工过程会提高糊化程度和降解程度。大麦或小麦谷物磨碎过细对奶牛瘤胃内环境、采食量和产奶量存在有潜在的危害,但是通过采用蒸汽压轧或干粗压轧(coarse dry rolled)处理后则可降低这种危害。Sadri等[8]研究表明大麦的加工处理方法对奶牛瘤胃状况和生产性能的影响与奶牛饲粮中淀粉的含量有关。Silveira等[9]研究表明在一定程度上,饲粮淀粉对瘤胃发酵和产奶量的影响归因于淀粉有效降解率。
瘤胃中淀粉降解率的变化还与反刍动物瘤胃中食糜流通率有关,当瘤胃、网胃中食糜滞留时间延长时,淀粉降解率尤其是不溶性淀粉降解率就会升高[7]。通过机械加工方法研磨(grinded)降低谷物粒度大小可提高淀粉在瘤胃中的降解率,这主要是由于增大了瘤胃中微生物接触淀粉的面积。包被方法也已证明对淀粉降解率有影响,磨碎(grounded)高湿玉米的淀粉有效降解率要高于磨碎的干玉米谷物。最近研究也已阐明淀粉降解率的其他变化来源,如Yang等[10]报道大麦在加工处理前后体积、质量上的变化可影响奶牛瘤胃淀粉降解率和生产性能,而McGregor等[11]并不完全支持该试验的结论,但支持加工处理前的谷物质量是需要重点考虑的因素之一。

表1 谷物来源及加工方法对瘤胃淀粉降解率的影响Table 1 Effects of sources and processing methods of grains on rumen starch degradability
1.2 粗饲料peNDF
粗饲料是全混合日粮(TMR)中peNDF的一个主要来源。Eastridge[12]研究表明通过增加奶牛饲粮中可降解纤维可提高粗饲料质量,进而改善奶牛生产性能(如采食量、能量采食量和产奶量),但不影响瘤胃功能。Zebeli等[3]表明增加粗饲料中可降解有机物质含量可提高粗饲料采食量,进而增加奶牛咀嚼和反刍时间,同时提高乳脂含量。因此,奶牛饲粮中添加优质粗饲料有助于维持能量摄入量,同时减少饲粮中精饲料比例,降低高产奶牛瘤胃失调的潜在危害,促进奶牛消化和提高产奶性能。世界上许多地区把玉米青贮和牧草青贮作为奶牛的主要粗饲料,他们的单独或混合的饲喂模式取决于地区、牧草的变化以及饲喂的目的不同,其中玉米青贮因具有高淀粉、高能量、优质青贮特性和相对较高的瘤胃可降解纤维以及饲喂后奶牛产奶量高等特性,是奶牛理想的粗饲料来源。牧草青贮生产费用相对低廉,营养价值也很高,也是TMR中一种重要的粗饲料来源。牧草青贮含有非常低的淀粉含量,但其粗蛋白质含量和细胞壁组成含量高。TMR中其他的粗饲料来源还有干草、苜蓿干草、高粱干草、燕麦青贮、大麦青贮和苜蓿青贮等,苜蓿青贮因其易降解的NDF(35% ~40%)、粗蛋白质(20% ~22%)和快速降解部分等的含量高,被认为是一种极好的粗饲料来源。
1.3 粗饲料粒度和peNDF的测定
由于粗饲料显著影响奶牛瘤胃功能和生产性能,因此在饲喂粗饲料时就需考虑粗饲料的营养品质。其中粗饲料粒度也影响其营养品质,一般切割较短(1~2 cm)的粗饲料对奶牛瘤胃消化可产生负面影响,为咀嚼活力和瘤胃收缩提供了较少的刺激,这在很大程度上将会降低瘤胃液pH,降低纤维消化能力、采食量和饲料转化率[4]。中等粒度(3~5 cm)的粗饲料可促进瘤胃消化,其主要原因是瘤胃内纤维分解菌的有效接触表面积的增加[13],有助于提高饲料采食量、增加高产奶牛的营养供应[1]。因此,适度的粗饲料粒度可提高TMR的均匀性[14],降低瘤胃失调所产生的一系列危害[15]。综上所述,适宜的粗饲料粒度对奶牛尤其是以TMR饲喂的奶牛的营养是非常重要的。
然而在实际生产中,对粗饲料或TMR的粒度进行测定是非常困难的。Tafaj等[4]研究表明在调查粗饲料粒度对高产奶牛瘤胃消化所产生的影响时,奶牛饲粮纤维尤其是粗饲料纤维所占RDS的比例、谷物粒度、加工处理方法以及饲料采食量等都应考虑在内。
宾夕法尼亚州立大学研究人员发明了一种评定粗饲料、TMR的碎片粒度的方法称为宾夕法尼亚州立大学的颗粒分级筛(penn state particle separator,PSPS)法[16-17]。PSPS 法可根据滞留在每个筛层和底盘上的饲料比例对饲料进行评价[17]。此外,PSPS法也能运用于评价TMR的分级损耗、混合程度和均匀度,也便于筛选出某些TMR中非营养的粗饲料组分[18]。
PSPS法可用于计算饲粮中peNDF含量。PSPS法原理是将3层筛子(孔径分别为19、8、1.18 mm)和底盘按孔径由大到小依次垂直排列,取约300 g鲜样置于最上层筛,筛子水平振荡40次(每个方向5次),振荡频率为1次/s或水平振荡距离大于17 cm。振荡过程中不允许出现垂直振动[18]。peNDF是指纤维的物理性质(主要是碎片大小),可以更精确预测瘤胃内的代谢状况,对促进瘤胃液固液相分层、刺激瘤胃蠕动以及刺激唾液分泌来中和瘤胃发酵产生的酸性物质有重要作用[19],同时 peNDF还可对化学 NDF和饲粮粒度碎片的信息进行整合[2-3]。饲料peNDF即为此饲料产品的NDF含量和物理有效因子(physical effectiveness factor,pef)的乘积,pef的范围在 0(NDF不能刺激咀嚼活动)和1(NDF最大刺激咀嚼活动)之间,其值大于等于某一孔径的各层筛上干物质含量之和[例如:pef1.18=(DM19mm+DM8mm+DM1.18mm)/100]。
计算peNDF主要有2个方法。方法一:滞留在PSPS的19和8 mm筛上干物质比例总和[16]、或计算滞留在19、8和1.18 mm筛上的干物质比例总和[17]乘以NDF含量分别得到 >8 mm层物理有效中性洗涤纤维(peNDF>8)、>1.18 mm 层物理有效中性洗涤纤维(peNDF>1.18);方法二:计算 滞 留 在 8(peNDF>8-NDF)和 1.18 mm(peNDF>1.18-NDF)筛上 NDF 碎片。后一个方法在表达TMR中peNDF含量时更加准确,因为充分考虑了不同粒度中NDF含量之间存在的差异。但是,鉴于以上2种方法都考虑到了饲粮peNDF含量[20],且 peNDF>8和 peNDF>1.18的计算更加实用、费用更加低廉,该方法在奶牛场中应用更为广泛。
运用计算 peNDF>1.18方法,估测到奶牛在自由采食TMR时,其中约有19%的饲粮干物质(4.1 kg/d peNDF>1.18或 6 g/kg BW peNDF>1.18)用于来维持瘤胃液 pH 在 6.0[3]。而 Mertens[2]也运用计算 peNDF>1.18方法,测出约有 22%的饲粮干物质(4.4 kg/d peNDF>1.18)是用来维持瘤胃液pH 在 6.0。Zebeli等[3]研究瘤胃液 pH 与饲粮peNDF>1.18关系时得出二者之间呈拟合(quasi)线性关系,运用数学渐进(asymptotic)函数得出瘤胃液pH与饲粮peNDF>1.18之间呈渐进关系,得出当饲粮 peNDF>1.18大约为 30% 时,瘤胃液 pH 可达6.2。
维持瘤胃正常功能所需求的peNDF的最佳含量主要取决于饲粮发酵特性,peNDF概念的缺陷之一是不能充分考虑各种饲料在瘤胃内发酵的差异,尤其是淀粉降解动力学。这将会导致瘤胃液pH对饲粮peNDF反映出不一致性,同时peNDF对瘤胃发酵和生产性能的影响也很难进行定量。因此,peNDF和奶牛饲粮中RDS含量的平衡关系也需要做出评价。
1.4 饲粮peNDF和RDS的平衡关系
饲粮peNDF与RDS的平衡可改变奶牛瘤胃发酵特性和生产性能。如Silveira等[9]研究表明peNDF可改变瘤胃液pH和生产性能,但当以可消化淀粉为来源时,以上影响是不明显的,表明可降解碳水化合物可提高奶牛对peNDF的需求。此外,Yang等[20]研究表明饲喂粒度较大的粗饲料可改变淀粉消化部位,如淀粉可从瘤胃进入到小肠进行消化,这样可降低奶牛瘤胃酸中毒的发生率。Zebeli等[19]研究表明饲粮中peNDF含量与瘤网胃外流体降解的碎片流通率之间呈正相关(r=0.5,P<0.001),表明当增加饲粮peNDF含量时,可加快瘤网胃降解瘤胃淀粉的流通率。但是,关于饲粮peNDF含量和小肠中最佳淀粉降解的转变程度之间的关系还需做进一步研究,以确定奶牛淀粉和饲料的最佳有效利用率。
为有效降低奶牛瘤胃酸中毒的发生、提高淀粉和饲料的利用率,在奶牛饲粮中提高过瘤胃淀粉量将会是一种有效的途径。但是,这在改变淀粉从瘤胃到小肠的降解率和提高葡萄糖代谢效率方面不是很有效,因为反刍动物小肠中降解淀粉的活性已被限制[5]。Matthe等[21]采用模型研究表明在饲粮中添加低于1.3 kg/d过瘤胃淀粉可避免淀粉降解率的降低。此外,淀粉在小肠中降解可提高泌乳奶牛葡萄糖供应,但如果这发生在瘤胃微生物蛋白合成的时期,将会提高后肠发酵程度及随后粪中微生物蛋白的损失。因此,增加葡萄糖供应最好的方法就是将最佳量的RDS结合限定量的过瘤胃淀粉,保证有足够量的丙酸在肝脏中转化为葡萄糖,并对纤维降解率和瘤胃功能不产生负面影响[6]。
近年采用的模型法得出TMR中约15%谷物源RDS可被作为评价瘤胃功能正常和消化率最佳的标准。但是,RDS含量是否还需进行校正取决于饲粮中peNDF含量。TMR中谷物适宜peNDF与RDS的比可作为于正确配制奶牛饲粮的参考。如表 1 中所示,提高 TMR 谷物中 peNDF>1.18与RDS的比可显著提高奶牛瘤胃内pH,但是此关系并不呈线性关系。此模型还表明TMR谷物中peNDF>1.18与 RDS 比的临界点为 1.45 ± 0.22 时可使瘤胃液 pH 维持在6.2,这与 Zebeli等[19]报道的均属于正常pH范围内。
就平衡饲粮中peNDF和可降解碳水化合物而言,TMR 中谷物 peNDF>1.18与 RDS 比的阈值可作为最佳值,可为配制奶牛健康饲粮提供参考,应极力避免此比例低于1.45。就实际生产中而言,达到最佳比例是非常困难的,只有以富含RDS的谷物(如大麦或小麦)饲粮为基础饲粮时才可以达到。
2 饲粮peNDF和RDS的平衡对奶牛瘤胃液pH和生产性能的影响
2.1 饲粮peNDF和RDS的平衡对瘤胃液pH的影响
饲粮成分在瘤胃内的发酵和降解效率是保证现代奶牛群体饲料利用率和生产性能的关键因素[12]。瘤胃液pH是瘤胃功能稳衡的重要因素,因为pH对瘤胃微生物区系、瘤胃发酵产物以及瘤胃生理功能等具有重要作用[22]。瘤胃液 pH在24 h内发生波动主要受采食碳水化合物的量影响[15,22]。
高产奶牛采食饲粮精饲料比例(干物质基础)>45%时,瘤胃液pH从早晨采食前的6.6变化到发酵期的 5.3或 5.0,平均 pH 在 6.0或6.2[15]。整个采食周期内的某一时间段 pH低于平均水平以下,pH低于安全值的这一段时间可造成瘤胃功能失调,并引发亚急性瘤胃酸中毒(SARA),SARA会降低奶牛纤维消化力、干物质采食量(DMI)、产奶量、饲料利用率,且易增加蹄叶炎和肝脂质代谢障碍的发生率,以及与此相关的全身性炎症反应。SARA会损害奶牛健康,由于纤维消化力和饲料利用率低下而使饲料费用增加,造成经济损失[1]。Zebeli等[19]研究得出了奶牛瘤胃液pH平均阈值、提高纤维降解和预防SARA出现的pH的持续时间。为确保瘤胃正常功能并预防SARA,高产奶牛日平均瘤胃液pH应低于6.16,低于5.8 的持续时间不应超过5.24 h/d。
表2总结了高产奶牛泌乳前、中期饲粮物理和化学特性对瘤胃发酵功能的影响。奶牛日平均瘤胃液pH与乳脂含量之间呈正相关关系,而瘤胃液pH维持在高于6.2(日常平均值)时可阻止高产奶牛乳脂含量的下降。当饲粮以苜蓿干草和磨碎玉米为基础饲粮时,奶牛日平均瘤胃液pH低于6.1;但当饲粮以玉米青贮(其淀粉含量要高于苜蓿干草)为基础饲粮时,peNDF>1.18含量提高到30% ~32%,瘤胃液pH高于6.16。当以玉米青贮为粗饲料、玉米为谷物来源时,得出与以上结论相似的结果。相反,当奶牛饲粮中添加大麦谷物时,瘤胃液 pH 则降低[9,24-25]。但是以上情况,当瘤胃液pH低于6.15时,通过增加饲粮中peNDF含量就会得以缓解。因此,以上结果证实了瘤胃液pH或奶牛SARA的发生主要取决于peNDF含量和谷物来源以及饲粮的发酵特性。
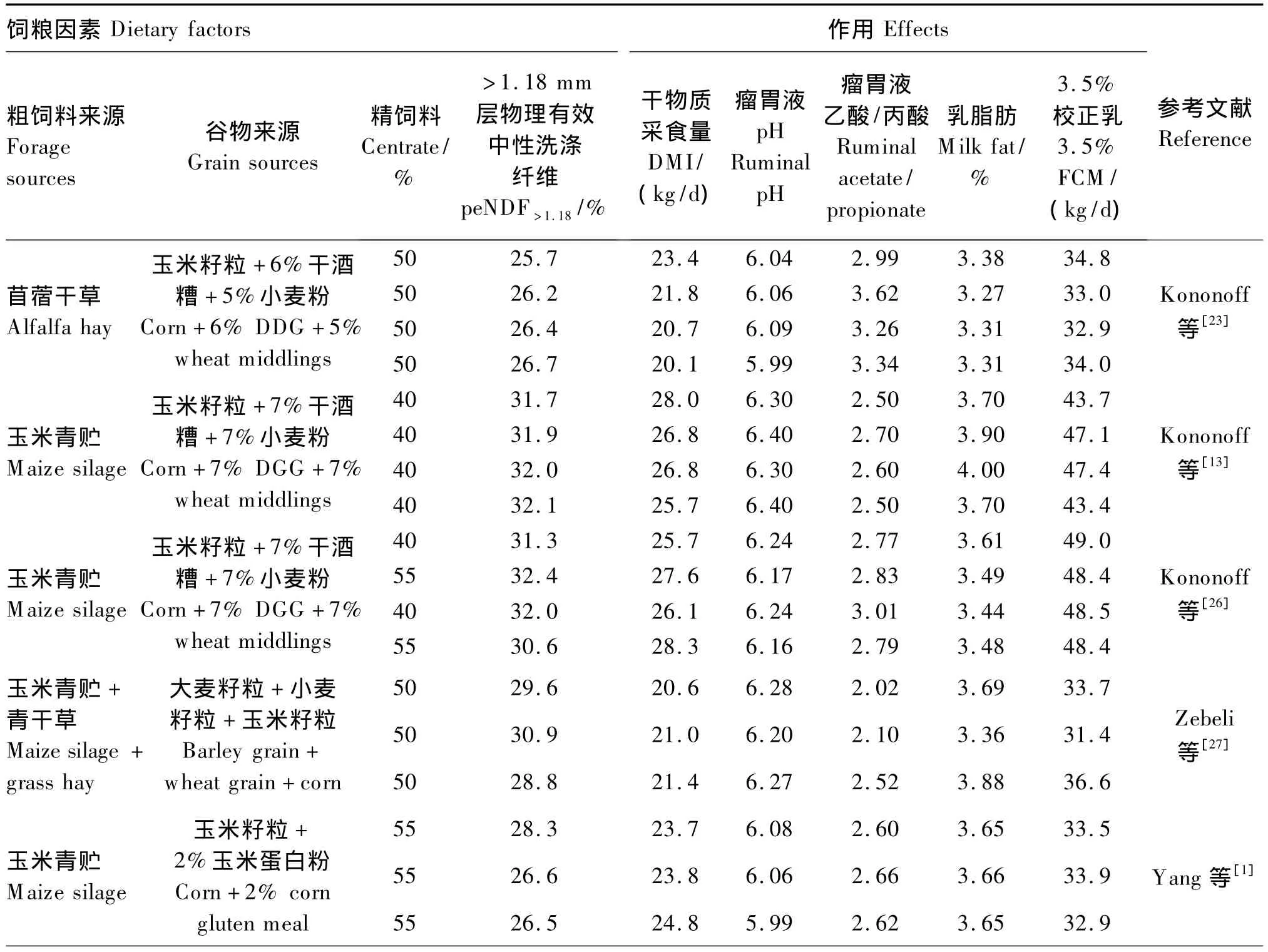
表2 不同饲粮因素对高产奶牛瘤胃发酵、采食量和乳脂产量的影响Table 2 Effects of different dietary factors on rumen fermentation,feed intake and milk fat production in high-producing dairy cow

续表2
2.2 饲粮peNDF和RDS的平衡对奶牛生产性能的影响
采食量的短期变化反映了谷物粒度大小和采食频率的变化,而粗饲料粒度[14]、精饲料水平及粗饲料来源[28]是影响谷物粒度大小和采食频率变化的主要因素。高采食量是高产奶牛保证产奶量和维持繁殖性能的必要条件。由表2可见,高产奶牛的 DMI范围在 20~28 kg/d之间。Allen[29]研究表明饲粮特殊的物理和化学特性可影响奶牛的DMI,包括饲粮纤维含量、淀粉和纤维降解酶、饲粮粒度、粒度碎片、青贮发酵物、脂肪浓度和特性以及瘤胃降解蛋白质,纤维质量尤其是纤维降解特性可刺激NDF在瘤胃中快速周转,进而促使奶牛采食更多的饲料。此外,NDF可运用于确定DMI的最高值和最低值,当瘤胃中饲粮NDF含量高时则会限制DMI,而当饲粮中NDF含量低时,通过能量采食量反馈作用就会促进DMI增加。
饲粮粒度或peNDF对高产奶牛DMI的影响已有广泛研究。因其物理填充效应(physical fill)产生的正效应,饲粮中低peNDF含量可增加奶牛DMI,但同时也提高了饲料发酵强度,有可能损坏瘤胃功能、降低 DMI。Allen[29]研究表明在低精饲料条件下,粗饲料对瘤胃产生的物理填充效应可限制奶牛的DMI。由表2可见,当奶牛饲粮中peNDF>1.18含量高时,奶牛以玉米青贮和玉米谷物为基础饲粮时DMI也相对较高;相反,当奶牛以粗饲料如苜蓿干草、青干草,谷物如大麦或小麦为基础饲粮时DMI则下降。泌乳后期通过饲喂奶牛以玉米谷物和经过干蒸馏谷物、粗饲料为苜蓿干草和玉米青贮(50∶50)的混合物的TMR为基础饲粮时,发现 DMI增加了 3 kg/d,尽管此时 peNDF>1.18含量仅提高了 2%[30]。Tafaj等[4]研究表明饲粮粒度对DMI的影响可能取决于粗饲料来源、精粗比及精饲料类型,尤其精饲料在瘤胃中的降解率,反映出他们对瘤胃功能和消化的影响。Silveira等[31]用小麦或大麦谷物替代TMR饲粮中玉米谷物,可降低泌乳早期和泌乳末期DMI 2 kg/d。但是当奶牛在不同的瘤胃降解阶段采食大麦谷物时并没有发现对 DMI产生不同的影响[8-9,11]。当用具有较高瘤胃降解特性和相对较低的peNDF特性的高湿玉米替代干玉米谷物时可降低DMI 2 kg/d,同时也表明了谷物来源和保护技术也是影响奶牛 DMI的重要因素[32]。
尽管饲粮中peNDF含量在维持最佳瘤胃微生态和促进瘤胃发酵效率方面是非常重要的,但饲粮中太多的peNDF反而对产奶量和饲料转化率产生负面影响[1]。由表 2 可见,TMR 中 peNDF>1.18含量高时并不会对产奶量和饲料转化率产生负面影响,例如:泌乳早期的研究结果表明饲喂30% ~32%的peNDF>1.18并不会对产奶量有副作用,尤其当以玉米青贮作为唯一粗饲料来源、低水平玉米谷物副产物作为精饲料混合物时。Silveira等[9]和Yang等[24-25]研究以快速降解大麦淀粉为基础,增加饲粮中 peNDF>1.18含量,结果表明由于 DMI下降而使产奶量下降,但是乳脂含量和产量上升,这主要是由于奶牛具有较好的瘤胃内环境和较高的乙酸/丙酸;增加饲粮中 peNDF>1.18含量,可提高3.5%校正乳脂、能量效率和饲料利用率。Zebeli等[27]和张赛等[33]报道,增加饲粮中 peNDF>1.18含量能提高产奶量和4%校正乳产量。Allen[29]认为在精饲料比例较高(>50%)的饲粮中,瘤胃微生物代谢对DMI的限制作用较饲料加工产生的物理效应更为重要。虽然DMI降低会影响产奶量,但张骞等[33]研究发现高水平 peNDF>1.18(36.96%)条件下产奶量和乳脂等乳成分含量较高。采食中等水平 peNDF>1.18(35.68%)饲粮奶牛乳脂、乳蛋白质和乳糖含量下降并导致乳总固形物含量随之发生相应变化,这可能由于苜蓿干草具有改善瘤胃微生物代谢和大颗粒苜蓿干草促进了咀嚼活动和唾液分泌,从而引起瘤胃液pH发生改变,使瘤胃发酵发生变化。因此,考察饲粮peNDF对产奶量尤其是对乳脂含量和乳能量效率的影响主要应研究对瘤胃功能和代谢的影响,提高瘤胃内代谢有助于提高乳脂合成。
乳脂含量和瘤胃发酵产物和功能有直接关系,乳脂含量常常作为衡量奶牛瘤胃健康和纤维充足的指标。根据DeBrabander等[34]的研究发现乳脂含量在1周内下降约0.6%可作为衡量奶牛饲粮中纤维不足的标准。通过对表2中7个研究所得的数据进行简单回归分析表明,高产奶牛饲粮中要求有足够的peNDF>1.18用以维持乳脂含量。Mertens[2]研究表明泌乳早期到泌乳中期的荷斯坦奶牛需要 20%(干物质基础)的 peNDF>1.18来维持3.4%的乳脂含量。但是最近研究结果表明即使peNDF>1.18含量为 23%[35]或 26%[23]时,乳脂含量仍低于3.4%,尤其当以玉米谷物或高湿玉米为基础饲粮时,谷物的发酵会增加peNDF的需求来维持乳脂含量。Silveira等[9]研究表明当以较高含量的大麦淀粉为基础饲粮时,29%peNDF>1.18对于维持3.4%乳脂含量是不足的,这与低日平均瘤胃液pH、乙酸/丙酸、丁酸比例有关。另外,当提高饲粮中 peNDF>1.18含量到 30% ~32% 时,所有研究均得出乳脂含量均超过3.4%的结论,而且不用考虑饲粮中的谷物来源。这表明饲粮peNDF>1.18和谷物降解淀粉由于对咀嚼活性和瘤胃代谢的影响而影响奶牛乳脂含量。Mertens[2]研究表明当奶牛采食peNDF不足会降低咀嚼活性、减少唾液分泌、降低瘤胃液pH、改变瘤胃发酵模式、降低瘤胃乙酸/丙酸等,这都将会最终改变动物代谢并降低乳脂含量。Zebeli等[3]通过回归分析发现奶牛乳脂含量与咀嚼活性呈正相关(R2=0.5)。根据这一分析,奶牛必须消耗足够的peNDF来获得687 min/d的咀嚼时间或30 min/kg的干物质摄入,从而保证生产出3.4%的乳脂。
3 小结
综上所述,饲粮中peNDF和RDS的平衡关系可影响奶牛瘤胃发酵和生产性能,当peNDF>1.18含量为 30% ~32%、peNDF>1.18与 RDS 比在 1.45 ±0.22时,可使奶牛日平均瘤胃液pH达6.2、降低SARA产生、预防乳脂含量下降,同时对DMI和产奶量不会产生负面影响。但是配方泌乳奶牛饲粮时,除要综合考虑奶牛饲粮中peNDF和RDS的平衡关系外,还要考虑奶牛饲料之间的组合效应、饲粮营养水平和比例以及饲粮在奶牛体内的降解情况等。
[1]YANG W Z,BEACHEMIN K A.Physically effec-tive fiber:method of determination and effects on chewing,ruminal acidosis,and digestion by dairy cows[J].Journal of Dairy Science,2006,89:2618 -2633.
[2]MERTENS D R.Creating a system for meeting the fiber requirements of dairy cows[J].Journal of Dairy Science,1997,80:1463-1481.
[3]ZEBELI Q,TAFAJ M,STEINGASS H,et al.Effects ofphysically effective fiberon digestive processes and milk fat content in early lactating dairy cow fed total mixed rations[J].Journal of Dairy Science,2006,89:651-668.
[4]TAFAJ M,ZEBELI Q,BAES C,et al.A meta-analysis examining effects of particle size of total mixed rations on intake,rumen digestion and milk production in high-yielding dairy cows in early lactation[J].Animal Feed Science Technology,2007,138:137-161.
[5]MATTHE A,LEBZIEN P,FLACHOWSKY G.On the relevance of bypass starch for glucose supply of high-producing dairy cows[J].Ubers Tierernahr,2000,28:1-64.
[6]FIRKINS J L,EASTRIDGE M L,ST-PIERRE N R,et al.Effect of grain processing on starch utilization by lactating dairy cattle[J].Journal of Animal Science,2001,79:218-238.
[7]OFFNER A,BACH A,SAUVANT D.Quantitative review of in situ starch degradation in the rumen[J].Animal Feed Science Technology,2003,106:81-93.
[8]SADRI H,GHORBANI G R,ALIKHANI M,et al.Ground,dry-rolled and steam-processed barley grain for midlactation Holstein cows[J].Animal Feed Science Technology,2007,138:195-204.
[9]SILVEIRA C,OBA M,BEAUCHEMIN K A,et al.Effect of grains differing in expected ruminal fermentability on the productivity of lactating dariy cows[J].Journal of Dairy Science,2007,90:2852-2859.
[10]YANG W Z,BEAUCHEMIN K A,RODE L M.Effect of barley grain processing on extent of digestion and milk production of lactating cows[J].Journal of Dairy Science,2000,83:554-568.
[11]MCGREGOR G,OBA M,DEHGHAN-BANADAKY M,et al.Extent of processing of barley grain did not affect productivity of lactating dairy cows[J].Animal Feed Science Technology,2007,138:272-284.
[12]EASTRIDGE M L.Major advances in applied dairy cattle nutrition[J].Journal of Dairy Science,2006,89:1311-1323.
[13]KONONOFF P J,HEINRICHS A J,BUCKMASTER D A.Modification of the Peen State forage and total mixed ration particle separator and the effect of moisture content on its measurements[J].Journal of Dairy Science,2003,86:1858-1863.
[14]ZEBELI Q,AMETAJ B N,JUNCK B,et al.Maize silage particle length modulates feeding patterns and milk composition in loose-housed lactating Holstein cows[J].Livestock Science,2009,134:33 -40.
[15]KRAUSE K M,OETZEL G R.Understanding and preventing ruminal acute acidosis in dairy herds[J].Animal Feed Science Technology,2006,126:215-236.
[16]LAMMERS B P,BUCKMASTER D R,HEINRICH A J.A simple method for the analysis of particle sizes of forage and total mixed rations[J].Journal of Dairy Science,1996,79:922-928.
[17]KONONOFF P J,HEINRICHS A J,LEHMAN H A.The effect of corn silage particle size on eating behaviour,chewing activities and rumen fermentation in lactating dairy cows[J].Journal of Dairy Science,2003,86:3343-3353.
[18]HEINRICH A J,BUCKMASTER D R,LAMMERS B P.Processing,mixing,and particle size reduction of forages for dairy cattle[J].Journal of Animal Science,1999,77:180-186.
[19]ZEBELI Q,DIJKSTRA J,TAFAJ M,et al.Modeling the adequacy of dietary fiber in dairy cows based on the responses of ruminal pH and milk fat production to composition of diets[J].Journal of Dairy Science,2008,91:2046-2066.
[20]YANG W Z,BEAUCHEMIN K A.Increasing effective fiber content of dairy cow diets may lower efficiency of feed use[J].Journal of Dairy Science,2006,89:2694-2704.
[21]MATTHE A,LEBZIEN P,HRIC I,et al.Effect of starch application into proximal duodenum of ruminants on starch digesbility in the small and total intestine[J].Archives of Animal Nutrition,2001,55:351-369.
[22]NARAGAJA T G,TIGEMEYER E C.Ruminal acidosis in beef cattle:the current microbiological and nutritional outlook[J].Journal of Dairy Science,2007,90:17-38.
[23]KONONOFF P J,HEINRICHS A J.The effect of corn silage particle size and cottonseed hulls on cows in early lactation[J].Journal of Dairy Science,2003,86:2438-2451.
[24]YANG W Z,BEAUCHEMIN K A.Altering physically effective fiber intake through forage proportion and particle length:chewing and ruminal pH[J].Journal of Dairy Science,2007,90:2826-2838.
[25]YANG W Z,BEAUCHEMIN K A.Altering physically effective fiber intake through forage proportion and particle length:digestion and milk production[J].Journal of Dairy Science,2007,90:3410-3421.
[26]KONONOFF P J,HEINRICHS A J.The effect of reducing alfalfa hay silage particle size on cows in early lactation[J].Journal of Dairy Science,2003,86:1445-1457.
[27]ZEBELI Q,TAFAJ M,JUNCK B,et al.Evaluation of the responses of ruminal fermentation and activities of nonstarch polysaccharide-degrading enzymes to particle length of corn silage in dairy cows[J].Journal of Dairy Science,2008,91:2388-2398.
[28]MAZZENGA A,GIANESELLA M,BRSCIC M,et al.Feeding behaviour,diet digesbility rumen fluid and metabolic parameters of beef cattle fed total mixed ration with a stepped subsituation of wheat straw with maize silage[J].Livestock Science,2009,122:16-23.
[29]ALLEN M S.Effect of short-term regulation of feed intake by lactating dairy cattle[J].Journal of Dairy Science,2000,83:1598-1624.
[30]KLERNSCHMIT D H,SCHINGORTHE D J,HIPPEN A R,et al.Dried distillers grains plus solubles with corn silage or alfalfa hay as the primary forage source in dairy cows[J].Journal of Dairy Science,2007,90:5587-5599.
[31]SILVEIRA C,OBA M,YANG W Z,et al.Selection of barley grains affects ruminal fermentation,starch digestibility,and productivity of lactating dairy cows[J].Journal of Dairy Science,2007,90:2860-2869.
[32]BRADFORD B J,ALLEN M S.Depression in feed intake by a highly fermentation diet is related to plasma insulin concentration and insulin response to glucose infusion[J].Journal of Dairy Science,2007,90:3838-3845.
[33]张骞,赵国琦,邬彩霞.peNDF水平对泌乳中后期奶牛产奶性能的影响[J].饲料工业,2010(9):33 -35.
[34]DEBRABANDER D L,DEBOEVER J L,VANACKER J M,et al.Evaluation of physical structure in dairy cattle nutrition[C]//Recent Advances in Animal Nutrition.Nottingham:Nottingham University Press,1999:111 -145.
[35]MERTENS D R.Role of effective fiber in reducing milk fat depression in lactating cows fed rumensim[J].Journal of Animal Science,2007,85:562.
