心肌缺血再灌注损伤的分子修复机制及其抑制剂的研究进展
2012-06-05欧阳越张景红
欧阳越 张景红,2
1.华侨大学分子药物学研究所,福建泉州 362021;2.华侨大学分子药物教育部工程研究中心,福建泉州 362021
OUYANG Yue1 ZHANG Jinghong1,2
1.Institute of Molecular Medicine,Huaqiao University,Quanzhou 362021,China;2.Molecular Medicine Engineering Research Center of Ministry of Education,Huaqiao University, Quanzhou 362021,China
1960年,Jennings等[1]首次提出了心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI)的概念,并把这种在心肌缺血基础上恢复血流后组织损伤加重、甚至发生不可逆损伤的现象称为心肌缺血再灌注损伤。如何减轻MIRI已成为防治缺血性心脏病和临床心脏病介入性治疗的一个重要课题。其发病机制可能与氧自由基、钙超载、炎症反应、细胞凋亡、蛋白激酶途径等有关[2-3],一些关键的调控分子包括细胞间粘附分子(intercellular adhesion molecule,ICAM)、一氧化氮合酶(NOS)、线粒体ATP敏感性钾通道(mitochondrial KATP channel,mitoKATP)和线粒体通透性转换孔(mitochondrial permeability transition pore,mPTP)等与其分子机制密切相关,目前研究的重点是通过激活再灌注损伤挽救激酶(reperfusion injury salvage kinase,RISK)途径、促进mitoKATP通道开放、抑制mPTP开放,从而减轻MIRI。近年来,新靶点层出不穷,围绕着这些新的靶点,新的药物抑制剂、小分子靶点抑制剂、中药单体抑制剂和中药复方抑制剂等也取得了长足的进展,并在实验动物模型上取得了一定的效果,现报道如下。
1 心肌缺血再灌注损伤的分子修复机制
1.1 抑制线粒体通透性转换孔的开放[4]
mPTP是位于线粒体内的一种非特异性通道,正常状态下和心肌缺血时,mPTP呈关闭状态并阻止小分子物质和水跨膜移动,在应激情况下其开放可导致水和溶质非选择性地进入线粒体内膜,使线粒体膜电位失衡,氧化磷酸化解偶联,导致ATP缺乏,线粒体肿胀和细胞死亡。许多研究证实在MIRI中,钙超载、氧化应激及各种信号级联通路最终都导致mPTP开放,使线粒体内膜间隙中的细胞色素C和凋亡诱导因子及释放到胞质中,从而启动细胞凋亡通路,导致心肌细胞凋亡。
1.2 激活线粒体ATP敏感性钾通道
心肌细胞中存在两种KATP通道,一种是位于线粒体上的线粒体KATP通道,另一种是位于心肌细胞表面的肌膜KATP通道。线粒体KATP通道开放剂能模拟缺血预处理所引起的心脏保护作用[5]。mitoKATP的开放一方面使线粒体膜去极化,降低线粒体外Ca2+内流的驱动力,减少Ca2+超载所引起的损伤,从而达到保护心肌缺血再灌注损伤的作用。另一方面mitoKATP的开放释放活性氧簇(ROS),增加NO释放量并激发链式激酶反应,使mitoKATP长时间保持开放状态,达到抑制MIRI的作用[6]。
1.3 激活RISK信号通路
如图1所示:Hausenloy等[7]首次将磷脂酰肌醇-3-激酶(phosphatidylinositol-3-OH linase,PI3K)和细胞外信号调节蛋白激酶(extra-cellular signal-regulated protein kinase,ERK)两个信号通路合称为再灌注损伤挽救激酶信号通路,即RISK信号通路。该通路的调控包括以下两个方面:(1)PI3K-Akt信号通路。当上游信号刺激细胞膜表面时,PI3K将胞外信号传递给下游的靶蛋白Akt,并激活Akt使其从胞膜释放进入细胞质,活化的Akt主要通过促进糖原合成激酶-3β(GSK-3β)磷酸化使其失活,磷酸化eNOS促进内源性NO生成并激活雷帕霉素(mTOR)及其下游的p70S6K,最终作用于线粒体和钾离子通道,减少mPTP开放和增加钾离子通道开放进而发挥保护MIRI的作用[8]。(2)ERK主要由Ras/Raf/MEK/ERK等构成,药物与细胞膜上的受体酪氨酸激酶结合后,将信号传递给Ras,Ras发生膜转位并激活Raf,活化的Raf通过磷酸化激活ERK。ERK通过激活mitoKATP促使线粒体ATP敏感性钾通道开放并增加活性氧ROS生成,ROS可激活线粒体ERK和PKC同工酶PKCε。同时ROS还可激活线粒体ERK,进一步激活核糖体蛋白S6激酶(p70S6K)从而发挥保护MIRI的作用。见图1。
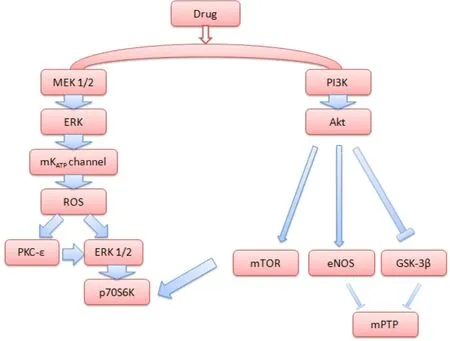
图1 药物通过RISK信号通路修复心肌缺血再灌注损伤的途径
2 心肌缺血再灌注损伤抑制剂的研究进展
目前,针对MIRI相关信号通路的靶点药物如表1所示。主要包括中药单体、中药复方、小分子抑制剂。其中小分子抑制剂的作用最为显著,但其缺点是作用靶点单一,且价格昂贵。而中药制剂可以通过调控GSK-3β、mTOR、PKC、mitoKATP、和mPTP等多靶点的调控作用修复MIRI。因此,从中药抑制剂中筛选MIRI信号通路相关的多靶点药物来修复MIRI将具有重要意义。下面对近年来发现的一些作用于MIRI相关靶点的抑制剂作一总结。
2.1 小分子靶点抑制剂
2.1.1 ATP敏感性钾通道开放剂和抑制剂 (1)线粒体ATP敏感性钾通道开放剂:尼克地尔(nicorandil,Nic)是目前唯一临床使用的有硝酸酯样作用的钾通道开放剂,一方面Nic通过激活线粒体KATP通道使线粒体内部去极化,降低线粒体的钙超载;另一方面激活KATP可抑制消耗细胞内ATP,减少释放乳酸脱氢酶并保存细胞内ATP,保护MIRI[20]。大量研究表明在心肌缺血初期,若给予激发线粒体ATP敏感性钾通道开放的药物(如吡那地尔、克罗卡林、二氮嗪),可减少梗死范围[21]。二氮嗪(diazoxide)是线粒体KATP通道特异性开放剂,mitoKATP通道开放伴随活性氧ROS生成的增加,可激活PKC,减少细胞凋亡,发挥保护MIRI的作用[22]。见图2。(2)心肌细胞膜ATP敏感性钾通道抑制剂:Vajda等[23]报道,与对照组相比,静脉注射选择性KATP抑制剂HMR1883的MIRI大鼠存活率显著提高。上述研究结果显示HMR1883(图2)对MIRI有一定抑制作用,但具体机制仍有待深入探讨。
2.1.2 mPTP抑制剂 Zhao等[24]发现环孢素A(cyclosporin A,CsA;图2)可阻止心肌缺血再灌注期间mPTP的开放。Xie等[25]将大鼠分为2组进行在体缺血再灌注,分别静脉注射给予CsA或空白溶剂,结果显示,相比于溶剂对照组,CsA组大鼠心肌梗死面积显著减少,提示CsA可能通过抑制mPTP的开放来保护MIRI,且证明mPTP在MIRI中起着至关重要的作用。
2.2 中药单体抑制剂
Yi等[26]证明人参总皂苷(TGS)在Langendorff离体大鼠心肌缺血再灌注损伤模型中,能通过激活PI3K/Akt-eNOS信号通路调控PI3K、p-Akt、和p-eNOS等靶蛋白的活性,增加大鼠心脏冠脉流量,从而修复MIRI。Wang等[27]也发现人参皂苷Rb1单体在大鼠心肌缺血再灌注损伤模型中可通过激活PI3K-Akt信号转导通路调控p-Akt的表达,改善大鼠心肌缺血再灌注损伤。人参皂苷Re为人参三醇类皂苷,最近的研究表明其能通过下调ICAM-1的表达改善大鼠MIRI[28]。见图2。
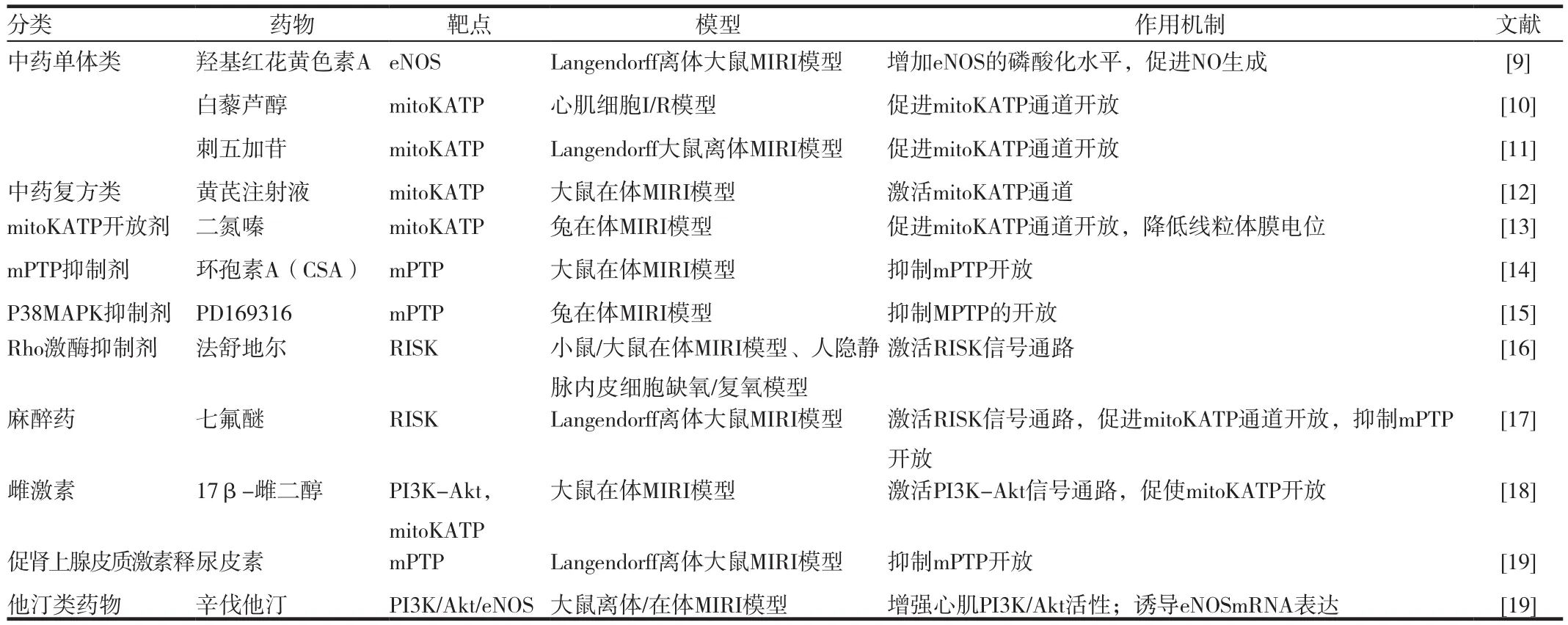
表1 MIRI相关靶点及其抑制剂
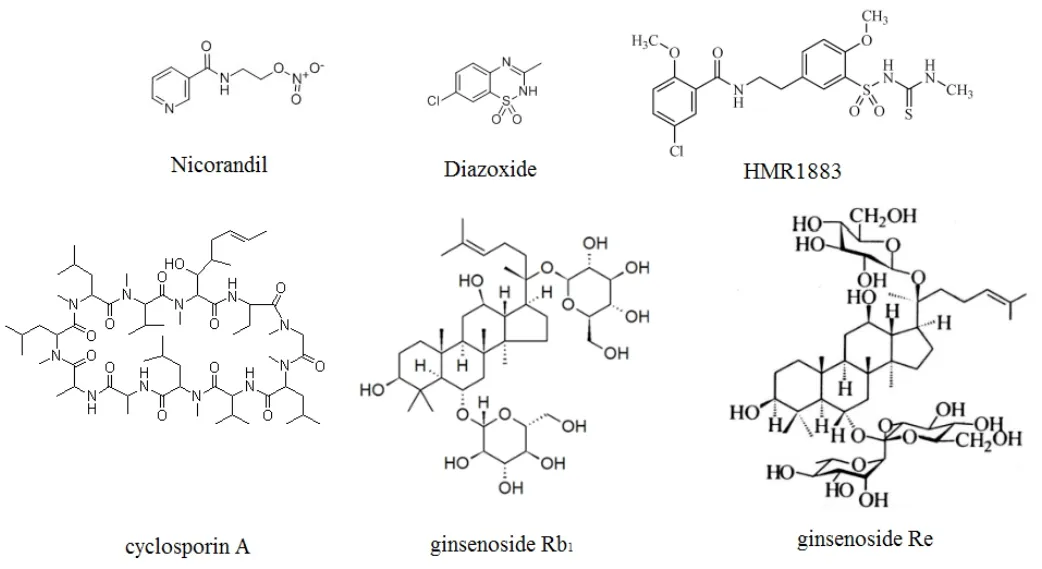
图2 部分MIRI抑制剂分子结构
2.3 中药复方抑制剂
关凤英等[12]的研究证实黄芪注射液能够改善心肌细胞再灌注损伤的细胞结构变化,减轻细胞损伤程度,对MIRI有一定的抑制作用,且线粒体ATP敏感钾通道抑制剂5-HD可减轻其对心肌损伤的保护作用,说明线粒体ATP敏感钾通道的激活可能是黄芪注射液修复MIRI的机制之一。
3 展望
综上所述,目前已对MIRI的分子机制进行了广泛研究,以其相关信号通路中的蛋白作为治疗靶点筛选各种抑制剂已成为新药研发的热点,也为MIRI的治疗提供了新思路。尽管已发现了一些针对MIRI相关靶点的抑制剂,并在MIRI的研究中取得了一定的进展,然而其作用靶点单一,且目前对其疗效、制剂、免疫抑制等方面仍存在许多问题,临床用药受到限制。因此,筛选多靶点、免疫抑制作用小的修复MIRI的药物成为迫切需要。而传统的天然药物抑制剂(中药单体和中药复方抑制剂)不仅对MIRI有很好的抑制作用,还兼有抗病毒,调节免疫和增强心功能等多方面的作用,同时具有副作用小、来源广泛、多靶点协同作用等优势。但目前已知的对MIRI具有良好药效的中药单体及中药复方尚少,因此仍需对MIRI的分子机制进行更深入、更广泛、更细致的研究,根据其相关作用靶点和作用途径开发有效的中药单体或中药复方制剂,为临床用药提供理论依据。
[1] Jennings RB,SommersHM,Smyth GA,et al.Myocardial necrosis induced by temporary occlusion of a coronary artery in the dog[J].Arch Pathol,1960,70:68-78.
[2] Yan Zhang,Fengxiang LV,Li Jin,et al. MG53 participates in ischaemic postconditioning through the RISK signalling pathway[J].Cardiovascular Research,2011,91:108-115
[3] Tetsuji M,Masaya T,Tatsuya S. Mitochondrial kinase signalling pathways in myocardial protection from ischaemia/reperfusion-induced necrosis[J].Cardiovascular Research,2010,88:7-15.
[4] Argaud L,Gateau-Roesch O,Muntean D,et al.Specific inhibition of the mitochondrial permeability transition prevents lethal reperfusion injury[J].J Mol Cell Cardiol,2005,38:367-374.
[5] O’Rourke B.Evidence for mitochondrial K+ channels and their role in cardioprotection[J].Circ Res,2004,94:420-432.
[6] Wang S,Con e J,Liu Y.Dual roles of mitochondrial KATP channels in diazoxide mediated protection in isolated rabbit hearts[J].Am J Physiol Hearts Circ Physiol,2001,280(1):246.
[7] Hausenloy DJ,Yellon DM.New directions for protecting the heart against ischaemia-reperfusion injury:targeting the reperfusion injury salvage kinase(RISK)pathway[J].Cardiovasc Res,2004,61(3):448-460.
[8] Feng J,Lucchinetti E,Ahuja P,et al.Isoflurane postconditioning prevents opening of the mitochondrial permeability transitionpore through inhibition of glycogen synthase kinase 3 beta[J].Anesthesiology,2005,103(5):987-995.
[9] 刘伊娜,朱健华,吴翔.羟基红花黄色素A对心肌缺血再灌注损伤的作用及其机制的探讨[J].交通医学,2009,23(5):482-487.
[10] 沈敏,王志鹏.白藜芦醇保护心肌细胞的信号转导途径研究[J].解放军药学学报,2010,26(6):475-477.
[11] 孔羽,徐峰,余振球.刺五加苷预适应对大鼠心肌缺血再灌注损伤的保护作用 [J].中国全科医学,2009,12(2B):292-294.
[12] 关凤英,李红,于秀霞.黄芪注射液预适应对大鼠实验性心肌缺血再灌注损伤的保护作用及其机制[J].中国老年学杂志,2010,11(30):3126-3129.
[13] Carreira RS,Facundo HTF,Kowaltowski AJ.Mitochodrial K+transport and cardiac protection during ischemia/reperfusion[J].Braz Jmed Biol Res,2005,38(3):345-352.
[14] 陈侠,沈小悔,李丈霞,等.环孢素A在老龄大鼠心肌缺血再灌注时的细胞保护作用机制探讨[J].中西医结合心脑血管病杂志,2009,7(6):682-683.
[15] Schwertz H,Carter JM,Abdudureheman M,et al.Myocardial ischemia/reperfusion causes VDAC phosphorylation which is reduced by cardioprotection with a p38MAP kinase inhibitor[J].Proteomics,2007,7(24):4579-4588.
[16] 杨兴艳.Rho激酶抑制剂保护心肌缺血再灌注损伤的研究[J].国际心血管病杂志,2010,37(2):68-71.
[17] 姚允泰,方能新,李立环,等.P13K、ERKl/2、mito-KATP通道及mPTP在七氟醚后处理减轻大鼠离体心脏缺血[J].中华麻醉学杂志,2009,29(10):915-921.
[18] 张志东,杨苏民.17β-雌二醇后处理对离体大鼠心肌缺血再灌注损伤的研究 [J].中国当代医药,2009,16(16):18-20.
[19] 欧袁,杨双强,辛东.Urocortin后处理抑制线粒体凋亡通路保护心肌缺血再灌注损伤[J].重庆医科大学学报,2010,35(8):1187-1190.
[20] Lu X,Liu LQ,Chen WN,et al.Effects of ischemic postconditioning and preconditioning induced by nicorandil on myocardial ischemia/reperfusion injury in isolated rat heart[J].Chin J Clin,2007,1(6):28-33.
[21] Penna C,Mancardi I,Rastaldo R,et a1.Intermittent activation of bradykinin B2 receptors and mitochondrial KATP channels trigger cardiac postconditioning through redox signaling[J].Cardiovasc Res,2007,75:168-177.
[22] Zatta AJ,Kin H,lee G,et al.Infarct -sparing effect of myocardial post conditioning is dependent on protein kinas C signaling[J].Cardiovasc Yasuda TRES,2006,70:315-324.
[23] Vajda S,Baczk I,Lepran I.Selective cardiac plasmamembrane KATP channel inhibition is defibrillatory and improves survival during acute myocardial ischemia and reperfusion[J].Eur J Pharmacol,2007,577(1):115-123.
[24] Zhao ZQ,Conrera JS,Halkos ME,et al.Inhibition of myocardial injury by ischemic postconditioning during reperfusion:comparison with ischemlc preconditioning[J].Am J Physiol Heart Cir Physiol,2003,285(2):579-588.
[25] Xie JR,Yu LN.Cardioprotective effects of cyclosporine A in an in vivo model of myocardial ischemia and reperfusion.Acta[J].Anaesthesiol Scand,2007,51(7):909-913.
[26] Yi XQ,Li T,Wang JR,et al.Total ginsenosides increase coronary perfusion flow in isolated rat hearts through activation of PI3K/Akt-eNOS signaling[J].Phytomedicine,2010,17(3):1006-1015.
[27] Wang Z,Li M,Wu WK,et al.Ginsenoside Rb1 preconditioning protects against myocardial infarction after regional ischemiaand reperfusion by activation of phosphatidylinositol-3-kinase signal transduction[J]. Cardiovasc Drugs Ther,2008,22(6):443-452.
[28] Jing L,Wang M,Zheng ZQ,et al.Ginsenoside Re downregulates ICAM-1 expression,inhibits polymorphonuclear infiltration,and ameliorates ischemiareperfusion injury[J].Med Chem Res,2010,19:962-969.
