腺病毒载体在小鼠肝脏的分布及其表达规律研究*
2012-06-04郭健文刘君慧叶华丽罗小平
王 鸣 郭健文 习 东 刘君慧 叶华丽 罗小平 宁 琴
近年来,随着基因治疗技术的兴起,暴发性肝炎的治疗多了新的选择。基因治疗是一种将外源性遗传物质导入目的器官、组织或细胞并显示出相应生物学效应,从而防治疾病的技术方法[1]。到目前为止,病毒载体在基因治疗中仍然是最有效的基因导入系统[2]。重组腺病毒作为基因治疗的重要载体之一,具有以下优点:(1)人类是腺病毒的天然宿主,所以比较安全[3];(2)宿主范围广泛,能将目的基因转移到分裂或静息的细胞中;(3)感染细胞时病毒DNA 不整合到宿主染色体中,潜在的致癌危险小;(4)外源基因表达水平较高,滴度高,在体外稳定,易于制备与纯化。尽管如此,腺病毒载体的安全性、靶向性及有效性依然是基因治疗中始终关注的问题。本研究探讨了5 型腺病毒载体介导的β-半乳糖苷酶(LacZ)报告基因(pAd/CMV/V5-GW/LacZ)在小鼠体内的分布和表达情况以及小鼠肝功能的变化情况,以评价腺病毒载体作为基因治疗转导系统的有效性及安全性,为进一步的目的基因导入及表达奠定基础。
材料与方法
一、实验动物与病毒株 SPF 级雌性Balb/cJ小鼠 24 只,6~8 周龄,体重 20±4g,购自湖北省实验动物研究中心。实验前随机将动物分为正常组和暴发性肝炎组。鼠Ⅲ型肝炎病毒(MHV-3)由加拿大多伦多大学Levy 教授馈赠。
二、细胞和腺病毒载体 293A 细胞培养于含10 %胎牛血清的 DMEM 培养基中;腺病毒载体pAd/CMV/V5-GW/LacZ 为 E1/E3 缺失型载体,购自Invitrogen 公司。
三、X-gal X-gal 购自 Imgenex 公司。1mg/mL X-gal 染液的配置方法为每5mL PBS 中,分别加入 164.665mg K3 Fe(CN)6(A)、211.195mg K4 Fe(CN)6·3H2O(B)和 MgCl2 475mg(C)。使用前取A、B 溶液各 100μL,C 溶液 2μL,X-gal 50μL(浓度为40mg/mL)混合,加 PBS 至终体积为2 mL。
四、病毒的包装、扩增和滴度滴定pAd/CMV/V5-GW/LacZ 载体经Pac1 酶切成线性,转染293A 细胞以包装出腺病毒颗粒。用感染复数(MOI)为3~5 的病毒量感染293A 细胞进行扩增,60h~72h 后待细胞完全出现病变时收获,反复冻融3 次,离心取上清,分装冻存于-70℃。病毒的滴度测定采用50%组织培养感染剂量法(TCID50法),即将病毒从10-3稀释至10-10,接种生长于96孔培养皿的293A 细胞,每个滴度接种10 孔,37℃培养3d,用X-gal 进行染色,计算病毒滴度为2×108PFU/ml。
五、暴发性肝炎小鼠模型的建立 暴发性肝炎Balb/cJ 小鼠于尾静脉注射腺病毒24h 后,腹腔注射100PFU MHV-3,在48h~96h 间出现暴发性肝炎表现。
六、尾静脉注射 18 只Balb/cJ 小鼠为正常组注射腺病毒载体,3 只用于暴发性肝衰竭小鼠模型的制备,并注射腺病毒载体,其余3 只未注射腺病毒载体作为对照(0h)。正常组小鼠尾静脉注射腺病毒(2×108PFU/只),并于尾静脉注射后的第24h、48h、72h、96h、120h、第 7 天随机取 3 只动物,取血检测谷丙转氨酶和总胆红素;颈椎脱臼处死动物后,分别取肝脏、心脏、肺、肾脏,置入液氮保存,冰冻切片,X-gal 染色后,显微镜下观察。确定腺病毒在体内的表达高峰在72 小时后,模型组小鼠在尾静脉注射腺病毒后24 小时腹腔注射100PFU 的MHV-3,以建立暴发性肝衰竭模型,并于72 小时取肝脏,液氮保存,冰冻切片,X-gal 染色后,显微镜下观察。
七、腺病毒载体转染效率的检测 在光镜下观察,并用Image-Pro Plus5.0 病理图文分析软件进行定量分析。转染率=(截面上蓝染细胞面积/所有细胞面积)×100%,取平均值。
结果
一、细胞形态学改变 293A 细胞感染大量腺病毒载体后均见细胞变圆,胞核增大,核着色加深,细胞脱落,呈葡萄串样改变,即所谓的细胞病理学效应(cell pathologic effect,CPE,图1)。
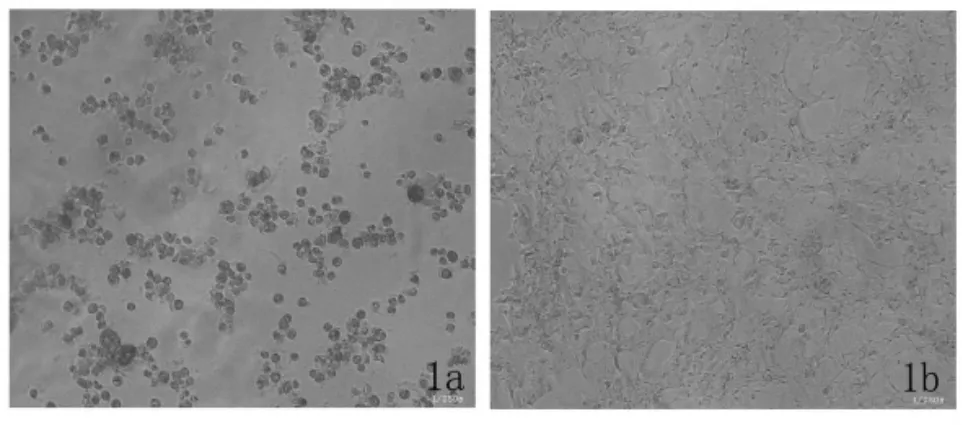
图1 细胞感染大量腺病毒载体后形态改变
二、腺病毒载体在正常小鼠不同脏器的分布 分别取小鼠的肝、心、肺、肾的冰冻切片进行X-gal 染色,光镜观察蓝绿色斑点为 LacZ 基因阳性表达的细胞群。结果显示,仅肝脏出现大量的蓝染的阳性细胞,并在第72 小时出现表达高峰,而在其他脏器未发现蓝染的阳性细胞。
三、腺病毒载体在正常小鼠肝脏表达的时间规律 在尾静脉注射腺病毒载体后不同时间,取小鼠肝脏冰冻切片进行 X-gal 染色。结果显示:β-半乳糖苷酶于腺病毒载体注射后的第24h 即开始在小鼠肝脏表达,第48 小时略有增加,第72h 出现表达高峰,约为55.7%,第96 小时表达显著下降,第120 小时仍有少量表达,第7 天基本检测不到目的蛋白的表达(图2)。
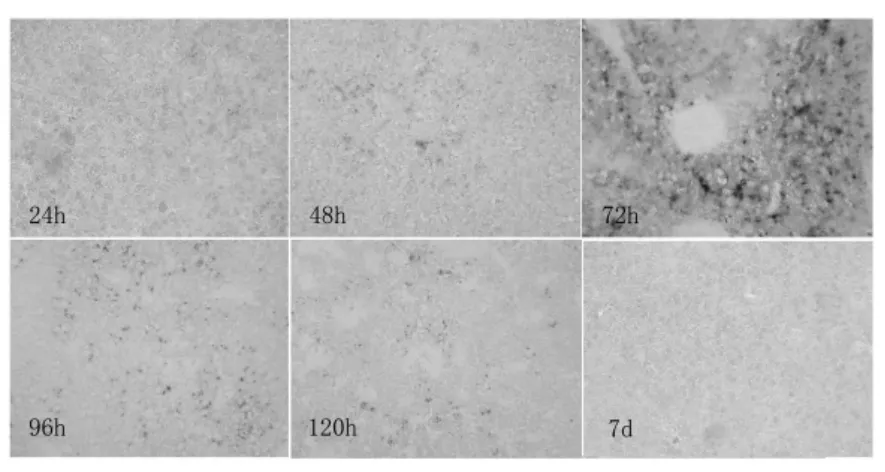
图2 腺病毒载体在正常小鼠肝脏表达的时间规律
四、腺病毒载体在暴发性肝炎小鼠肝脏的表达效率 造模组于尾静脉注射腺病毒载体后72h,取小鼠肝脏冰冻切片进行 X-gal 染色,结果显示β-半乳糖苷酶表达效率约为25.7%(图3)。
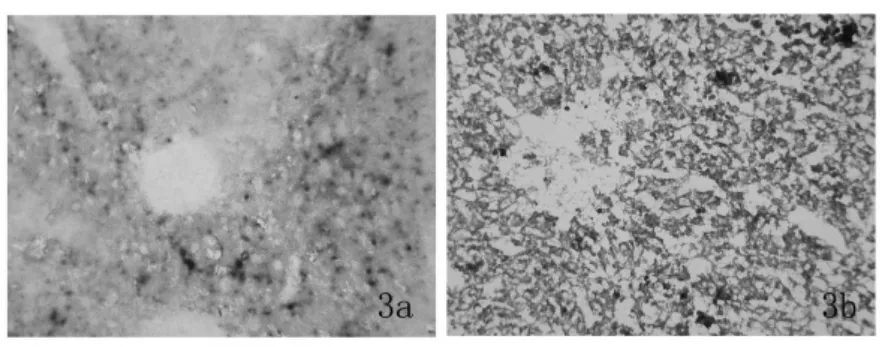
图3 腺病毒载体在暴发性肝炎小鼠肝脏的表达情况
五、腺病毒注射后对小鼠肝功能的影响 正常小鼠尾静脉注射腺病毒载体后,小鼠谷丙转氨酶和总胆红素无明显变化。
讨论
暴发性肝炎病情凶险,进展迅速,预后差,病死率可高达 80%~90%。近年来,对基因治疗研究的不断深入为其开辟了新的治疗途径。基因治疗是一种针对单基因和多基因遗传病、心血管疾病、恶性肿瘤和一些传染病的新的治疗模式,方法是将外源治疗基因导入靶细胞,使其在体内产生疗效。朱传龙等[4]用针对mfgl2 基因的反义质粒进行小鼠基因治疗实验,取得较好的效果,使暴发性肝炎小鼠的生存率提高了33.3%。基因治疗研究的内容包括:①目的基因的选择;②目的基因的克隆、测序、基因表达及其产物的功能特点研究;③目的基因转移传递系统的研究;④目的基因表达调控研究;⑤疗效及安全性研究[2]。其中,基因导入系统是基因治疗的核心技术,可分为病毒载体系统和非病毒载体系统。在临床试验中,病毒载体约占了70%,其中又以腺病毒和莫洛尼鼠白血病病毒(MoMLV)为主[5]。MoMLV 是一种逆转录病毒(retrovirus,RV),体内有效的基因治疗需要有足够高的感染率,大部分逆转录病毒载体都很难达到。因此,逆转录病毒载体更适用于体外转染[6]。现在最常用的是缺失了整个E1A 和部分 E1B 基因的 Ad2 及 Ad5 型腺病毒载体[7],两者在血清学分类上均属C 亚群,其对人的致病性主要表现为可以导致儿童上呼吸道感染,且症状通常是比较短暂而轻微的。腺病毒天然嗜上呼吸道上皮细胞,有研究利用腺病毒这一特性进行囊性纤维化的基因治疗[8,9]。重组腺病毒载体若直接注射到血液循环中,则主要靶向到肝细胞[10,11]。因此,对于肝脏疾病如暴发性肝衰竭的基因治疗可以首先考虑腺病毒载体。如果载体使用肝细胞特异性启动子,如白蛋白基因启动子,那么肝脏的转基因表达将更具严格的靶向性[12]。但是,腺病毒的免疫原性较强,可引起机体的免疫反应,并导致转基因表达效率下降[13,14]。同时,腺病毒本身还具有细胞毒性作用[15]。因此,使用腺病毒载体作为目的基因转移传递系统必须考虑其有效性及安全性。
本实验研究了腺病毒载体介导的β-半乳糖苷酶(LacZ)报告基因在正常小鼠及暴发性肝炎小鼠体内的分布及表达情况,并检测了小鼠肝功能的变化情况,以评价腺病毒载体作为基因治疗转导系统的有效性及安全性,为进一步的目的基因导入及表达奠定基础。不同的病毒载体在不同组织细胞的表达效率与该病毒受体的多少密切相关。腺病毒感染细胞的过程从腺病毒纤毛的头节区粘附到细胞表面的特异性受体开始。人腺病毒主要与柯萨奇B病毒共用一种受体,即柯萨奇/ 腺病毒受体(coxsackie/adenovirus receptor,CAR)[16]。CAR 分布广泛,且不同种属、组织的分布不同。在小鼠中,mCAR分布于心、肝、脑、肾、肺等,且在肝脏中表达量最高。而hCAR 在心脏和胰腺中表达最强,脑、小肠、睾丸、前列腺也有较高表达,肝脏、肺次之,而肾、外周血白细胞、胸腺和脾脏则未见表达[17]。CAR 介导的腺病毒进入靶细胞是基因转移中的限速步骤,并且转染效率与细胞表面 CAR 表达水平有关。虽然CAR 广泛分布导致腺病毒宿主范围广,但是从实验结果可以看出,腺病毒载体通过尾静脉注射到正常小鼠体内,主要在小鼠肝脏表达,在其他脏器基本无表达,这与上述Tomko 等[17]的研究是一致的。另外,用不同的给药方式,腺病毒载体的分布也不同。本实验通过尾静脉注射到小鼠循环系统,而且注射体积较多,可造成小鼠一过性的心力衰竭,使腺病毒载体更加主要的靶向到肝脏。因此,其他脏器未能检测到外源基因β-半乳糖苷酶的表达。在本实验中,腺病毒载体在正常小鼠和暴发性肝衰竭小鼠的肝脏表达效率可达55.7%和25.7%。因此,它可作为针对肝脏疾病基因治疗有效的基因转导系统来使用。
在基因治疗中,目的基因在体内的表达时间愈长,其治疗作用持续的时间亦愈长,疗效则愈加。因此,基因治疗中腺病毒载体的表达时限也是衡量其有效性的另一方面。本实验中,腺病毒载体所介导的报告基因在24h 即开始表达,并在72h 达到高峰,到120h 表达显著下降,第7 天已基本检测不到报告基因的表达。复制缺陷型腺病毒载体携带的目的基因在体内的表达随时间而减少,主要是因为重组腺病毒不能在体内自我复制,同时又不能将目的基因整合到染色体上,外源基因随着细胞分裂或死亡而消失。另外,腺病毒载体在体内表达的外源基因及自身蛋白可引起机体较强的免疫反应,使得腺病毒载体被机体的免疫系统所清除,导致目的基因在体内的表达时间缩短。Kagami 等[18]研究提示腺病毒载体所介导的基因在体内表达高峰在48h~72h,到第7~10 天表达显著下降,两周之后恢复到原来水平,与本实验结果基本一致。腺病毒载体介导目的基因的表达高峰出现较快,表达时间短暂,虽在基因治疗中需反复转导,但此特性亦有利于急性疾病如暴发性肝炎的基因治疗。
此外,本实验还检测了腺病毒载体注射到小鼠体内后小鼠肝功能的变化情况。实验结果表明,正常小鼠尾静脉注射腺病毒载体后,小鼠谷丙转氨酶和总胆红素无明显变化,腺病毒载体对肝脏无明显损害。腺病毒的免疫原性较强,可以诱导产生中和抗体,产生体液反应及强烈的细胞因子介导的炎症反应[13,14]。本实验未行这方面的检测,但是正常小鼠尾静脉注射腺病毒载体后,与未注射小鼠表现无异。因此,腺病毒载体可作为针对肝脏疾病基因治疗的安全基因转导系统。
[1]Anderson WF.Human gene therapy.Science,1992,256(5058):808-813.
[2]顾健人,曹雪涛.基因治疗.北京:科学出版社,2001:1-54.
[3]Castell JV,Hernandez D,Gomez-Foix AM,et al.Adenovirusmediated gene transfer into human hepatocytes:analysis of the biochemical functionality of transduced cells.Gene Ther,1997,4(5):455-464.
[4]Zhu C,Sun Y,Luo X,et al.Novel mfgl2 antisense plasmid inhibits murine fgl2 expression and ameliorates murine hepatitis virus type 3-induced fulminant hepatitis in BALB/cJ mice.Hum Gene Ther,2006,17(6):589-600.
[5]Edelstein ML,Abedi MR,Wixon J.Gene therapy clinical trials worldwide 1989-2004-an overview.J Gene Med,2004,6(6):597-602.
[6]曹明媚.基因治疗载体的研究进展.国外医学-肿瘤分册,2004,31(1):22-26.
[7]Seth P.Adenoviral vectors.Adv Exp Med Biol,2000,465:13-22.
[8]Rosenfeld MA,Yoshimura K,Trapnell BC,et al.In vivo transfer of the human cystic fibrosis transmembrane conductance regulator gene to the airway epithelium.Cell,1992,68(1):143-155.
[9]Zabner J,Couture LA,Gregory RJ,et al.Adenovirus-mediated gene transfer transiently corrects the chloride transport defect in nasal epithelia of patients with cystic fibrosis.Cell,1993,75(2):207-216.
[10]Stratford-Perricaudet LD,Levrero M,Chasse JF,et al.Evaluation of the transfer and expression in mice of an enzyme-encoding gene using a human adenovirus vector.Hum Gene Ther,1990,1(3):241-256.
[11]Haffe HA,Danel C,Longenecker G,et al.Adenovirus-mediated in vivo gene transfer and expression in normal rat liver.Nat Genet,1992,1(5):372-378.
[12]Pinkert CA,Ornitz DM,Brinster RL,et al.An albumin enhancer located 10 kb upstream functions along with its promoter to direct efficient,liver-specific expression in transgenic mice.Genes Dev,1987,1(3):268-276.
[13]Thomas CE,Ehrhardt A,Mark AK,et al.Progress and problems with the use of viral vectors for gene therapy.Nat Rev Genet,2003,4(5):346-358.
[14]Kafri T,Morgan D,Krahl T.Cellular immune response to adenoviral vector infected cells does not require de novo viral gene expression: implications for gene therapy.Proc Natl Acad Sci USA,1998,95(19):11377-11382.
[15]Young LS,Mautner V.The promise and potential hazards of adenovirus gene therapy.Gut,2001,48(5):733-736.
[16]Okegawa T,Pong RC,Li Y,et al.The mechanism of the growth-inhibitory effect of coxsackie and adenovirus receptor(CAR)on human bladder cancer:a functional analysis of car protein structure.Cancer Res,2001,61(17): 6592-6600.
[17]Tomko RP,Xu R,Philipson L.HCAR and MCAR: the human and mouse cellular receptors for subgroup C adenoviruses and group B coxsackieviruses.Proc Natl Acad Sci USA,1997,94(7):3352-3356.
[18]Kagami H,Atkinson JC,Michale SM,et al.Repetitive adenovirus administration to the parotid gland:role of immunological barriers and induction of oral tolerance.Hum Gene Ther,1998,9(3):305-313.
