木糖醇对猪精液低温保存的影响
2012-06-02杨杨
杨 杨
(江苏省句容市畜牧兽医站,句容 212400)
虽然猪精液保存技术的研究已有近50年的历史[1],但其保存效果很不理想。主要原因是低温保存和冷冻保存后精子活率、顶体完整率、受精能力等都比鲜精要差[2]。在精液低温保存的过程中,精子膜的完整性对复苏后精子的活力和受精能力是至关重要的。目前,国内外已有报道,在牛、羊的冻精稀释液中添加糖类、氨基酸和牛血清白蛋白能保护精子质膜的稳定性[3-6]。
甘油和糖类是常用的冷冻保护剂,一般甘油限制在1%~3%为宜[7]。在猪精液,冷冻稀释液中多加有甘油等抗冻物质,以增强精子抗冻能力,对防止冰晶发生有重要作用。但甘油浓度过高对精子有毒害作用,造成精子顶体和颈部损伤,尾部弯曲等。对猪精子来说,当甘油浓度增大时,冷冻精液,活率虽高,但受胎率极不理想。由于多数糖类能被细胞分解代谢。因此,常使用糖类代替部分甘油,以减少对精子的毒害作用,这方面已有不少报道[1,12,15],但仅利用双糖(乳糖和蔗糖)代替甘油的研究还未见报道。
双糖包括多种,如乳糖、蔗糖、海藻糖、麦芽糖、纤维二糖等。本实验主要研究木糖醇的添加量。即猪精液冷冻稀释液中单独添加不同浓度的乳糖或蔗糖,以及添加不同比例的乳糖和蔗糖代替部分甘油对颗粒冻精冻后活率,活力,顶体完整率和精子畸形率的影响。
手握法采集成年长白种公猪精液,离心去精清,收集富含精子的部分,在精液稀释液中加入不同浓度的木糖醇和甘油,采用液氮熏蒸法制作颗粒冻精。在40℃~45℃下解冻观察。
1 材料与方法
1.1 实验动物
体质健康、性欲旺盛的成年长白种公猪1头,18月龄。
1.2 实验设备
电热恒温水浴锅、隔水式电热恒温培养箱、电动离心机、生物显微镜、恒温载物台、电子天平、冰箱、聚四氟乙烯板、超低温温度计、双重水自动蒸发仪。
1.3 稀释液的配制
电子天平准确称量各种试剂后,用双蒸水定容、过滤、灭菌,配制成Ⅰ液。采精前,按比例配成Ⅱ液,置于35°C水浴中预热。其各种物质含量如下所示:
Ⅰ液:葡萄糖8 g;蒸馏水 100 ml。
Ⅱ液:取Ⅰ液77 ml,加入卵黄20 ml,青霉素和链霉素各5~10万U。
最后向Ⅱ液加入不同浓度的蔗糖、乳糖即为所用的冷冻稀释液。其添加量详见表1、表2。

表1 在稀释液中单独乳糖和蔗糖的含量(g/100 ml)
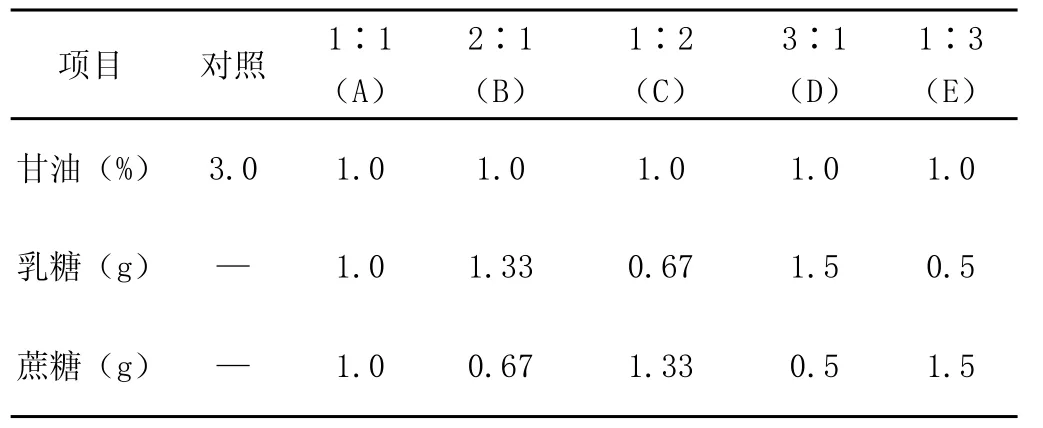
表2 在稀释液中按不同比例添加乳糖与蔗糖(g/100 ml)
1.4 精液采集
采精前将集精杯预热至35 ℃~37℃,以发情母猪诱导成年公猪爬跨。待公猪阴茎伸出后,用手握法采精。采精后选择中段浓份精液用4层纱布过滤,除去胶状物后,在37℃下进行常规品质检查。选择无异味、色泽为乳白色、精子形态正常、活率在0.7以上的精液用于实验。
1.5 精液的预处理
将合格精液在保温壶中(32℃~35℃)中静置60~80min,使精子和精清充分接触,然后经800 r/min离心10 min,弃去上部精清的4/5。为防止长时间静置使猪精子进入假死状态,离心前应轻轻晃动集精瓶数次,以使精子恢复活力。
1.6 精液的稀释与平衡
采用二次稀释法,先将Ⅰ液按1∶1的比例缓慢倒入精液中进行等温稀释(32℃~35 ℃)后,再用12~15层纱布包裹集精瓶,连同Ⅱ液一起放入2℃~5 ℃冰箱中平衡2 h,然后加入与第一次稀释后精液总量相等的Ⅱ液,使精液最终稀释比例为1:3,继续平衡1~2 h备用。
1.7 低温精液的制作
低温保存的温度是0℃~5℃。一般将稀释好的精液置于冰箱或广口保温瓶中,在保存期间要保持温度恒定,不可过高过低。操作时注意严格遵守逐步降温的操作规程,原则上精液稀释后,要逐渐降温到0℃~5℃,避免精子发生冷休克。所以一般要用平均每30 min降低5℃的速度降温,即下降速度约为0.2℃/min。在生产实践中,为了提高工作效率,都采用直接降温法。即将分装有稀释精液的试管(或小瓶),包以数层纱布或棉花,再装入塑料袋中,而后直接放入冰箱(0℃~5℃)或装有冰块的广口保温瓶中,也可将其放入30℃温水(室温)杯中,再一起直接放入0℃~5℃的环境中,经1~2 h。精液温度降至0℃~5℃。
1.8 解冻与镜检
颗粒冻精采用干解冻法,将颗粒冻精放入灭菌试管内,用40℃~45℃温水解冻(时间为8~10s),在37℃恒温载物台上,400~600倍生物显微镜下评定活率,顶体完整率,精子畸形率等指标。
1.9 数据处理
按统计学方法处理各组数据。
2 结果与分析
2.1 添加木糖醇和甘油对猪精液在室温下活率的影响
选取不同比例的乳糖或蔗糖,加入稀释液中制成颗粒冻精,结果如图1所示。
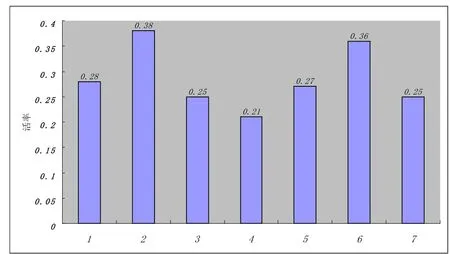
图1 稀释液中单独添加乳糖或蔗糖时的活率
由图1可知,1号、5号的活率最好,显著高于其他组(P<0.05)。即在稀释液中添加1%的乳糖效果最好(P<0.05),在添加蔗糖时以2%的比例最佳(P<0.05),而添加1%的乳糖又较添加2%的蔗糖好(P<0.05)。从总体来看,添加乳糖比添加蔗糖的效果好。
2.2 单独添加木糖醇对猪精液室温下活率的影响
在稀释液中按比例单独添加乳糖或蔗糖,以替代不同浓度的甘油。结果详见表3。
从表3可以看出,精子畸形率检测中1号、2号明显优于其他(P<0.05)。4号及6号顶体完整率与对照组比较差异显著(P<0.05)。
2.3 添加木糖醇和甘油对猪精液5度下活率的影响
选取5种不同比例的乳糖与蔗糖的稀释液(乳糖:蔗糖),替代部分甘油,制成颗粒冻精解冻后的精子活率结果如图2所示。
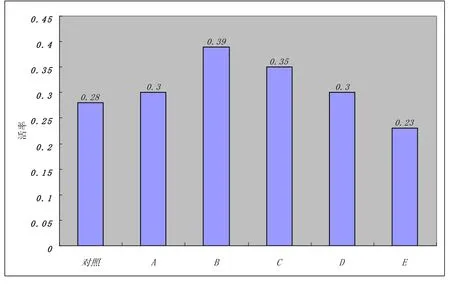
图2 同时添加乳糖和蔗糖时精子的活率
由图2可知,B组、C组的活率较好,分别达到0.39,0.35且与其他组差异显著(P<0.05)。
2.4 不添加甘油对猪精液5度下活率的影响
选取5种不同比例的乳糖与蔗糖的稀释液(乳糖:蔗糖),替代部分甘油,结果详见表4。
从表4可以看出,精子畸形率A、B组差异显著(P<0.05)。而B、C组的顶体完整率较好,且差异显著(P<0.05)。
3 讨论
3.1 单独添加乳糖或蔗糖对猪精液冻后活率的影响
关于猪冻精稀释液成分多种多样,但使用最多的还是糖类。目前,国内外已有报道,糖类、氨基酸和牛血清白蛋白通过对质膜的稳定,发挥其对精子的保护作用[3-6]。牧人等[1]研究了蔗糖等对白绒山羊冷冻精液的影响,褚仁忠等[8]也研究了糖类保护剂对山羊冻精的影响,结果都表明在羊上糖类对冷冻精液有较好的保护作用。在猪上也有较多的关于糖类稀释液的研究,李青旺等[9]对添加不同量的葡萄糖,蔗糖,乳糖的稀释液作了详尽的研究,结果表明低浓度的乳糖与葡萄糖混合使用可取得较好的效果,猪精液冻后活率可达0.53。而且李震钟等[10]研究也表明,在猪冻精稀释液中添加2%~4%的葡萄糖效果较好,浓度过高对精子顶体就会有损害。本实验表明,稀释液中添加1%乳糖时,精子活率较高(P<0.05),说明乳糖可以代替部分的甘油,以1%为宜。稀释液中添加2%蔗糖时,精子活率比对照组的活率高(P<0.05),说明蔗糖也可代替部分的甘油,以2%为宜。从添加乳糖和添加蔗糖对照来看,添加乳糖的颗粒冻精活率较添加蔗糖的活率高。说明乳糖比蔗糖更适宜代替部分甘油。这与Paulenz等[11]研究结论相似。
3.2 单独添加乳糖或蔗糖对猪精液冻后精子畸形率,顶体完整率的影响
本实验表明,2号、3号颗粒冻精的精子畸形率明显较低。说明一定量的乳糖(1%~2%)对精子具有保护作用。减少了由甘油引起的精子顶体和颈部的损伤及尾部弯曲等。而5、7号顶体完整率较好,说明添加一定量的蔗糖可以减少精子顶体的损伤,对精子具有一定的保护作用。
3.3 同时添加乳糖和蔗糖对猪精液冻后活率的影响
本实验表明,当稀释液中乳糖与蔗糖比例为2∶1时,颗粒冻精的活率最好,为0.39,差异显著(P<0.05)。当乳糖与蔗糖比例为1∶2时,颗粒冻精的活率为0.35,差异显著(P<0.05)。当这2者进行比较,比例为2∶1时的活率明显优于1∶2(P<0.05)。从总体来看,混合添加乳糖与蔗糖的效果优于单独添加的效果。

表3 稀释液中单独添加乳糖或蔗糖的结果(%)

表4 同时添加乳糖和蔗糖对猪精液冻后精子畸形率及顶体完整率的影响(%)
3.4 同时添加乳糖和蔗糖对猪精液冻后精子畸形率及顶体完整率的影响
实验表明,当稀释液中乳糖与蔗糖比例为2∶1或1∶2时,顶体完整率明显上升,并且差异显著(P<0.05),说明当稀释液中乳糖与蔗糖比例为2∶1或1∶2时对精子顶体有一定的保护作用。可以看出,2种双糖对精子都有一定的保护作用,但乳糖较蔗糖要好一些,所以当乳糖比例较高时,精子活率,顶体完整率都较好一些。
目前,各种家畜冷冻精液的稀释液一般都含有糖类和甘油,但并没有一个明确的最佳添加量。尤其是甘油,已证实,冷冻稀释液中添加棉籽糖、蔗糖、等类物质,以及甘油、乙二醇、缓冲剂、乙二胺四乙酸二钠(EDTA)及可可碱和萘类物质对公猪精液的冷冻保存均有帮助但在所筛选的各种动物精子冷冻保护液毫无例外的都保留有甘油,研究表明,甘油的冷冻保护效果在高浓度时效果最明显,然而当甘油浓度高于0.5 ml/L(≈9.2%)时对精子是有害的[12-14]。本实验研究中甘油添加量并没有一个确定的量,在添加乳糖时,甘油的添加量为2%时效果最好,这与周佳勃等[15],李青旺等[9]的研究结果相似。但在添加蔗糖中甘油的添加量为1%时效果较其他的要好,综合来看这应与糖的种类和添加量有关。这还有待进一步研究。
4 结论
4.1 稀释液中添加1%和2%乳糖时,精子畸形率较低,分别为7.1%和8.6%(P<0.05)。添加1%及3%蔗糖时顶体完整率较好,分别为86.7%和86.8%(P<0.05)。
4.2 稀释液中添加1%乳糖时,活率为0.38差异显著(P<0.05)。稀释液中添加2%蔗糖时,活率为0.36差异显著(P<0.05)。
4.3 当稀释液中乳糖与蔗糖比例为2∶1或1∶2时,顶体完整率为88.2%及88%差异显著(P<0.05)。
4.4 稀释液中乳糖与蔗糖以2:1及1:2的比例添加时,活率最好,分别为0.39和0.36差异显著(P<0.05)。
[1]Polge C.Artifivial insemination in pigs[J].Vet Pec,1956,(68):62-76
[2]藤钟秀,刘建.保存温度和不同种类稀释液对猪精液品质的影响[J].兽医大学学报.1991,(12):387-391
[3]牧人,张锁链,王建国,等.蔗糖、牛血清白蛋白和锌离子对白绒山羊精液冷冻效果的影响[J].畜牧兽医学报.1997,28(2):120-125
[4]DeleevwFEetal.Effectsofvariouscryoprotectiveagentsandmembrancesta bilizingcompoundsonb ullspermmembraneintegrityaftercollingandfreezi ng.Cryobiology,1993,(30):12-16
[5]ChenYetal.Effectofsucrose,trehalose,hypotaurine,taurine,and bloodserumonsurvivaloffrozenb ullsperm.Cryobiology,1993,30:423-431
[6]AbdelhakeamAAetal.Studiesontheabseceofglycerolinunfrozenandfrozen ramsemen.Cryobiolo-gy,1991,78:43-49
[7]李青旺,武浩.动物繁殖学[M].西安 西安地图出版社[M]2000,184-214
[8]褚仁忠,孟庆栓.山羊冷冻精液糖类保护剂的实验效果[J].黑龙江畜牧兽医.2004,(12):33-36
[9]李青旺,王立强,于永生,等.猪精液冷冻技术研究[J].畜牧兽医学报.2004,35(2),150-153
[10]李震钟,杨学时,冯健超,等.家畜繁殖进展[M]。重庆技术文献出版社重庆分社,1976
[11]Paulenz H,Taugbol O.Effect of dietary supplementation with cod liver oil on cold shock and freezability of boar semen[J].Reprod-domestanim,1999,34(5):431-435
[12]刘玉堂.精液冷冻保存的影响因素分析[J].黑龙江动物繁殖.2003,11(2),10-14
[13]武英,傅成典.猪精液冷冻稀释液配方的筛选[J].农业科学.1992,(2):12-15
[14]刘学剑.猪的精液冷冻技术研究进展[J].四川畜禽.1994,(4):13-14
[15]周佳勃,岳奎忠,孙兴参,等.猪精液冷冻技术研究[J].中国畜牧杂志.1999,(4):28-32
