SPIO标记兔BMSCs的生物学特性与体外MRI显像研究*
2012-06-02中山大学附属第一医院放射科广东中山510080
1. 中山大学附属第一医院放射科(广东 中山 510080)
2. 中山大学附属第一医院骨科
3. 中山大学附属第一医院病理科
4. 中山大学医学院生理学教研室
高振华1 胡晓书1 蔡华松1尹军强2 刘大伟3 崔 宇4
SPIO标记兔BMSCs的生物学特性与体外MRI显像研究*
1. 中山大学附属第一医院放射科(广东 中山 510080)
2. 中山大学附属第一医院骨科
3. 中山大学附属第一医院病理科
4. 中山大学医学院生理学教研室
高振华1胡晓书1蔡华松1尹军强2刘大伟3崔 宇4
目的 采用超顺磁性氧化铁(SPIO)作为磁探针标记兔骨髓间充质干细胞(BMSCs), 探讨不同浓度SPIO的磁标记效率及其对细胞活力的影响,观察标记干细胞体外MR显像情况。 方法 采用含铁不同浓度(11.2μg/ml、22.4μg/ml、44.8μg/ml)的SPIO标记兔BMSCs,分别行普鲁士蓝染色和MTT比色法检测其标记效率和BMSCs增殖活性,同时观察不同浓度磁标记细胞组(1×106、1×105、1×104和1×103细胞数/ml)和对照组(1×106细胞数/ml)的T1WI、T2WI及T2*WI体外显像信号。结果SPIO标记BMSCs中铁含量越高,其标记率越高,含铁浓度为22.4μg/ml时磁标记率达95%且对BMSCs生长活性无明显影响。三种MR序列信号变化随细胞浓度的增加,其信号变化越明显,但在相同细胞浓度下,T2
*WI信号变化率最大(P<0.05)。 结论采用含铁浓度为22.4μg/ml的SPIO来标记BMSCs,其磁标记率和安全性均很高。T2
*WI是体外示踪磁标记BMSCs最佳的MR成像序列。
超顺磁性氧化铁;骨髓干细胞;磁共振成像
骨髓间充质干细胞(Bone marrow stromal cells,BMSCs)移植是目前骨组织工程研究的热点内容之一,国内外许多学者采用BMSCs进行股骨头坏死缺损修复的实验研究[1-3]。而利用MRI活体实时动态观察磁标记BMSCs在植入体内的分布及存活状况,对于在体评估干细胞移植的效果具有重要意义[4、5]。本研究通过观察超顺磁性氧化铁(superparamagnetic iron oxide,SPIO )标记对兔BMSCs生物学特性的影响以及标记干细胞体外MR显像研究,为 MRI活体示踪BMSCs在兔股骨头坏死的疗效评估奠定基础。
资料与方法
1.1 实验动物实验用健康雄性新西兰大白兔6只,1.5月龄,体重540g,由中大实验动物中心提供。
1.2 主要试剂与仪器设备DMEM/F12培养基,胎牛血清(FBS),胰蛋白酶,鼠抗兔CD29、CD34单克隆抗体,四甲基偶氮唑蓝(MTT),4',6-二脒基-2-苯基吲哚(DAPI),超顺磁性氧化铁(SPIO,商品名Feridex,购自Advanced公司),PBS(磷酸盐缓冲溶液)。倒置相差显微镜(Nikon),荧光倒置显微镜(Zeiss),CO2培养箱(Thermo公司,美国),超净工作台(国产),台式高速离心机(HETTIH公司,德国),全自动酶标仪(Thermo),3.0T MR成像仪(Siemens,德国),24孔培养板,96孔培养板,25cm2培养瓶(CORNING,美国)。
1.3 主要实验方法和观察指标采用密度梯度离心法体外分离培养兔骨髓的BMSCs,对其进行免疫细胞化学荧光CD29、CD34染色和DAPI染色双重鉴定;采用含铁不同浓度(11.2μg/ml、22.4μg/ml、44.8μg/ml)的SPIO- FBS培养基培养BMSCs 48h,细胞密度为1×105细胞数/ml;再行普鲁士蓝染色检测其标记效率,其判断方法是显微镜不同视野下计数500个细胞,统计细胞内铁染色阳性细胞数;采用四唑盐(MTT)比色法检测SPIO对所标记BMSCs增殖活性的影响,对照组采用不含SPIO的培养基培养。将SPIO标记的不同浓度(1×106、1× 105、1×104、1×103细胞数/ml)细胞悬浮于DMEM/F12完全培养液中置于15ml离心管中,1×106/ml未标记细胞及DMEM/F12完全培养液作为对照组,采用德国Siemens公司3.0T超导型磁共振仪体外成像。采用头线圈,轴位扫描,层厚2mm,成像序列包括SE T1WI(TR 320ms,TE 10ms)、TSE T2WI(TR 3200ms,TE 120ms)和GRE T2*WI(TR 320ms,TE 16ms,翻转角15°)。观察比较体外3种不同MRI成像序列上标记细胞与未标记细胞的信号强度随不同细胞浓度的变化,并计算信号强度变化率Δ SI=[(|SIL-SIU|)/SIU]×100%(其中SIL及SIU分别为标记及未标记BMSCs的MR信号强度)。
1.4 统计学分析应用SPSS 10.0统计软件对不同浓度磁标记干细胞的增殖活性和三种MR成像序列间信号变化率分别进行分析,以P<0.05为差异有统计学意义。
结 果
2.1 BMSCs的培养倒置相差显微镜下观察,刚接种的原代细胞呈圆形,培养36h后换液,除去未贴壁细胞和残渣等成分,可见贴壁细胞呈多角形或梭形。3d后细胞集落较明显形成以梭形细胞为主(图1)。6d时细胞近完全融合状态。传代后的细胞形态类似与原代培养的细胞,但细胞贴壁及增殖速度较原代细胞明显增快。
2.2 BMSCs的鉴定免疫细胞化学荧光染色中,约96%细胞CD29表达阳性,表现为胞浆中见大量强度较高的绿色荧光信号(图2),CD34表达阴性,表现为胞浆中极低的荧光信号强度。DAPI染色中,细胞核为蓝色的是骨髓基质干细胞的细胞核(图3)。
2.3 BMSCs的SPIO标记效率采用11.2μg/ml、22.4μg/ml和44.8μg/ml三种不同含铁浓度的SPIO标记BMSCs 48h后行普鲁士蓝染色,光镜下观察标记细胞质内可见蓝染铁颗粒而未标记细胞内未见蓝染颗粒。本组结果中SPIO标记 BMSCs的含铁浓度越高,标记率越高;当含铁浓度为22.4μg/ml时,细胞内蓝染颗粒标记率达95%(图4);含铁浓度为44.8μg/ml时,细胞内蓝染颗粒聚集成堆,铁染色阳性率近100%。

图1 兔BMSCs原代培养3d后镜下观(×100),细胞呈多角形或梭形,以梭形细胞为主;图2 兔BMSCs免疫荧光CD29染色(×400)胞浆中见大量强度较高的绿色荧光信号;图3 兔BMSCs DAPI 染色(×200)胞核呈深蓝染色;图4 含铁浓度22.4μg/ml的SPIO标记BMSCs后普鲁士蓝染色(×200),细胞内蓝染颗粒阳性率达95%。
2.4 SPIO标记BMSCs的增殖活性采用细胞浓度为1×105细胞数/ml对不同含铁浓度(22.4μg/ml和44.8μg/ml)的SPIO-PBS培养基培养BMSCs 48h后MTT比色法检测,结果显示两种含铁浓度SPIO标记的细胞与未标记细胞的台盼蓝拒染率相近,分别为95%、92%和100%,其差别无统计学意义(P>0.05)。
2.5 SPIO标记BMSCs的体外MR显像分别对SPIO(含铁浓度为22.4μg/ml)标记的不同细胞浓度(1×106、1×105、1×104、1×103细胞数/ml)的标记细胞及未标记(1×106细胞数/ml)的细胞对照组行T1WI、T2WI、I序列3.0T MR扫描。相对于未标记的对照组信号,T1WI序列见标记细胞信号升高,T2WI及I序列均见标记细胞信号降低,三种序列信号变化随细胞浓度的增加,其信号变化越明显(图5)。在相同细胞浓度下,I信号变化率最大,T1WI信号变化最小,三种序列间信号变化率差异均有统计学意义(P<0.05)。
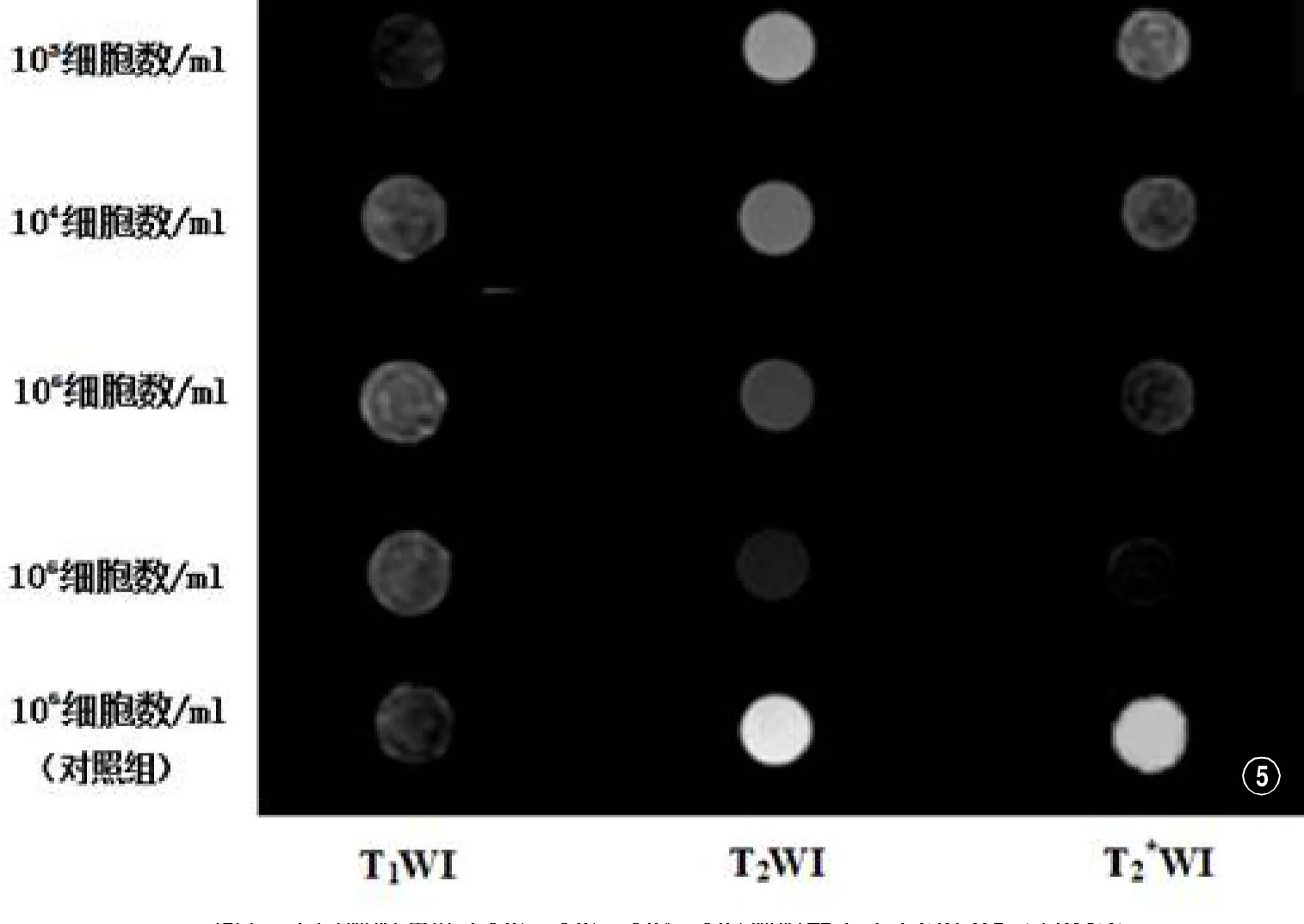
图5 不同细胞浓度(106、105、104、103细胞数/ml)SPIO标记BMSCs与未标记对照组(106细胞数/ml)的T1WI、T2WI和T2*WI显像比较。
讨 论
骨髓由造血和基质系统组成,骨髓基质为造血系统提供结构和功能支持,其成骨潜能来源于基质系统的BMSCs。骨髓组织来源的骨髓基质干细胞因较易获取,培养扩增简便、较强的成骨潜能保持对骨坏死修复能力,而传代能力强,每传一代,细胞数量就增加2-4倍,是目前最理想的骨组织工程种子细胞[6]。
目前,实验室常用分离纯化BMSCs的方法有全骨髓贴壁培养法[7]和密度梯度离心法[8],本研究采用骨髓冲洗法从幼年新西兰大白兔股骨干骨髓组织获得待培养组织,采用密度梯度离心法分离骨髓基质干细胞在体外进行贴壁培养,成功获得活性及传代能力很强的纯化兔BMSCs。而BMSCs的鉴定主要借助其表面抗原性,BMSCs在细胞贴壁附着后表达CD29、CD44等多种表面蛋白,但不表达造血干细胞表面标志CD14和CD34等[9]。本实验除利用免疫细胞化学对细胞浆CD29和CD34荧光染色外,同时结合DAPI细胞核染色来准确鉴定出所培养的细胞为兔BMSCs而非造血干细胞。
SPIO因其直径一般在纳米数量级,且具有强大的顺磁效应,因此可将其作为磁标记探针来标记细胞进行MRI成像。SPIO被证实能够在细胞内较长时间持续存,经活体成像后能够准确地反映所标记细胞的行为,包括细胞所在的位置、数量及迁徙。SPIO标记BMSCs后,从光学显微镜下可观察到铁粒子被吞噬在 BMSCs 的细胞浆中。细胞标记效率与标记细胞种类、使用SPIO与转染剂的种类及浓度、共培养时间等有关[10],而且每种细胞及对应的标记策略的安全性检测至关重要。本实验对含不同Fe3+浓度的SPIO对BMSCs的标记率及其安全性进行观察,结果显示在一定范围内SPIO的含铁浓度越高,测得的BMSCs铁含量越高,标记率也越高,含铁浓度在22.4μg/ml时的标记率已达95%,而且SPIO对BMSCs生长活性无明显影响。
相对于检测干细胞的敏感性而言,MRI低于光学成像及核素显像方法,但MRI具有良好的空间分辨率、软组织分辨率及时间分辨率,无电离辐射,移植干细胞经过磁性物质标记后,可很好的显示移植细胞,而且可以在示踪干细胞的同时监测干细胞移植的治疗效果,在干细胞治疗领域得到广泛应用[11,12]。超顺磁性氧化铁颗粒标记细胞后以囊泡的形式存在于细胞质中,囊泡在细胞中及细胞在组织中呈不均匀分布,造成局部磁场的不均匀,从而加速了质子去相位,明显缩短T2及弛豫时间,使组织信号降低,而对T1弛豫影响较小[13]。本研究采用SPIO标记BMSCs的体外3.0T MR成像观察,证实了SPIO主要缩短及T2弛豫时间,I序列检测SPIO标记细胞最敏感[12-14],且1×103细胞数/ml的细胞浓度即可引起明显信号变化,提示随着MR仪器磁场强度的增加,对磁标记干细胞的显示更敏感。
总之,本实验采用含铁浓度为22.4μg/ml的SPIO来标记BMSCs,其磁标记率和安全性均很高;T2
*WI是磁标记BMSCs体外MR成像的最佳扫描序列。
1.孙伟,李子荣,史振才,等.纳米晶胶原基骨和骨髓间充质干细胞复合修复兔股骨头坏死缺损的研究[J].中国修复重建外科杂志,2005,19(9):703-706.
2.杨建平,王黎明 徐燕,等.辛伐他汀联合BMSCs 治疗激素性股骨头坏死的实验研究[J].中国修复重建外科杂志,2008,22(3):290-294.
3.Noel D, Djouad F, Jorgense C, et al.Regenerative medicine through mesenchymal stem cells for bone and cartilage repair[J]. Curr Opin Investig Drugs,2002,3(7):1000-1004.
4.刘再毅,梁长虹.干细胞MRI活体示踪磁探针标记方法原理及进展[J]. 中国医学影像技术,2008,24(8):1285-1288.
5.居胜红, 滕皋军.干细胞的磁粒子标记和磁共振示踪[J].中国CT和MRI杂志,2005,3(3):58-61.
6.Schweizer PA, Krause U, Becker R, et al:Atrial-radiofrequency catheter ablation mediated targeting of mesenchymal stromal cells[J]. Stem Cells,2007,25(6):1546-1551.
7.Lennon DP, Edmison JM, Caplan AI.Cultivation of rat marrow-derive mesenchymal stem cells in reduced oxygen tension: effects on in vitro and in vivo osteochondrogenesis[J].J Cell Physiol,2001,187(3):345-355.
8.陈红霞,高英茂,邴鲁军. 大鼠骨髓基质干细胞的分离培养与向神经元样细胞诱导分化的实验研究[J]. 中国组织化学与细胞化学杂志,2003,12(1):12-15.
9.Liu W, Cui L,Cao Y. Bone reconstruction with bone marrow stromal cells[J]. Methods Enzymol,2006,420:362-380.
10.Frank JA, Miller BR, Arbab AS, et al. Clinically applicable labeling of mammalian and stem cells by combining superparamagnetic iron oxides and transfection agents[J].Radiology,2003,228(2):480-487.
11.Zhou R, Acton PD, Ferrari VA. Imaging stem cells implanted in infarcted myocardium[J]. J Am Coll Cardiol,2006,48(10):2094-2106.
12.朱文珍,李祥,漆剑频,等.神经干细胞超顺磁性氧化铁标记及体内外MRI示踪[J].中华放射学杂志,2006,40(2):160-164.
13.蔡金华,冯敢生,王新,等.大鼠骨髓间充质干细胞磁标记及MR成像研究[J].中华放射学杂志,2006,40(2):155-159.
14.Bos C, Delmas Y, Desmouliere A, et al. In vivo MR imaging of intravascularly injected magnetically labeled mesenchymal stem cells in rat kidney and liver[J].Radiology,2004,233(3):781-789.
Biological Characteristics and MR Imaging in Vitro of SPIO Labeled Rabbit BMSCs*
GAO Zhen-hua, HU Xiao-shu, CAI Hua-song, et al. Department of Radiology, the First Affiliated Hospital, Sun Yat-sen University, Zhongshan Guangzhou 510080, China
ObjectiveTo label rabbit bone marrow stem cells (BMSCs) with superparmagnetic iron oxide nanoparticles (SPIO) as a magnetic probe and to explore the effects of magnetic cell labeling with various concentrations of SPIO on cellular biological characteristics, and MR signals in vitro.MethodsBMSCs were labeled by SPIOs with different concentrations of 11.2μg/ml, 22.4μg/ml and 44.8μg/ml, respectively. Intracellular irons was evaluated with Prussian blue stain, and cell proliferation was evaluated by using MTT assay. Different concentrations of labeled BMSCs suspended in medium and the control cells were scanned using T1WI,T2WI and T2*WI sequences, and then percentage change in signal intensity normalized to the unlabeled cells was investigated.ResultsThe more irons in SPIO labeled BMSCs, the higher was cellular labeling efficiency. For SPIO labeling with concentrations of 22.4μg/ml, the labeling efficiency was approximately 95% and the viability and proliferation of the labeled cells were unaffected by compared with these characteristics of unlabeled cells. The change in MR signal intensity increased at T1WI, T2WI and T2*WI along with elevation of the labeled cells concentration,and There were more significant in the change of signal intensity at T2*WI than T1WI and T2WI under the same cell concentration (P<0.05).ConclusionBMSCs was labeled by SPIO of 22.4μg/ml has higher cellular labeling efficiency and cell proliferation. Compared with T1WI and T2WI, T2*WI is the most sensitive sequence for MR tracking of SPIO labeled BMSCs in vitro.
superparamagnetic iron oxide; bone marrow stromal cells; magnetic resonance imaging
R445.2
A
广东省医学科研基金项目(编号:B2010073)
10.3969/j.issn.1672-5131.2012.05.001
高振华
book=4,ebook=227
(本文编辑:任晓璇)
2012-03-18