鞘内西地那非能减轻神经病理性疼痛大鼠的痛觉高敏
2012-05-31王洪超李伟伟李雪飞刘清珍李伟彦
王洪超,李伟伟,李雪飞,许 倩,刘清珍,刘 健,李伟彦
(1.徐州医学院麻醉学重点实验室,江苏徐州 221002;2.南京军区南京总医院麻醉科,江苏 南京 210002)
神经病理性疼痛(neuropathic pain)以痛觉高敏为主要特征,近年来大量研究提示由脊髓胶质细胞介导过度的神经炎症是神经病理性疼痛发生维持的一个重要机制[1]。随着体外实验发现提高胶质细胞内环磷腺苷(cyclic 3',5'-adenosine monophosphate,cAMP)水平能抑制胶质细胞的活化[2],抑制胶质细胞内磷酸二酯酶(phosphodiesterase,PDE)成为治疗神经病理性疼痛的一个重要研究方向。
西地那非(sildenafil)是高度选择性磷酸二酯酶5(PDE5)抑制剂,目前主要应用于治疗男性勃起功能障碍,既往研究已证实西地那非能抑制急性炎性疼痛,同时亦有研究证明PDE5抑制剂能够抑制小胶质细胞的激活[3],但目前尚无西地那非用于神经病理性疼痛的研究报道。本实验采用大鼠L5脊神经切断神经病理性疼痛模型,观察鞘内给予不同剂量西地那非对大鼠痛觉过敏的影响,并观察其对小胶质细胞的活化、促炎细胞因子TNF-α和 IL-1β表达的影响。
1 材料与方法
1.1动物和分组清洁级♂ SD大鼠120只(由南京军区总医院动物实验中心提供),体质量190~220 g,随机分为5组,每组24只。Ⅰ组:假手术组;Ⅱ组:L5脊神经切断模型鞘内注射20 μl生理盐水;Ⅲ~Ⅴ组:L5脊神经切断模型分别鞘内注射3 μg/20 μl、10 μg/20 μl、30 μg/20 μl 西地那非(China Pfizer)组;剂量选择参考既往文献[4]。
1.2左侧L5脊神经切断模型参照Colburn等[5]方法,即在2%的戊巴比妥40 mg·kg-1麻醉后,切开大鼠左侧L5至骶1棘突表面皮肤,分离椎旁肌肉,去除L5横突,暴露L5脊神经,Ⅱ~Ⅴ组用3-0丝线结扎并切断L5脊神经,Ⅰ组仅暴露神经,不予结扎切断处理。手术操作在14∶00至16∶00时完成。
1.3鞘内给药鞘内注射参照 Mestre等[6]的方法。大鼠局部麻醉,用连有PE-10导管的稍钝针头经L5和L6椎间隙行椎管穿刺,以穿刺针内有脑脊液流出或动物出现突然地侧向甩尾运动作为穿刺成功的标志。鞘内注射采用25 μl微量进样器(上海高欣玻璃仪器厂)进行。术后d 7,行为学测试后,Ⅰ组和Ⅱ组鞘内注射20 μl生理盐水,Ⅲ~V组鞘内注射相应剂量的西地那非,给药共持续5 d。操作在14∶00至16∶00时完成。
1.4行为学测试机械痛阈值(MWT)的测定,以机械测痛仪(Model 2390CE,ⅡTC Life Science.Inc,美国)测定。每只大鼠重复测量5次,间隔5 min,去除最大和最小值,计算3次的平均值即为大鼠的MWT值。行为学测试在安静的24℃的动物房中进行,时间在8∶00至10∶00时完成。每组大鼠各取6只于术前1 d,术后7、8、10和12 d进行行为学测试。
1.5标本采集于给药后与术后8、10、12 d各组大鼠完成行为学测试后,每组于3个时间各取8只大鼠与腹腔注射戊巴比妥60 mg·kg-1处死,取脊髓-80℃冻存。
1.6L5脊髓细胞因子测定每组于3个时间点取L5脊髓(每组4只),组织匀浆、离心取上清夜,按照试剂盒指示采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)测定 TNF-α、IL-1β 含量。
1.7Real-time PCR检测L5脊髓小胶质细胞标记物白细胞分化抗原11b(CD11b,cluster of differentiation antigen 11b)① RNA的提取,每组于3个时间点取L5脊髓(每组4只)采用TRIzo1(15596-026,Invitrogen,America)试剂盒提取总核糖核酸(Ribonucleicacid,RNA)。② cDNA的合成,引物由南京金斯瑞科技有限公司合成。运用cDNA第一链合成试剂盒(PC0002,Fermentas,Lithuania)在逆转录酶(AMV)作用下反转录合成为反向转录脱氧核糖核酸 (complementary deoxyribonucleic acid,cDNA)。③ 实时定量PCR扩增,取25 μl反应体系以梯度稀释标准模板作为标准曲线,在 Rotor-Gene 3000 Realtime PCR仪中扩增。
1.8统计学分析计量资料数据以±s表示,以SPSS 16.0统计软件处理。各组测定指标组间比较采用双因素方差分析,组内比较采用重复测量单因素方差分析。
2 结果
2.1行为学结果各组大鼠术前1 d的MWT差异无显著性;与Ⅰ组比较,术后d 7,其它4组MWT均明显降低(P<0.05);与Ⅱ组比较,Ⅲ、Ⅳ、Ⅴ组术后8、10、12 d MWT 有明显升高(P<0.05),且 MWT 的增高与西地那非剂量相关(Fig 1)。
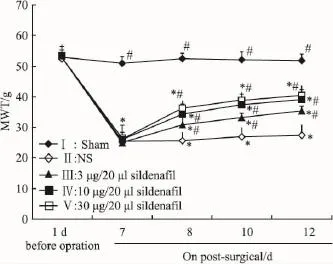
Fig 1 Comparison of mechanical withdrawl threshold among the five groups of rats(±s,n=6)
2.2L5脊髓细胞因子TNF-α和IL-1β表达测定与Ⅰ相比较,其余各组大鼠术后8、10、12 d TNF-α和IL-1β的水平均明显上升(P<0.05)。与Ⅱ相比较,Ⅲ、Ⅳ、Ⅴ组大鼠鞘内注射西地那非术后8、10、12 d能剂量依赖地降低脊髓TNF-α和IL-1β的含量(Tab 1、2)。
Tab 1 Levels of TNF-α in the spinal cord of L5segment after intrathecal injection of sildenafil(ng·g-1,±s,n=4)
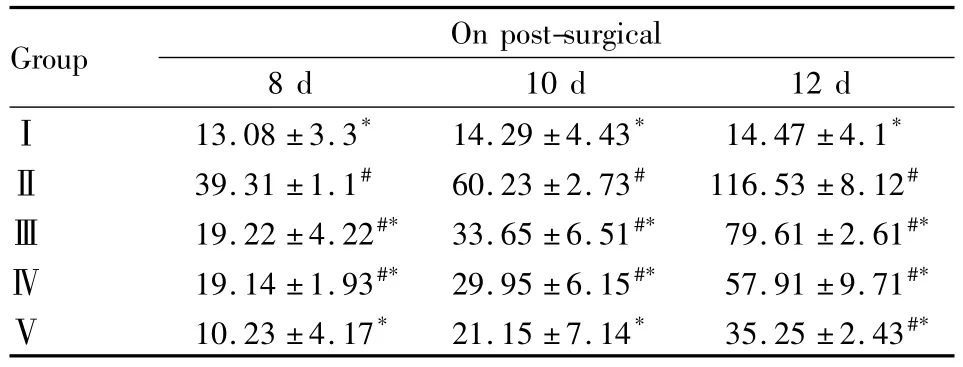
Tab 1 Levels of TNF-α in the spinal cord of L5segment after intrathecal injection of sildenafil(ng·g-1,±s,n=4)
#P <0.05 vs groupⅠ;*P<0.05 vs groupⅡ
Group On post-surgical 8 d 10 d 12 dⅠ13.08 ±3.3* 14.29 ±4.43* 14.47 ±4.1*39.31 ±1.1# 60.23 ±2.73# 116.53 ±8.12#Ⅲ19.22 ±4.22#* 33.65 ±6.51#* 79.61 ±2.61#*Ⅳ19.14 ±1.93#* 29.95 ±6.15#* 57.91 ±9.71#*Ⅴ10.23 ±4.17* 21.15 ±7.14* 35.25 ±2.43#*Ⅱ
Tab 2 Levels of IL-1β in the spinal cord of L5segment after intrathecal injection of sildenafil(ng·g-1,±s,n=4)
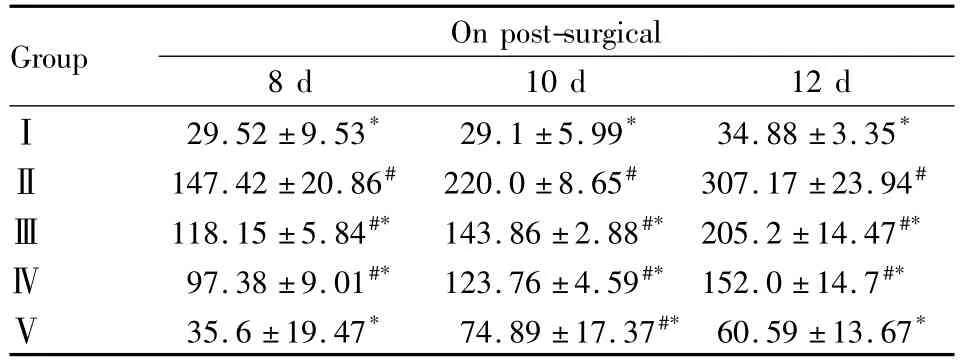
Tab 2 Levels of IL-1β in the spinal cord of L5segment after intrathecal injection of sildenafil(ng·g-1,±s,n=4)
#P <0.05 vs groupⅠ;*P<0.05 vs groupⅡ
8 d 10 d 12 dⅠGroup On post-surgical 29.52 ±9.53* 29.1 ±5.99* 34.88 ±3.35*Ⅱ 147.42 ±20.86# 220.0 ±8.65# 307.17 ±23.94#Ⅲ 118.15 ±5.84#* 143.86 ±2.88#* 205.2 ±14.47#*Ⅳ97.38 ±9.01#* 123.76 ±4.59#* 152.0 ±14.7#*Ⅴ35.6 ±19.47* 74.89 ±17.37#* 60.59 ±13.67*
2.3PCR检测L5CD11b的表达与Ⅰ组相比较,Ⅱ、Ⅲ组大鼠术后各天CD11b表达增多(P<0.05),说明在小胶质细胞在术后8、10、12 d激活增加,而Ⅳ组术后12 d后以及Ⅴ组术后各天CD11b表达降至正常(P>0.05)。与Ⅱ组相比较,Ⅲ~Ⅴ组大鼠鞘内注射西地那非后在术后8、10、12 d CD11b表达降低(P<0.05),见 Tab 3。
Tab 3 Expression of CD11b mRNA in the spinal cord of L5 segment after intrathecal injection of sildenafil(±s,n=4)
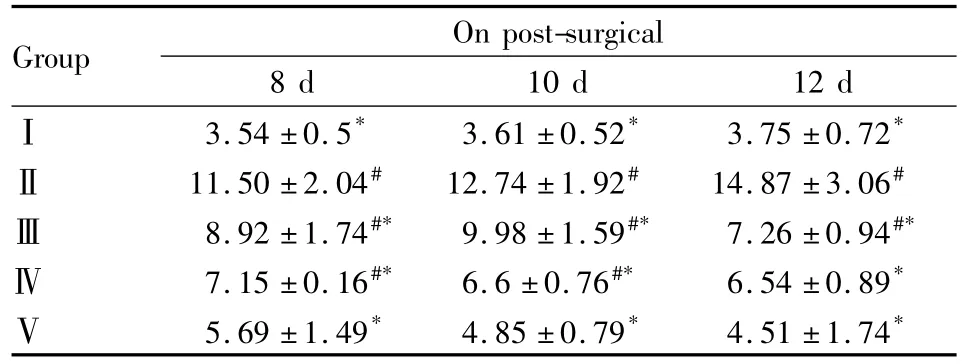
Tab 3 Expression of CD11b mRNA in the spinal cord of L5 segment after intrathecal injection of sildenafil(±s,n=4)
#P <0.05 vs groupⅠ;*P<0.05 vs groupⅡ
Group On post-surgical 8 d 10 d 12 dⅠ3.54 ±0.5* 3.61 ±0.52* 3.75 ±0.72*11.50 ±2.04# 12.74 ±1.92# 14.87 ±3.06#Ⅲ8.92 ±1.74#* 9.98 ±1.59#* 7.26 ±0.94#*Ⅳ7.15 ±0.16#* 6.6 ±0.76#* 6.54 ±0.89*Ⅴ5.69 ±1.49* 4.85 ±0.79* 4.51 ±1.74Ⅱ*
3 讨论
近年来,越来越多的研究证实胶质细胞为主导的神经炎症和神经免疫反应在神经病理性疼痛的发生、维持中发挥重要作用,因此调控胶质细胞功能,控制过度的神经炎症成为目前神经病理性疼痛研究及药物开发的一个热点[1],神经损伤后脊髓前角和后角的小胶质细胞迅速活化增殖,大约在4 d达顶峰,数周缓慢下降,并能分泌多种炎症因子如:TNF-α、IL-1β、IL-6、前列腺素等,可直接活化初级传入神经元中枢支和脊髓后角神经元。己酮可可碱(pentoxifylline)、丙戊茶碱(propentofylline)及异丁地特(ibudilast)可抑制cAMP的降解,但均为非特异性PDE抑制剂,它们可以抑制PDE3、4等多种亚型,并且抑制小胶质细胞或者星形胶质细胞激活,预防或治疗神经病理性疼痛[7-9]。
西地那非是高度选择性PDE5抑制剂,能特异性抑制cGMP的降解,从而提高细胞内cGMP含量。目前已证实西地那非在糖尿病疼痛模型、角叉菜胶实验、扭体实验、福尔马林实验中发挥镇痛作用[10-13],但其镇痛作用机制目前尚未明确,NO-cGMP信号通路、脊髓水平的腺苷受体和血清素受体[4]、NO-cGMP 相关的钾离子通道[14],GABA 受体[15]和阿片类受体[16]都可能与西地那非的镇痛作用有关。此外最近研究证明西地那非能够明显抑制LPS激活的体外培养的N9小胶质细胞分泌的细胞因子 IL-1β 和 TNF-α[3],提示抑制脊髓小胶质细胞活性,也可能是西地那非镇痛作用的一个机制。
本实验选择L5脊神经结扎切断模型,该模型较稳定,术后7 d后大鼠痛觉过敏处于稳定状态。我们发现,术后7 d开始连续鞘内给予西地那非3、10和30 μg 5 d后能剂量依赖性的缓解大鼠神经病理性疼痛,本实验所用剂量已证实能抑制大鼠急性炎性疼痛[4]。此外,西地那非治疗组的大鼠脊髓小胶质细胞标记物CD11b的mRNA表达量剂量依赖地明显下降,这提示西地那非能剂量依赖地抑制神经病理性疼痛大鼠脊髓的小胶质细胞的活性,同时L5脊髓节段的促炎细胞因子TNF-α、IL-1β也明显下降,这可能与胶质细胞活性抑制有关。本研究未探讨西地那非抑制小胶质细胞的活性的分子机制,既往研究提示西地那非可能是通过升高小胶质细胞细胞内cGMP,抑制NF-κB和MAPKs信号通路的激活[3],继而抑制小胶质细胞活化,减少促炎细胞因子的释放。
综上所述,我们的实验证明了鞘内给予西地那非能剂量依赖地缓解L5脊神经切断大鼠的痛觉高敏行为,该效应可能与其剂量依赖地抑制脊髓小胶质细胞活化,减少促炎细胞因子TNF-α、IL-1β释放有关。本研究为下一步深入理解PDE抑制剂在胶质细胞靶向调控治疗中的作用机制提供了新的思路和理论依据,并为新型镇痛药物的研发提供新的方向。
[1]Scholz J,Woolf C J.The neuropathic pain triad:neurons,immune cells and glia[J].Nat Neurosci,2007,10(11):1361-8.
[2]Yoshikawa M,Suzumura A,Tamaru T,et al.Effects of phosphodiesterase inhibitors on cytokine production by microglia[J].Mult Scler,1999,5(2):126-33.
[3]Zhao S Q,Zhang L J,Lian G N,et al.Sildenafil attenuates LPS-induced pro-inflammatory responses through down-regulation of intracellular ROS-related MAPK/NF-κB signaling pathways in N9 microglia[J].Int Immunopharmacol,2011,11(4):468-74.
[4]Lee H G,Kim W M,Park C H,et al.Roles of adenosine and serotonin receptors on the antinociception of sildenafil in the spinal cord of rats[J].Yonsei Med J,2010,51(6):960-4.
[5]Colburn R W,Rickman A J,DeLeo J A.The effect of site and type of nerve injury on spinal glial activation and neuropathic pain behavior[J].Exp Neural,1999,157(2):289-304.
[6]Mestre C,Pelissier T,Fialip J,et al.A method to perform direct transcutaneous intrathecal injection in rats[J].J Pharmacol Toxicol Methods,1994,32(4):197-200.
[7]张艳兵,王丽娜,成 浩,等.丙戊茶碱预处理削弱大鼠关节炎痛觉过敏的脊髓机制[J].中国药理学通报,2007,23(10):1384-8.
[7]Zhang Y B,Wang L N,Cheng H,et al.Effect and mechanism of pretreating propentofylline on attenuation of arthritis thermal hyperalgesia[J].Chin Pharmacol Bull,2007,23(10):1384-8.
[8]Ledeboer A,Liu T,Shumilla J A,et al.The glial modulatory drug AV411 attenuates mechanical allodynia in rat models of neuropathic pain[J].Neuron Glia Biol,2006,2(4):279-91.
[9]Liu J,Li W,Zhu J,et al.The effect of pentoxifylline on existing hypersensitivity in a rat model of neuropathy[J].Anesth Analg,2008,106(2):650-3.
[10]Jain N K,Patil C S,Singh A,Kulkarni S K.Sildenafil,a phosphodiesterase-5 inhibitor,enhances the antinociceptive effect of morphine[J].Pharmacology,2003,67(3):150-6.
[11]Araiza-Saldaña C I,Reyes-García G,Bermúdez-Ocaña D Y,et al.Effect of diabetes on the mechanisms of intrathecal antinociception of sildenafil in rats[J].Eur J Pharmacol,2005,527(1-3):60-70.
[12]Yoon M H,Park K D,Lee H G,et al.Additive antinociception between intrathecal sildenafil and morphine in the rat formalin test[J].J Korean Med Sci,2008,23(6):1033-8.
[13]Yoon M H,Kim C M,Lee H G,et al.Synergistic antinociception of intrathecal sildenafil with clonidine in the rat formalin test[J].Pharmacol Biochem Behav,2009,92(4):583-8.
[14]Vale M L,Rolim D E,Cavalcante I F,et al.Role of NO/cGMP/KATPpathway in antinociceptive effect of sildenafil in zymosan writhing response in mice[J].Inflamm Res,2007,56(2):83-8.
[15]Huang L J,Yoon M H,Choi J I,et al.Effect of sildenafil on neuropathic pain and hemodynamics in rats[J].Yonsei Med J,2010,51(1):82-7.
[16]Yoon M H,Kim W M,Lee H G,et al.Roles of opioid receptor subtypes on the antinociceptive effect of intrathecal sildenafil in the formalin test of rats[J].Neurosci Lett,2008,441(1):125-8.
