Wnt信号通路诱导肿瘤细胞上皮间质转化的研究进展
2012-05-31朱智杰阮君山郑仕中王爱云陈文星
朱智杰,阮君山,李 尧,陆 茵,2,郑仕中,2,王爱云,2,陈文星,2
(1.南京中医药大学药学院,江苏南京 210029;2.江苏省中药药效与安全性评价重点实验室,江苏南京 210046)
上皮间质转化(epithelial-mesenchymal transition,EMT)是指上皮细胞在形态学上发生向间质细胞表型的转变并获得迁移能力的过程[1]。在EMT过程中,细胞会失去极性、与周围细胞和基质的接触减少,细胞的迁移和运动能力增强,同时细胞表型发生改变,出现间质细胞的特性。EMT是胚胎早期发育和器官生成中的一个极其重要的过程,同时伤口愈合以及许多恶性上皮肿瘤发展的过程也与EMT密切相关[2-3]。诱导EMT发生的信号通路中,Wnt信号通路是诱导上皮组织EMT产生的关键信号转导通路。
Wnt信号具有重要的生理功能,在早期的胚胎生长发育过程中,Wnt信号通路是脑和神经系统形成的必要因素[4-5]。同时,Wnt信号与干细胞自我更新和分化调控也密切相关,Wnt信号通路对于造血干细胞的自我更新有着重要意义,还维持小肠组织的稳定性,调节骨密度以及脂肪细胞的分化[6]。然而,Wnt信号转导途径的失调与多种已知的高发性癌变有关[7]。根据Wnt蛋白转导信号的方式不同,Wnt信号转导可以分为经典Wnt信号通路(canonical Wnt signaling pathway)和非经典的Wnt信号通路(noncanonical Wnt signaling pathway)。如 Fig 1所示,经典 Wnt通路(Wnt/βcatenin通路)通过核内β链接蛋白(β-catenin)的累积,激活Wnt相关靶基因,这条通路中的成分(β-catenin,Axin)活化过度或者失调可引起肿瘤的形成;非经典通路又主要分为两条:(1)Wnt/Ca2+通路由Wnt5A和Wnt11激活,通过钙调蛋白依赖的激酶Ⅱ(CamkⅡ)、钙调蛋白敏感的蛋白磷酸酶(Calcn)和T细胞核因子NF-AT的作用,引起细胞内Ca2+增加并激活蛋白激酶C(PKC),调节肿瘤细胞之间的黏附。(2)细胞平面极性通路(Wnt/polarity通路),又称Wnt/PCP途径或Wnt/Jun激酶途径,涉及RhoA和Jun激酶(JNK),此通路主要调控肿瘤细胞骨架的重排,控制细胞骨架的形成,参与肿瘤细胞的变形、迁移以及肿瘤细胞的极性变化等[8]。近几年国内外的研究发现,Wnt的经典和非经典通路均参与EMT的诱导过程,不同Wnt信号通路之间以及Wnt信号与其他通路间有时还存在相互作用(cross talk),这使其分子机制变得异常复杂。但Wnt信号通路是EMT最主要的诱因之一,本文着重论述近几年关于Wnt信号通路诱导肿瘤EMT过程的重要进展,期望能对肿瘤研究的科学工作者提供借鉴。
1 Wnt/β-catenin通路在肿瘤上皮间质转化中的作用
Wnt经典信号通路调节由胞质β-链接蛋白的磷酸化/降解引起。如Fig 1所示,在没有Wnt信号时,大部分β-链接蛋白与E钙黏附蛋白(E-cadherin)和细胞骨架蛋白(actin)结合维持其稳定性,少部分与大肠腺瘤样蛋白(adenomatous polyposis coli,APC)、GSK3β及轴蛋白(axin)结合形成“降解复合物”,随后进行泛素化和蛋白酶体介导的降解,使胞质内游离的β-catenin维持在低水平,不能进入核内激活作用靶点。在有 Wnt信号存在时,形成 Wnt蛋白、Frizzled和LRP5/6的复合物,信号通过作用于胞质内蓬松蛋白(Dvl),导致细胞质中的降解复合物失去活性,并发生解离,使之不能再磷酸化β-catenin,β-catenin在细胞质的水平得到累积,转位进入细胞核,在胞核与T细胞因子(TCF)/淋巴增强子结合因子(LEF)转录因子结合,调节靶基因的表达[9]。
β-catenin进入细胞核并堆积在核内,与肿瘤细胞EMT的发生以及肿瘤转移密切相关。Prasad等[10]研究发现,波形蛋白表达与细胞核β-catenin以及胞质内蓬松蛋白(Dvl)之间有明显的关联,证明了在浸润性乳腺导管癌(IDCs)中Wnt/β-catenin信号通路诱导 EMT发生的重要性。Prasad等[11]又进一步通过对98例临床浸润性乳腺导管癌样本中Wnt/β-catenin信号通路的表达方式以及关键组分E钙粘素、Slug和GSK3β之间关系的分析发现,Slug作为介导EMT发生的重要分子,可以通过激活Wnt/β-catenin信号通路降低E钙粘素,首次提供了临床证据支持在浸润性乳腺导管癌的EMT中,Wnt/β-catenin信号通路的表达上调。Zhao等[12]研究发现,使用缺氧诱导因子-1α(HIF-1α)可以诱导前列腺癌细胞(LNCaP)发生EMT。细胞的间质标志物呈现高表达,上皮标记物则低表达;而转染β-catenin的短发卡RNA(shRNA)后,细胞上皮标记物E钙粘素表达增加,间质标记物N-钙粘素(N-cadherin),波形蛋白(vimentin)以及基质金属蛋白酶-2(MMP-2)的表达则明显下降,通过β-catenin的shRNA作用,LNCaP细胞的EMT发生了逆转,证明了Wnt/β-catenin信号通路作为一个必要的内源性信号,可能直接控制HIF-1α 诱导 EMT 的发生。Stemmer等[13]研究发现,Wnt/β-catenin信号激活可以使Slug、Snail、Twist等表达增加,降低E钙粘素并形成EMT。而在结肠癌细胞系的EMT过程中,Snail过表达可以增加Wnt信号靶基因的表达,Snail通过其N端与β-catenin相互作用,进一步激活Wnt信号下游靶基因的表达,从而形成Wnt信号激活的正反馈。
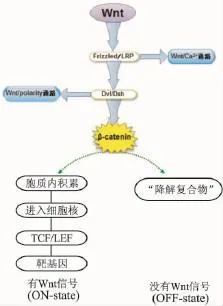
Fig 1 Wnt signaling pathway
2 非经典Wnt通路在肿瘤上皮间质转化中的作用
目前已经发现了多种Wnt蛋白,其并不通过β-catenin在核内积累而产生Wnt信号,包括Wnt5A、Wnt11在内的多种Wnt蛋白是通过非经典Wnt信号发生转导。深入的研究发现,Wnt非经典信号通路也参与肿瘤细胞EMT的诱导过程。
Dissanayake等[14]通过对黑色素瘤 EMT的研究发现,Wnt5A可以增加Snail以及波形蛋白,减少E钙粘素的表达。使用蛋白激酶C(PKC)抑制剂后加入人重组Wnt5A与肿瘤细胞共培养,可以明显抑制Snail的表达,提示Wnt5A是通过PKC途径诱导黑色素瘤EMT和转移的。Fort等[15]对神经嵴(NC)细胞中 Rho家族研究发现,Wnt的应答基因RhoU/wrch1在颅神经嵴细胞(CNC)中表达,RhoU通过激活JNK调控Wnt/polarity通路发生作用,细胞中的RhoU的表达水平在EMT形成以及肿瘤的转移过程中扮演重要角色。体外研究还发现,RhoU与PAK1和Rac1共同在EMT和肿瘤转移过程中起作用[16]。Chen等[17]对小猎犬肾上皮细胞中EMT的研究发现,细胞中Wnt5A的表达增加,使用siRNA沉默Wnt5A后发现细胞的迁移能力明显下降。在EMT过程中还发现RhoA,Rac以及JNK等调控因子的表达都上调,说明Wnt5A还可以通过细胞平面极性通路诱导EMT的产生。
3 经典和非经典Wnt信号通路共同作用
在某些情况下,一种Wnt蛋白的下游信号可以是经典Wnt信号,也可以是非经典Wnt信号,所以有些EMT的产生是通过Wnt的经典和非经典通路共同诱导的。
von Gise等[18]对肾母细胞肿瘤基因(WT1)的研究发现,WT1可以调控心外膜上的上皮间质转化,通过使用遗传谱系跟踪法获得缺少WTI基因[WT1(KO)]的心外包膜和心外包膜衍生物。研究发现,WT1(KO)不会发生EMT,一方面WT1(KO)的心外包膜上Wnt/β-catenin信号通路的重要成分Lef1和Ctnnb1(β-catenin)表达下降,该通路下游的Axin2、Cyclin D1和Cyclin D2的活性也降低;另一方面,WT1(KO)与具有WT1的心外膜相比,Wnt5A和Raldh2表达明显下降,说明WT1可以通过经典和非经典的Wnt通路共同调控心外膜的 EMT。Iwai等[19]发现,在口腔鳞状细胞癌(SCC)胞质中堆积大量β-catenin,不但增加Tcf/Lef介导的转录活性,还上调Wnt/β-catenin信号的靶基因MMP-7,并且增加Rho家族Cdc42和Rac的水平,诱导上皮间质转化,提高口腔鳞状癌细胞的侵袭和迁移。Chung等[20]报道,分泌型卷曲相关蛋白SFRP1和SFRP2在宫颈癌CaSki细胞中能引起Wnt信号的衰减,降低β-catenin在细胞核内的异常堆积,抑制癌细胞的生长,同时还能增加E钙粘素并降低Slug、Twist和Snail的表达。而β-catenin在CaSki或者HeLa3rd细胞胞质中呈现出不同的堆积状态,提示SFRP1和SFRP2通过不同的Wnt信号产生作用。

Tab 1 信号通路在不同肿瘤中的分布
4 Wnt信号通路与其他信号通路的相互作用
Wnt信号通路作为诱导肿瘤EMT的重要信号,还与TGF-β、PI3K/Akt、Notch等其他信号通路有着一定程度的相互作用(cross talk)。通过对Wnt信号通路与其他信号的相互作用的研究,可以进一步了解EMT的机制的复杂性,同时也为如何逆转EMT提供了思路。
4.1Wnt与TGF-β信号通路Scheel等[21]最新研究证实在永久化人乳腺上皮细胞(HMLE)中,经典及非经典Wnt信号通路与TGF-β协同作用诱导激活细胞EMT程序,之后以自分泌的方式维持最终的间质细胞状态,证实在上皮细胞中下调内源的自分泌信号抑制因子可诱导细胞启动EMT程序。反之,当在细胞中添加相关信号通路抑制剂时,发现自分泌信号破坏可导致原代永久化人乳腺上皮细胞迁移及自我更新受到抑制,并降低了转化衍生物诱导的肿瘤形成及转移。Qin等[22]在卵巢上皮细胞中,通过生物信息学方法发现Wnt通路下游的LEF1可作为TGF-β通路中Smad蛋白的共调节因子,共同参与对靶基因的转录调节,从而连接Wnt和TGF-β/Smad两条信号通路。
4.2Wnt与PI3K/Akt通信号通路Wnt与 PI3K/Akt信号通路在EMT过程中对GSK3磷酸化的不同作用,同时通过刺激Wnt/Disheveled信号可以进一步激活Akt的活性,并且Akt可能作用于β-catenin的转录以及磷酸化过程,然而两个信号通路在EMT过程的直接相互作用则有待进一步的研究[23]。
4.3Wnt与Notch信号通路许多文献都报道了Wnt和Notch通路的交联,Niessen等[24]报道在上皮细胞中,Snail2是Notch信号通路的一个靶基因,而Notch信号则可以直接上调 Slug,促进 EMT的形成。Devgan等[25]的研究揭示Notch信号对皮肤角质细胞β-catenin有调节作用,Notch通路能够上调p21基因的表达,而p21蛋白可以与转录因子E2F-1共同作用于Wnt4基因的启动子,下调Wnt4蛋白的表达。
4.4Wnt与Hedgehog信号通路研究发现,Hedgehog信号可以上调间质细胞中SFRP1、SNAI1(Snail)以及ZEB1和ZEB2的水平[26]。Yang等[27]研究发现,在小鼠基底细胞癌(BCC)的上皮芽和错构瘤中,Wnt/β-catenin信号通路能够诱导癌基因M2SMO表达,进一步激活Hedgehog信号。
5 基于Wnt信号通路诱导EMT的抗肿瘤药物
由于EMT在肿瘤的发展过程中扮演重要角色,阻断甚至逆转EMT可为肿瘤的的治疗提供新的思路,通过药物调节Wnt信号通路,可能成为抗肿瘤的新方法,同时对抗肿瘤药物的发展具有积极的推动作用。
闫喆等[28]研究发现厄贝沙坦可以下调 Wnt4、α-SMA及β-catenin核蛋白表达,升高E钙粘素的表达水平,抑制Wnt/β-catenin信号途径诱导的肾小管上皮细胞EMT。赵士彭等[29]报道塞来昔布通过COX-2依赖或非依赖途径抑制Wnt信号通路从而抑制结肠癌移植瘤的生长,诱导实现细胞的凋亡。黄伟平等[30]发现舒林酸通过下调 β-catenin抑制肝癌细胞的Wnt信号通路,下调 cyclinD1的表达。马骏飞等[31]研究发现布洛芬可以使肝癌细胞HepG2在细胞核中β-catenin堆积减少,胞质中增多,通过调控Wnt/β-catenin信号通路,影响β-catenin的表达和定位,调节下游相关靶基因的转录。
6 结语
上皮细胞发生EMT获得间质细胞特性从而使肿瘤细胞进一步发生侵袭和转移,在肿瘤的发展过程中扮演了重要的角色,而Wnt信号则是诱导 EMT发生的重要途径之一。EMT并非永久的,在一定的条件下可以发生阻断甚至逆转,通过对Wnt信号诱导EMT过程的研究,对我们进一步揭示肿瘤的本质,寻找临床有效治疗手段提供了新思路。同时,EMT的发生以及Wnt信号通路中的信号分子表达异常还可以作为早期肿瘤诊断的标记,让我们能够尽早及时的趋利避害。而且不同的Wnt信号在不同的肿瘤细胞中可能存在特殊的分布(如表1),可能与不同的肿瘤微环境有关。对Wnt信号与其他信号在EMT过程中的相互作用研究让我们更加全面了解EMT复杂性的同时还发现有些信号分子可以作为靶点来调节Wnt信号。因此,了解Wnt信号通路对EMT的诱导过程,对于如何有效阻断或逆转EMT的发生以及肿瘤的诊断和治疗都有着重要意义。
[1]Acloque H,Adams M S,Fishwick K,et al.Epithelial-mesenchymal transitions:the importance of changing cell state in development and disease[J].J Clin Invest,2009,119(6):1438 -49.
[2]Gos M,Miloszewska J,Przybyszewska M.Epithelial-mesenchymal transition in cancer progression[J].Postepy Biochem,2009,55(2):121-8.
[3]徐思云,李 静,耿美玉.上皮间质转化的信号转导调控及药物开发[J].中国药理学通报,2008,24(9):1131 -4.
[3]Xu S Y,Li J,Geng M Y.The signal tansduction and drug drvelopment of epithelial-mesenchymal transition[J].Chin Pharmacol Bull,2008,24(9):1131 -4.
[4]Fossat N,Jones V,Khoo P L,et al.Stringent requirement of a proper level of canonical Wnt signalling activity for head formation in mouse embryo[J].Development,2011,138(4):667 -76.
[5]Wang Y Z,Molotkov A,Song L,Li Y.Activation of the Wnt/beta-catenin signaling reporter in developing mouse olfactory nerve layer marks a specialized subgroup of olfactory ensheathing cells[J].Dev Dyn,2008,237(11):3157 -68.
[6]尹定子,宋海云.Wnt信号通路:调控机理和生物学意义[J].中国细胞生物学学报,2011,33(2):103-11.
[6]Yin D Z,Song H Y.Regulation of Wnt signaling:mechanisms and biological significance[J].Chin J Cell Biol,2011,33(2):103-11.
[7]Lie D C,Colamarino S A.Song H J,et al.Wnt signalling regulates adult hippocampal neurogenesis[J].Nature,2005,437(7063):1370-5.
[8]任学群,李宜雄.Ezrin与细胞骨架在肿瘤侵袭转移中的作用[J].河南大学学报:医学版,2010,29(2):104 -7.
[8]Ren X Q,Li Y X.The role of Ezrin and cytoskeleton in tumor invasion[J].J Henan Univ(Med Sci),2010,29(2):104 -7.
[9]Zerlin M,Julius M A,Kitajewski J.Wnt/frizzled signaling in angiogenesis[J].Angiogenesis,2008,11(1):63 -9.
[10]Prasad C P,Mirza S,Sharma G,et al.Epigenetic alterations of CDH1 and APC genes:relationship with activation of Wnt/betacatenin pathway in invasive ductal carcinoma of breast[J].Life Sci,2008,83(9 -10):318 -25.
[11]Prasad C P,Rath G,Mathur S,et al.Expression analysis of E-cadherin,Slug and GSK3beta in invasive ductal carcinoma of breast[J].BMC Cancer,2009,9:325.
[12]Zhao J H,Luo Y,Jiang Y G,et al.Knockdown of beta-Catenin through shRNA cause a reversal of EMT and metastatic phenotypes induced by HIF-1alpha[J].Cancer Invest,2011,29(6):377 -82.
[13]Stemmer V,de Craene,B,Berx G,Behrens J.Snail promotes Wnt target gene expression and interacts with beta-catenin[J].Oncogene,2008,27(37):5075 -80.
[14]Dissanayake S K,Wade M,Johnson C E,et al.The Wnt5A/protein kinase C pathway mediates motility in melanoma cells via the inhibition of metastasis suppressors and initiation of an epithelial to mesenchymal transition[J].J Biol Chem,2007,282(23):17259-71.
[15]Fort P,Guemar L,Vignal E,et al.Activity of the RhoU/Wrch1 GTPase is critical for cranial neural crest cell migration[J].Dev Biol,2011,350(2):451 -63.
[16]Schiavone D,Dewilde S,Vallania F,et al.The RhoU/Wrch1 Rho GTPase gene is a common transcriptional target of both the gp130/STAT3 and Wnt-1 pathways[J].Biochem J,2009,421(2):283-92.
[17]Chen Y S,Mathias R A,Mathivanan S,et al.Proteomics profiling of Madin-Darby canine kidney plasma membranes reveals Wnt-5a involvement during oncogenic H-Ras/TGF-beta-mediated epithelial-mesenchymal transition[J].Mol Cell Proteomics,2011,10(2):M110.001131.
[18]von Gise A,Zhou B,Honor L B,et al.WT1 regulates epicardial epithelial to mesenchymal transition through beta-catenin and retinoic acid signaling pathways[J].Dev Biol,2011,(356)(2):421 -31.
[19]Iwai S,Yonekawa A,Harada C,et al.Involvement of the Wntbeta-catenin pathway in invasion and migration of oral squamous carcinoma cells[J].Int J Oncol,2010,37(5):1095 - 103.
[20]Chung M T,Lai H C,Sytwu H K,et al.SFRP1 and SFRP2 suppress the transformation and invasion abilities of cervical cancer cells through Wnt signal pathway[J].Gynecol Oncol,2009,112(3):646-53.
[21]Scheel C,Eaton E N,Li S H,et al.Paracrine and autocrine signals induce and maintain mesenchymal and stem cell states in the breast[J].Cell,2011,145(6):926 -40.
[22]Qin H,Chan M W,Liyanarachchi S,et al.An integrative ChIP-chip and gene expression profiling to model SMAD regulatory modules[J].BMC Syst Biol,2009,3:73.
[23]Larue L,Bellacosa A.Epithelial-mesenchymal transition in development and cancer:role of phosphatidylinositol 3'kinase/AKT pathways[J].Oncogene,2005,24(50):7443 - 54.
[24]Niessen K,Fu Y,Chang L,et al.Slug is a direct notch target required for initiation of cardiac cushion cellularization[J].J Cell Biol,2008,182(2):315 -25.
[25]Devgan V,Mammucari C,Millar S E,et al.p21WAF1/Cip1 is a negative transcriptional regulator of Wnt4 expression downstream of Notch1 activation[J].Genes Dev,2005,19(12):1485 -95.
[26]Katoh Y,Katoh M.Hedgehog signaling,epithelial-to-mesenchymal transition and miRNA[J].Int J Mol Med,2008,22(3):271 -5.
[27]Yang S H,Andl T,Grachtchouk V,et al.Pathological responses to oncogenic Hedgehog signaling in skin are dependent on canonical Wnt/beta3-catenin signaling[J].Nat Genet,2008,40(9):1130-5.
[28]闫 喆,姚 芳,张丽萍,等.厄贝沙坦对高糖诱导肾小管上皮细胞转分化中Wnt/β-catenin信号途径表达的影响[J].中国药理学通报,2009,25(12):1630 -4.
[28]Yan Z,Yao F,Zhang L P,et al.Modulation of Wnt/β-catenin in signaling pathway by irbesartan in highglucose-induced tubular epithelial-mesenchymal transition[J].Chin Pharmacol Bull,2009,25(12):1630-4.
[29]赵士彭,蔡建辉,赵 发,等.Wnt信号传导通路在塞来昔布抗结肠癌生长中的作用[J].中国老年学杂志,2009,29(8):917-20.
[29]Zhao S P,Cai J H,Zhao F,et al.Effect of Wnt-singnal pathway on celecoxib’s against colon cancer growth[J].Chin J Gerontol,2009,29(8):917 -20.
[30]黄伟平,黄月红,陈治新,等.舒林酸对HBV X基因转染的肝癌细胞Wnt信号通路的影响[J].胃肠病学和肝病学杂志,2010,19(8):703-7.
[30]Huang W P,Huang Y H,Chen Z X,et al.Effect of Sulindac on Wnt signaling in hepatocellular carcinoma cells transfected with HBV X gene[J].Chin J Gastroenterol Hepatol,2010,19(8):703-7.
[31]马骏飞,赵迎泽,李青岭,等.布洛芬对肝癌细胞HepG2增殖及wnt/β-catenin信号通路的影响[J].生物技术通报,2009,2:132-7.
[31]Ma J F,Zhao Y Z,Li Q L,Influence of ibuprofen on proliferation of human liver cancer cell line hepG2 and β-catenin signaling pathway[J].Biotechnol Bull,2009,2:132 - 7.
