谷氨酰胺对心肌细胞线粒体膜PTP开放干预作用的实验研究*
2012-05-24刘铁民张玉玲
刘铁民,张玉玲
(1.聊城大学体育学院生化室,2.聊城大学医院,山东聊城 252059)
线粒体是心肌细胞损伤时的主要受损部位[1],线粒体膜通透性转换孔(permeability transition pore,PTP)为位于线粒体内外膜间的多蛋白孔道,是线粒体内外信息交流的中心枢纽[2]。PTP开放是导致线粒体膜通透性转移和凋亡蛋白释放、调控细胞死亡的重要结构基础[3]。研究表明[4],过度训练可导致线粒体膜PTP的开放,过度训练状态下心肌线粒体钙代谢的紊乱、自由基生成增加、磷脂酶A2(phospholipase A2,PLA2)活性增加等变化皆与PTP开放密切相关。但如何遏制或调节PTP开放,能否通过外源性物质的补充来调节PTP的开放,这些问题尚不清楚。本研究通过补充外源性谷氨酰胺(glutamine,G ln)的对比试验,探讨G ln对心肌细胞线粒体膜PTP开放的干预作用及其可能机制。
1 材料与方法
1.1 主要试剂和仪器
罗丹明 123(Rhodamine123,Rh123)、鱼藤酮(Rotenone)、寡霉素(Oligomycin)、鲁米诺 (Luminol)(Sigma),SDS(Pharmacia),Tris、TEMED(AMRESCO),其他试剂均为国产分析纯。U-2001紫外分光光度仪(HITACHI),F-4500荧光分光光度仪(HITACHI),3K18低温高速离心机(Sigma)。
1.2 实验动物
30只健康雄性SD大鼠(180~220g)(中国科学院动物研究所提供),随机分为对照组(CG组)、过度训练组(OG组)和补充 G ln+过度训练组(G OG组)(n=10)。分笼饲养,饲养环境温度22℃±3℃,相对温度60%±15%,自然光照,自由饮食和饮水。G OG组大鼠训练开始,每天早晨8点每只大鼠灌服G ln溶液1次(G ln溶液浓度为10%,灌服剂量为500mg/kg bw),连续灌服8周;为排除灌胃对大鼠刺激的影响,CG组、OG组每天灌服等量的生理盐水1次。
1.3 实验方法
1.3.1 过度训练动物模型的建立 CG组动物进行中等强度的跑台(BCPT-96型)训练。第1周:每天完成10m/min×10min的跑台运动;第2周:每天完成10m/min×10min的跑台运动后,继续加速至15 m/min×10min;以后维持这一运动量直至第8周周末。每周训练5 d,周末休息。OG组与 G OG组动物进行持续大运动量跑台(BCPT-96型)训练8周,包括一般训练和力竭训练各4周。动物跑台坡度为10°,每周训练5天,周末休息。一般训练:第1周:每天完成10m/min×10min的跑台运动;第2周:每天完成10m/min×10min跑后,继续加速至15 m/min ×10min;第 3 周:每天进行 10m/min、15 m/min、20m/min各10min的持续跑台训练;第4周:每天分别进行 10m/min、15 m/min、20m/min、25 m/min各10min的持续运动。力竭性训练:从第5周起进行递增负荷跑台运动,每天以15 m/min、20m/min、25 m/min各10min运动后加速至30m/min、35 m/min各20min运动,并不断递增跑速,直至大鼠力竭。力竭标准:连续予大鼠施加声、光、机械刺激后,大鼠不能跑动,下跑台后连续喘息,暂时无逃避反应。第6、7、8周做与此相同的训练。训练中动态观察大鼠的精神状态和饮食情况,从第5周开始,每天记录动物的跑距(m),每周末称量所有参试动物体重。第8周周末,运动后即刻断头处死全部动物。
1.3.2 大鼠心肌线粒体的制备 大鼠断头处死后,立即取心脏,剪取心室肌,置于预冷的分离介质中(0.125 mol/L sucrose、0.101 mol/L Tris-HCL,pH 7.4),洗去血液,充分剪碎、匀浆,采用差速离心法分离线粒体,即首先以700×g离心7 min,弃沉淀,上清经10000×g离心10min,弃上清,用分离介质悬浮沉淀,以同样高速离心1次,沉淀以分离介质悬浮即制成线粒体悬液,以上操作均在0℃~4℃进行。极谱式氧电极法测定线粒体耗氧速率以确定其纯度。蛋白定量采用Bradford法,线粒体用量根据其蛋白含量决定。
1.3.3 线粒体PTP开放的检测 (1)紫外分光光度仪检测参照Sarah等[5]的方法,用分光光度仪检测在540nm处的线粒体吸光度(A540nm)的变化来测定PTP开放。反应体系:0.12 mol/L surose,10mmol/L Tris-Mops,pH 7.4,5 mmol/L succinate-Tris,1 mmol/L Pi-Tris,10μmol/LEGTA-Tris,2μmol/L rotenone,1 mg/L oligomycin;线粒体用量为0.15 g/L蛋白浓度;反应温度为25℃恒温;终体积为2 ml。反应开始,加入线粒体,记录其在540nm处的初始吸光度值(A0),1 min后加入150μmol/L CaCl2,记录其在15 min内吸光度的变化(△A)。△A值的升高或下降分别代表PTP开放程度的降低和增加。(2)荧光分光光度仪检测参照 Fontaine等[6]的方法,用荧光分光光度仪检测线粒体膜电位改变来测定PTP开放,反应体系同上。取 1 mg线粒体,用 0.12μmol/L Rh123培育5 min后,在F-4500荧光分光光度仪上立即检测体系中Rh123的荧光强度(激发波长为488 nm,发射波长为525 nm),记录为 F 0、1 min后再加入150μmol/L CaCl2,记录其在15 min内荧光强度的变化(△F)。△F值的升高或降低,分别表示PTP开放程度的下降和增加。
1.3.4 心肌线粒体谷胱苷肽(glutathione,GSH)含量的测定采用电化学法,钴酞箐(COPC)修饰电极及高压液相色谱联用[7]。
1.3.5 心肌线粒体膜磷脂酶A2(phospholipase A2,PLA2)活性测定参考文献[8],用高灵敏度pH计(PX-215型)离子活度计测定消耗盐酸的量来计算PLA2的活力。
1.3.6 线粒体丙二醛(malondialdehyde,MDA)的测定采用硫代巴比妥酸缩合法,试剂盒由南京建成生物工程研究所提供。
1.4 统计学分析
应用SPSS 15.0软件进行统计学分析,各组数据以均数±标准差()表示,方差分析比较组间显著性差异。
2 结果
2.1 心肌线粒体PTP开放的变化
OG组与G OG组相比,线粒体在540nm处的初始吸光度值(A0)显著下降(P<0.05)。线粒体在15 min内的吸光度变化(△A)与 G OG组比较,OG组显著降低(P<0.05)。OG组线粒体Rh123的初始荧光强度(F0)与 G OG组比较,显著增强(P<0.05)。加入150μmol/L CaCl2后,OG组 △F值与 G OG组比较,明显降低(P<0.05)。G OG组与CG组比较,无显著差异(表1)。
Tab.1 Changes of the opening of PTP in myocardial mitochondrial membrane(,n=10)

Tab.1 Changes of the opening of PTP in myocardial mitochondrial membrane(,n=10)
A:Absorbance;F:Fluorescence;PTP:Permiability transition pore*P<0.05vsG OGgroup
Group A0 △A F0 △F C G 108±45 52.40±0.31 361.67±75.38 174.51±46.34 G OG 114±48 51.32±0.26 371.70±75.26 163.44±48.11 O G 65±31* 20.89±0.18* 535.32±104.80* 89.28±29.75*
2.2 心肌线粒体MDA、GSH含量和PLA2的活性
与G OG组比较,OG组MDA含量明显升高(P<0.05),线粒体 GSH含量下降,PLA2活性显著增加(P<0.05)。G OG组与CG组比较,无显著差异(表2)
Tab.2 Changes of the MDA and GSH contents and PLA2activity in myocardial mitochondrial membrane(,n=10)
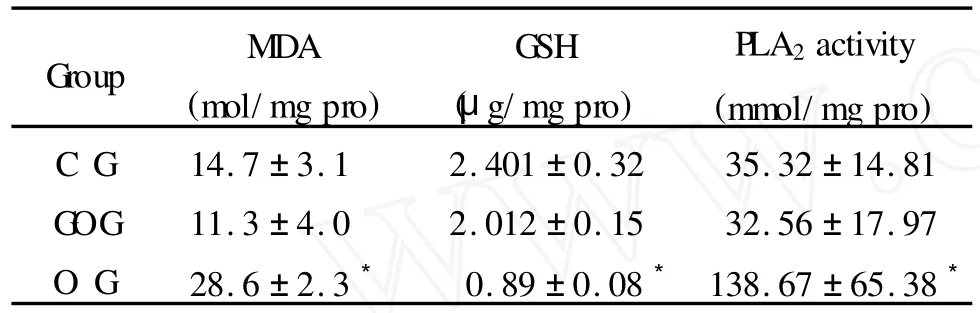
Tab.2 Changes of the MDA and GSH contents and PLA2activity in myocardial mitochondrial membrane(,n=10)
MDA:Malondialdehyde;GSH:G lutathione;FLA2:Phospholipase A2*P<0.05vsG OGgroup
3 讨论
谷氨酰胺(glutamine,G ln)是血液中和体内游离氨基酸池中含量最丰富的游离氨基酸,具有维持体内酸碱平衡、保持小肠黏膜上皮的结构和功能、维持组织中抗氧化剂的贮备、增强免疫功能等重要作用。同时,G ln又是组织间作为氨前体的穿梭工具,是蛋白质合成的重要调节剂及肾脏产氨的重要物质。另外,G ln是一个生糖氨基酸,可以提供碳链氧化分解释放能量。G ln作为体内含量非常丰富的一种氨基酸,尚具有许多重要的生理功能,它能促进胃肠粘膜细胞增生,维持肠道的完整性,而巨噬细胞的吞噬作用、淋巴细胞的增殖以及蛋白质的合成作用,都必需依赖充足的G ln。机体在运动过程中体内产生大量自由基,对膜性结构造成损伤,影响运动能力。谷胱甘肽(glutathione,GSH)是体内的重要保护因子,可以保护巯基酶的活性,可以在谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)催化下,保护生物膜及生物大分子免受氧化损伤。而 G ln可增加 GSH合成而保护细胞膜免受自由基的损害。增加G ln不但能增加细胞膜的稳定性,更重要的能增加细胞的GSH含量,减少氧自由基对机体膜性结构的损害。
线粒体膜通透性转换孔(permeability transition pore,PTP)是位于线粒体内外膜间由多个蛋白组成的复合孔道,目前认为该复合体至少由胞浆的己糖激酶、外膜的外周苯二氮卓受体、电压依赖性阴离子通道等组成[2]。正常情况下,PTP可逆性的低水平开放可维持线粒体跨膜电位,其作用是传递电信号和钙信号,一旦在多种死亡信号的刺激下,PTP发生大量持续开放,则引起线粒体内膜通透性急剧增加,使得一些正常不能通过内膜的物质(分子量<1500D)可以自由透过内膜,从而继发线粒体膜去极化、氧自由基(oxygen free radical,OFR)过量生成、基质渗透性肿胀及凋亡效应蛋白释放等一系列细胞学效应,致使细胞凋亡的发生[3]。
有关PTP开放的检测,目前在整体水平采用较多的是分光光度法,通过测定PTP开放所引起的线粒体状态的变化来反映PTP的开放。为保证测定结果的可靠性,本研究根据PTP开放的两个特征性改变-线粒体膜肿胀与膜电位下降,线粒体肿胀可表现为A540nm值下降,利用紫外和荧光分光光度法两种方法分别检测了过度训练对大鼠心肌线粒体PTP开放的影响。研究结果显示,OG组与CG组和G OG组比较,线粒体在540nm处的初始吸光度值(A0)显著下降(P<0.05),表明过度训练可导致线粒体PTP开放增加,而 G ln对这种变化有明显干预作用。Ca2+为一种常用的 PTP开放诱导剂,Ca2+诱导后PTP的变化能力反映了线粒体PTP的初始状态;将心肌细胞线粒体直接置于Ca2+浓度高达150μmol/L的体系中,发现线粒体在15 min内的吸光度变化(△A)与CG组和 G OG组比较,OG组显著降低(P<0.01)。PTP开放还可导致线粒体膜电位下降甚至消失。Rh123为正电性荧光染料,正常情况下,线粒体存在内负外正膜电位,Rh123积聚于线粒体内,当PTP开放引起线粒体膜电位消失,储积在线粒体内的Rh123释放出来,造成线粒体内荧光强度降低,而测试介质内荧光强度增高。结果显示OG组线粒体Rh123的初始荧光强度(F0)与CG组和 G OG组比较,显著增强(P<0.05);加入150μmol/L CaCl2后,OG组△F值与CG组和 G OG组比较,明显降低(P<0.05)。这些结果皆表明过度训练可导致线粒体PTP开放增加,而补充外源性的 G ln对PTP开放有显著的干预作用。
为探讨PTP开放和G ln干预作用的可能机制,本研究还观察了运动后心肌线粒体丙二醛(malondialdehyde,MDA)、谷胱甘肽(glutathione,GSH)GSH和磷脂酶A2(phospholipase A2,PLA2)等生化指标的变化。结果显示,运动后OG组与 G OG组和CG组比较,线粒体 GSH含量显著降低(P<0.05),PLA2活性显著增加(P<0.05);MDA含量显著升高(P<0.05)。过度训练后MDA含量明显增加,表明训练后心肌线粒体氧自由基生成和脂质过氧化水平增加了,因为脂质过氧化反应产物MDA含量变化可作为评定自由基生成及膜脂质双层结构破坏的指标。由此看来,过度训练后线粒体氧自由基生成增加可能是诱导PTP开放的重要因素之一,因为内源性自由基的存在可以攻击膜蛋白巯基,致使膜蛋白发生交联,导致线粒体膜PTP开放增加[4]。GSH作为细胞中最丰富的非蛋白巯基的来源,维持线粒体内膜巯基基团的还原状态,线粒体 GSH的含量对线粒体膜PTP开放起着重要的调节作用。当线粒体 GSH含量处在较高水平时,线粒体PTP处于稳定状态。当线粒体 GSH含量排空时、线粒体内膜PTP开放增加[7]。巯基氧化作用对增加PTP开放是必需的,但不是唯一的,过度训练后心肌线粒体活性氧生成增加,活性氧及其脂质过氧化反应的产物MDA也可直接增加PLA2的活性,而PLA2的激活可使PTP开放增加。这是因为PLA2活性增加,可导致膜磷脂的降解加快,其降级产物溶血磷脂、白三烯、前列腺素可促进细胞膜及亚细胞结构降解,增加膜的刚性和对钙的通透性。本研究结果显示,过度训练后大鼠心肌线粒体GSH含量显著下降和PLA2的活性明显增加,这可能是导致过度训练后心肌线粒体膜PTP开放增加的又一诱发因素。而G ln作为体内含量最丰富的游离氨基酸[9],对细胞膜的稳定性具有广泛的保护作用,它可通过增加GSH合成速度而增加细胞GSH的储量,这对保护细胞膜免受自由基的损害,遏制PLA2活性增加和Ca2+积聚等方面具有重要意义。总之,关于PTP开放机制的问题是一个相当复杂的问题,很多问题尚未完全阐明,尚需进一步研究。
[1]Waczulikova I,Habodaszova D,Cagalince M,et al.Mitochondrial membrane fluidity,potential,and calcium transients the myocardium from acute diabetic rats[J].Can J Physiol pharmacol,2007,85(3-4):372-381.
[2]Bernardi P,Forte M.The Mitochondrial permeability transition pore[J].Novartis Found Symp,2007,287:157-164.
[3]Tamura T,Said S,Lu W,et al.Is apoptosis present in progression to chronic hypertensive heart failure[J].J Card Fail,2000,6(1):37-42.
[4]刘铁民,许豪文.过度训练对大鼠心肌组织损害的实验研究[J].中国体育科技,2003,39(2):31-34.
[5]Berman S B,Watkins S C,Hastings T G.Quantitative biochemical and ultrastructural comparison of mitochondrial permeability transition in isolated brain and liver mitochondria:evidence for reduced sensitivity of brain mitochondria[J].Exp Neurol,2002,164(2):415-425.
[6]Fontaine E,Eriksson O,Ichas F,et al.Regulation of the permeability transition pore skeletal muscle mitochondria[J].Biol Chem,1998,273(20):12662-12668.
[7]曾贵云,徐向伟,刘厚孝.心衰的实验模型[J].药学学报,2002,37(7):579-585.
[8]陈思锋,吴中立.体液和组织磷脂酶A2简便快速测定法[J].第2军医大学学报,1989,10(3):54-57.
[9]Furst P,Pogan K,Stehle P.G lutamine dipeptides in clinical nutrition[J].Nutrition,1997,13(7-8):731-737.
