重组人凝血因子VIII表达质粒的构建及其在HepG2细胞中的表达*
2012-05-24解金辉李双玉种靖慧闫莉娜刘运德袁玉华
赵 倩,解金辉,李双玉,董 磊,种靖慧,闫莉娜,刘运德,袁玉华
(1.天津医科大学医学检验学院,天津 300203;2.天津市血液中心,天津 300110)
血友病A是由于遗传性凝血因子VIII(FVIII)基因缺陷,造成血浆凝血因子VIII含量不足或功能缺陷,引起的一组终身出血的凝血障碍性疾病。凝血因子VIII是治疗血友病的唯一有效用药,它的生产原料就是血浆,而血浆的严重不足造成了目前凝血因子VIII一药难求的局面,也造成了有些患者不治而亡。
血友病A的治疗主要包括血浆来源的凝血因子VIII(plasma-derived FVIII,pdFVIII)和重组凝血因子VIII(recombinant FVIII,rFVIII)制剂。目前国内对血友病A的治疗仍以血浆凝血因子VIII浓缩剂为主,但有感染病毒性肝炎及艾滋病等传染性疾病的危险[1]。由于rFVIII在生化、免疫、凝血活性及药物动力学等方面与pdFVIII无明显差别[2],但在纯度、抗原性、安全性、无自身血源性病毒感染等方面具有pdFVIII无法比拟的优点,因此展示了良好的应用前景。面对目前国内凝血因子VIII的短缺,为了避免潜在的血液来源的病毒传染,利用基因工程生产rFVIII成为解决其短缺的一个重要方法。本研究通过利用基因克隆技术,以BDDhFVIII为目的片段构建重组真核表达质粒,并观察其在HepG2细胞中的分泌表达。
1 材料与方法
1.1 材料
含有B区缺失型(△760aa-1639aa)人凝血因子VIII基因片段的pCI-neo-BDDhFVIII质粒由上海血液学研究所王鸿利教授惠赠。HepG2细胞为本实验室保存,限制性内切酶(Nhe I,Xho I)和T4 DNA连接酶购自Fermentas公司,Fast pfu DNA高保真酶、E.coli DH 5α感受态细胞、质粒提取试剂盒和DNA凝胶回收试剂盒购自北京全式金生物技术有限公司,Ni-NTA琼脂糖凝胶购自北京瑞达恒辉科技发展有限公司,pcDNA4/v5-his载体、TrypLETMExpress和 Zeocin购自美国Invitrogen生物公司,DMEM和FBS购自Thermo公司,mouse anti-His IgG和Goat anti-mouse IgG-HRP购自北京中杉金桥生物技术有限公司,引物由上海英骏合成。
1.2 目的基因BDDhFVIII的扩增
参照GenBank的人凝血因子VIII基因序列(M14113.1),采用Primer 5.0软件设计引物并加入限制性内切酶位点及保护碱基(Tab.1)。上游引物在5′端加了Nhe I限制性酶切位点和6个组氨酸,下游引物在5′端加了Xho I限制性酶切位点。以pCI-neo-BDDhFVIII为模板扩增目的片段,扩增产物的大小为4.4 kb。PCR扩增体系为:PCI-neo-BDDhFVIII 1μl,5 ×Buffer 10μl,dNTP(2.5 mmol/L)5μl,上游引物(10μmol/L)2μl,下游引物(10μmol/L)2μl,MgSO4(50mmol/L)1μl,Fast Pfu(2.5 U/μl)1μl,加 ddH2O至50μl。PCR反应循环条件为:95℃预变性5 min,95℃40s、62℃40s、72℃2 min,共 30个循环,最后72℃延伸5 min。PCR产物经 0.7%琼脂糖凝胶电泳进行鉴定,回收目的基因片段。

Tab.1 Sequence of the primers
1.3 重组真核表达质粒的构建及鉴定
PCR扩增产物和pcDNA4/v5-his空载体分别用Nhe I和Xho I双酶切,0.7%琼脂糖凝胶电泳,切胶回收后T4 DNA连接酶将目的片段BDDhFVIII定向连接于真核表达载体pcDNA4/v5-his中。取连接产物转化E.coli DH 5α感受态细胞,经含氨苄霉素(100mg/ml)的LB培养基筛选,挑取单克隆行菌落PCR,并抽提重组质粒进行限制性酶切鉴定及送单克隆菌落至上海英骏公司测序。
1.4 Zeocin筛选浓度的确定
用胰酶消化处于对数生长期的HepG2细胞,并以1×105cells/ml每孔接种于 96孔培养板内,每孔200μl,在各孔中加入不同浓度梯度的Zeocin(e.g.50,100,200,300,400,500μg/ml),一式两孔 。每2天换液,观察细胞生长状态及存活率,连续培养14 d,挑选HepG2细胞恰好死亡的Zeocin的浓度即为Zeocin的筛选浓度。
1.5 重组表达质粒的转染
采用电转介导重组真核表达质粒转染HepG2细胞。转染当天收集HepG2细胞加入无抗生素含10%FBS的DMEM 培养基制成细胞悬液,取30μl细胞悬液加入1μl纯化的连接液,冰上放置60s后,将混合液加入预冷的电击杯,BioRod电转化仪,0.1电转化杯,1 Kv,5 ms,电击。向电转化杯加入500μl含10%FBS且无抗生素的DMEM 培养基,将混合液洗出,加于24孔板的细胞悬液中,37℃、5%CO2、饱和湿度下培养 。取 1μl pcDNA4/v5-his空载体转染HepG2细胞作为对照组步骤同上。转染后48 h,加入Zeocin筛选阳性细胞,每2~3天换液一次,继续培养扩增,直至细胞扩增达到可以移至25 ml的培养瓶中进行传代培养。
1.6 Ni-NTA纯化及Western blot检测
分别收集24h,48 h,96 h及144h重组真核表达质粒pcDNA4/v5-his-BDDhFVIII转染组HepG2细胞培养液,经7%SDS-聚丙烯酰胺凝胶电泳,湿转,然后分别结合对应一抗(anti-His鼠源单克隆抗体,1∶1000稀释)及二抗(Goat anti-mouse IgG-HRP,l∶2500稀释),暗室曝光。结合 Western blot图选取重组蛋白分泌最多的时间点,收集该时间点重组真核表达质粒 pcDNA4/v5-his-BDDhFVIII转染组及空载体pcDNA4/v5-his转染组HepG2细胞培养液进行Ni-NTA 纯化 ,10mmol,20mmol,250mmol咪唑梯度洗脱,结合在Ni-NTA柱上的重组蛋白经250mmol咪唑洗脱三次并留样(Elution 1,Elution 2,Elution 3)。纯化样本变性后Western blot检测,步骤同上。
2 结果
2.1 目的基因的扩增
以含有BDDhFVIII的重组质粒PCI-neo为模板,Fast pfu DNA高保真酶扩增含有Nhe I、Xho I双酶切位点及 6×His标签的目的片段,将PCR产物在0.7%的琼脂糖凝胶中电泳,可见一条长约4.4 kb的条带,与预期结果一致(图1)。
2.2 重组真核表达质粒的构建及鉴定
PCR产物及pcDNA4/v5-his空载体经Nhe I和Xho I双酶切及胶回收,T4 DNA连接酶16℃连接过夜。取连接产物转化E.coli DH5α感受态细胞,经氨苄青霉素LB平皿筛选,选取单克隆菌落摇菌提质粒。重组质粒经Nhe I或Xho I单酶切可见一条长约9.5 kb的条带,Nhe I、Xho I双酶切可见4.4 kb和5.1 kb两条带(图2A)。送阳性克隆株进行测序,结果与GenBank报道序列完全一致(见图2B)。酶切及测序正确的重组真核表达质粒命名为pcDNA4/v5-his-BDDhFVIII。

Fig.1 Analysis of PCR product of BDDhFVIII

Fig.2 Identification of recombinant plasmid pcDNA4/v5-his-BDDhFVIII
2.3 Zeocin筛选浓度的确定及重组真核表达质粒的转染
HepG2细胞选取的Zeocin浓度为 300μg/ml,该浓度培养条件下细胞在第14天时恰好完全死亡。重组表达质粒 pcDNA4/v5-his-BDDhFVIII及空载体pcDNA4/v5-his电转染HepG2细胞后,HepG2细胞的培养条件为未加筛选抗生素的含10%(v/v)FBS的DMEM培养液,在37℃、5%CO2饱和湿度下培养。转染48 h后加入300μg/ml的Zeocin和10%P/S。
2.4 采用Ni-NTA纯化及Western blot检测
从pcDNA4/v5-his-BDDhFVIII转染组24h,48 h,96 h及144h HepG2细胞培养液Western blot结果(图3A)可见96 h细胞培养液中,大小约为160kD的重组蛋白分泌最多,而144h时重组蛋白出现了部分降解。故收集96 h重组表达质粒pcDNA4/v5-his-BDDhFVIII转染组及空载体pcDNA4/v5-his转染组HepG2细胞培养液进行Ni-NTA纯化,纯化样本变性后Western blot检测如图3B,可见pcDNA4/v5-his-BDDhFVIII转染组细胞培养液Ni-NTA纯化后条带明显比未纯化的HepG2细胞培养液的条带浓重。且洗脱液2(Elution 2)是最亮的,而空载体pcDNA4/v5-his转染组未见条带。
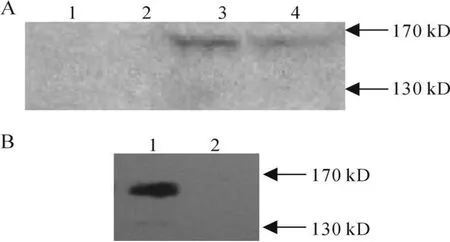
Fig.3 Expression of BDDhFVIII in transfected HepG2 cells detected by Western blot
3 讨论
凝血因子VIII在血浆中的含量极微并且分离纯化的难度极大,其基因和蛋白结构一直是人们试图着手之处,直到Gitschier和Wood等在1984年首先采用蛋白分离纯化技术完成了人凝血因子VIII cDNA全长的克隆和测序工作,并在体外培养的COS细胞中获得低水平表达,凝血因子VIII的重组表达就成为了人们研究的热点。野生型人凝血因子VIII cDNA大约为7 kb,根据其内部序列的同源性分成3个A区、1个B区和2个C区,排列成A1-A2-B-A3-C1-C2结构[3,4]。B 区(约 3 Kb)在凝血因子 VIII的活化过程中被全部切除,缺失型凝血因子VIII与野生型凝血因子VIII具有相同的生物学特性,凝血酶酶切产物、凝血酶活化效率、和vWF的结合能力与野生型之间也没有区别,却解决了载体包装容量的限制,且表达产物的结构更为简单[5-7]。
过去的20年中,可观的临床实验结合市场调查研究充分表明rFVIII制剂用于临床治疗出血或预防出血发作的安全性和高效性[6,8]。rFVIII制剂是目前血友病A治疗的研究方向,并且已经成为大多数血友病治疗中心对血友病A患者治疗的首选药物[9]。面对国内凝血因子VIII的短缺,进口rFVIII的昂贵,同时为了避免潜在的血液来源的病毒传染,现阶段研发生产凝血因子VIII有着积极的意义。
His-Tag融合蛋白是目前最常见的表达方式,而且很成熟,它的优点是表达方便而且基本不影响蛋白的活性,并可以用固定金属离子亲和色谱法(IMAC)纯化。金属镍可与6个组氨酸特异性结合,并可被含不同浓度咪唑的洗脱缓冲液所洗脱,故采用镍结合柱对收集的细胞培养液进行过柱吸附并洗脱以达到纯化的目的。由于上游引物设计时加了6个组氨酸,这就使重组蛋白N端带上了His-Tag。凝血因子VIII是个微量的胞外分泌蛋白,收集细胞培养液经Ni-NTA纯化就增加了其可检测性。同时由于融合表达产物中含有His-Tag,故选择anti-His单克隆抗体作为一抗,使实验更经济可行。pcDNA系列载体被广泛应用于真核表达质粒的构建及其后续功能研究中,该载体含有一个位于起始密码子上游的高效翻译增强子,可以明显提高转录效率而增加重组蛋白的产量,为体外大量获得rFVIII提供了可能。
由于凝血因子VIII高表达于肝脏,所以选择了肝组织细胞HepG2进行重组蛋白的表达。pcDNA4/v5-his-BDDhFVIII经酶切及测序显示其序列无误,而且转染细胞后,细胞培养液未纯化与经Ni-NTA纯化后在160KD处均可见条带,而空载体pcDNA4/v5-his转染组在160KD处未见条带,从而证实pcDNA4/v5-his-BDDhFVIII重组真核表达质粒成功转染了HepG2细胞。经过Zeocin的筛选HepG2细胞持续表达重组蛋白,故成功构建了表达BDDhFVIII的稳定细胞系,从而为后续进一步研究凝血因子VIII奠定了实验基础。
[1]Ponder K P.Gene therapy for hemophilia[J].Curren Opin Hematol,2006,13(5):301-307.
[2]Pipe S W.Recombinant clotting factors[J].Thromb Haemost,2008,99(5):840-850.
[3]Shen B W,Spiegel P C,Chang C H,et al.The tertiary structure and domain organization of coagulation factor VIII[J].Blood,2008,111(3):1240-1247.
[4]Ngo J C,Huang M,Roth D A,et al.Crystal structure of human factor VIII:implications for the formation of the factor IXa-factor VIIIa complex[J].Structure,2008,16(4):597-606.
[5]Musso R.Efficacy and safety of recombinant factor VIII products in patients with hemophilia A[J].Drugs Today(Barc),2008,44(10):735-750.
[6]Saenko E L,Ananyeva N M,Moayeri M,et al.Development of improved factor VIII molecules and new gene transfer approaches for hemophilia A[J].Curr Gene Ther,2003,3(1):27-41.
[7]Gan S U,Calne R Y.Gene therapy for hemophilia A[J].Discov Med,2006,6(35):198-202.
[8]Shapiro A,Gruppo R,Pabinger I,et al.Integrated analysis of safety and efficacy of a plasma-and albumin-free recombinant factor VIII(rAHF-PFM)from six clinical studies in patients withhemophilia A[J].ExpertOpin Biol Ther,2009,9(3):273-283.
[9]Batlle J,Villar A,LirasA,et al.Consensus opinion for the selection and use of therapeutic products for the treatment of haemophilia in Spain[J].Blood Coagul Fibrinolysis,2008,19(5):333-340.
