猪繁殖与呼吸综合征病毒GP5蛋白在酿酒酵母中的定位研究
2012-05-21李能章邱荣蓉黄园媛邹灵秀彭远义
李能章,邱荣蓉,黄园媛,邹灵秀,彭远义*
(1.西南大学动物科技学院,重庆 400716;2.重庆理工大学药学与生物工程学院,重庆 400054)
猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)是一种有囊膜的单股正链RNA病毒,主要侵染猪肺部和淋巴组织中的巨噬细胞和树突状细胞[1]。病毒在细胞中大量复制组装,破坏宿主细胞原有细胞结构,导致这些细胞功能丧失从而使整个机体免疫功能下降[2-3]。不同病毒对细胞结构破坏程度差异决定了感染细胞最终命运。现有研究认为,囊膜病毒的囊膜来源于宿主细胞的各种膜,但不同病毒形成最终病毒粒子时获取囊膜的位置存在差异。PRRSV囊膜来源于宿主细胞内膜成分,但具体来源于细胞哪部分膜,目前并不清楚。因此,研究病毒获取囊膜的位置,对了解该病毒在宿主细胞中装配的时空区域有着重要意义。本研究选择PRRSV囊膜蛋白GP5作为一种指示蛋白,通过其在酿酒酵母中的表达定位来间接反映PRRSV在感染细胞中获取囊膜的可能位置。
1 材料和方法
1.1 主要实验材料 含PRRSVgp5基因的pMD-gp5重组质粒、E.coliDH5a菌株、酿酒酵母菌株CEN.PK2及定位表达载体pUG35(带有gfp基因)均由本实验室保存;pMD19-T Simple载体、BamHⅠ、SalⅠ、ExTaqDNA聚合酶、DNA Ligation Kit ver 2.1购自TaKaRa公司;无氨基酸酵母氮源YNB购自生工生物工程(上海)有限公司;Yeast Synthetic Drop-out Medium Supplements without uracil(Y1501)和多种氨基酸购自Sigma公司。
1.2 gp5基因重组表达质粒的构建 将gp5基因克隆到酿酒酵母表达载体pUG35中gfp基因上游位置,构建gp5-gfp融合基因重组表达质粒pUG-gp5-gfp,重组质粒经双酶切及测序验证其正确性。
1.3 基因重组酿酒酵母筛选[4-5]将测序验证正确的pUG-gp5-gfp采用ApaⅠ线性化处理,纯化回收后,电击导入酿酒酵母CEN.pk2细胞中,涂布于尿嘧啶营养缺陷培养基进行阳性重组酵母筛选,PCR方法进行确证。
1.4 gp5基因在酿酒酵母中表达的定位检测[4-5]挑取阳性重组酵母到甲硫氨酸营养缺陷培养基中进行诱导培养,取诱导培养酵母细胞荧光显微镜观察,获取gp5-gfp融合基因在酵母中的表达和定位信息。
2 结果与讨论
2.1 PRRSVgp5基因重组酵母表达质粒的鉴定取PRRSV的gp5基因重组质粒pMD-gp5和酿酒酵母表达质粒pUG35分别用BamHⅠ和SalⅠ双酶切,回收纯化目的片段连接转化E.coliDH5α,筛选得到酵母重组表达质粒pUG-gp5-gfp,该重组质粒经BamHⅠ/SalⅠ酶切鉴定出现一条约600 bp的片段(图1),重组表达质粒测序结果表明: PRRSVgp5基因正确插入到pUG35载体中GFP基因的上游位置,形成融合基因gp5-gfp。gp5基因为PRRSV完整ORF5,该基因表达蛋白具有信号肽序列,一旦该融合基因在酵母细胞中获得表达,融合蛋白中的GP5部分具有的信号肽可以引导整个融合蛋白到相应的细胞位置,而其GFP部分具有荧光性质,可以通过荧光显微镜进行观察,因此细胞中观察到的GFP蛋白荧光强度和位置就反映了GP5蛋白在细胞内的表达情况和其定位位置。
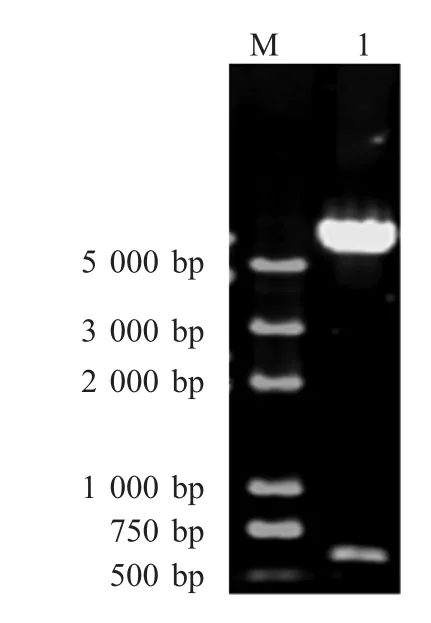
图1 重组酵母表达质粒pUG-gp5-gfp的双酶切鉴定Fig.1 Enzyme digestion analysis of yeast expression plasmid pUG-gp5-gfp
2.2 gp5基因在酿酒酵母中的表达、定位检测 对重组酵母表达质粒pUG-gp5-gfp和空载质粒pUG-gfp分别采用ApaⅠ酶线性化后,电击导入酿酒酵母CEN.PK2感受态细胞中,通过尿嘧啶缺陷培养基进行筛选培养,获得重组酵母pUG-gp5-gfp/CEN.PK2和pUG-gfp/CEN.PK2。由于酿酒酵母CEN.PK2为尿嘧啶缺陷型菌株,因此在尿嘧啶缺陷培养基中生长出来的酵母菌落均为重组酵母,没有转入目的质粒的酵母细胞在尿嘧啶缺陷培养基上不能生长。
挑取重组酵母接种到甲硫氨酸缺陷培养基进行诱导培养,30℃220 r/min振荡培养4 h,取培养物直接进行荧光显微镜观察,结果显示:表达GP5-GFP蛋白时,绿色荧光集中分布的位置与内质网和质膜的定位模式相一致(图2a-c)[6],而单独表达GFP蛋白时,绿色荧光均匀分布于整个细胞质中,无特定的定位位置(图2d-f)。该结果表明gp5基因在酿酒酵母中获得了表达,所表达蛋白能够定位到细胞的内膜上,其定位内质网和质膜的特性间接反映了PRRSV在宿主细胞中最终获取囊膜的位置,进而印证了PRRSV在未破裂的感染细胞中存在有完整病毒粒子[7]。同时这种定位研究模式可以为其他病毒的各个成分在宿主细胞中的组装位置研究提供新的思路,进而为提出新的病毒控制方法。
gp5基因诱导表达时显示,所筛选的重组酵母在4℃处理7 d以上或通过两次-80℃冻存后,重新活化的酵母菌进行诱导培养后荧光显微镜观察,其荧光强度要比不经处理的酵母菌荧光强度大;同时,初始接种量及诱导培养时间长短对融合荧光蛋白表达也有非常大的影响,初始接入酵母细胞后的液体培养基OD600nm值为0.6~0.8,诱导培养4 h时进行荧光观察最好,这时,具有荧光的酵母细胞多,荧光较强,而增加诱导时间,则具有荧光的酵母细胞减少,荧光强度减弱。
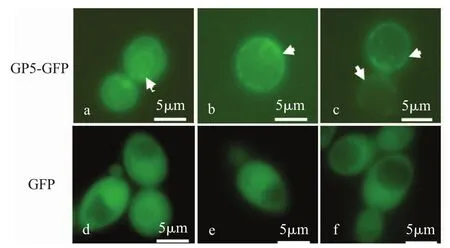
图2 gp5-gfp融合基因在酿酒酵母中的表达及融合蛋白在细胞中的定位Fig.2 Expression and cell localization of GP5 protein fusion with GFP in the Saccharomyces cerevisiae detected by fluorescence microscope
[1]Beyer J,Fichtner D,Schirrmeier H,et al.Porcine reproductive and respiratory syndrome virus(PRRSV):kinetics of infection in lymphatic organs and lung[J].J Vet Med B Infect Dis Vet Public Health,2000,47(1):9-25.
[2]Thanawongnuwech R,Halbur P G,Thacker E L.The role of pulmonary intravascular macrophages in porcine reproductive and respiratory syndrome virus infection[J].Anim Health Res Rev,2000,1(2):95-102.
[3]Murtaugh M P,Xiao Zheng-guo,Zuckermann F.Immunological responses of swine to porcine reproductive and respiratory syndrome virus infection[J].Viral Immunol,2002,15(4):533-547.
[4]Slamovits C H,Burri L,Keeling P J.Characterization of a divergent Sec61beta gene in microsporidia[J].J Mol Biol,2006,359(5):1196-1202.
[5]Ando A,Suzuki C.Cooperative function of the CHD5-like protein Mdm39p with a P-type ATPase Spf1p in the maintenance of ER homeostasis inSaccharomyces cerevisiae[J].Mol Genet Genomics,2005,273(6):497-506.
[6]Gagnon C A,Lachapelle G,Langelier Y,et al.Adenoviralexpressed GP5 of porcine respiratory and reproductive syndrome virus differs in its cellular maturation from the authentic viral protein but maintains known biological functions[J].Arch Virol,2003,148(5):951-972.
[7]Yan Ya-xian,Lu Ya-jun,Wang Heng-an,et al.Morphologic study on porcine reproductive and respiratory syndrome virus by electron microscopy[J].Chinese J Vet Science,2001,21(006):554-555.
