高/低侵袭转移性肺癌干细胞模型的建立
2012-05-17刘晓光乐涵波
曾 芳 刘晓光 乐涵波
近20年来,中国肺癌导致的死亡超过癌症总死因的20%,其发生率和病死率在我国男性居恶性肿瘤之首位,在女性仅次于乳腺癌居第2位[1]。虽然近年来肺癌的诊治水平有了明显进步,形成了以手术切除为主,化疗、放疗、各种介入治疗、免疫和中医药治疗为辅的综合治疗模式,但肺癌具有起病隐匿、潜伏期长、恶性高、进展快、侵袭性强、预后差、病死率高等特点,导致全球肺癌患者术后5年生存率仅15%[2]。其原因可能是肺癌干细胞(lung cancer stem cells,LTSCs)的存在。LTSCs成瘤能力极强,分化程度极低,是肺癌组织发生、发展、侵袭、转移、耐药、复发的基础和源头[3]。有学者提出LTSCs既是肺癌转移的“种子”,也是肿瘤侵袭和转移的主要承担者[4]。因此,人们推断肺癌是肺癌干细胞增殖和分化形成的肿瘤器官,肺癌干细胞的残存是肺癌复发的根源[5,6]。
目前开展LTSCs研究的首要问题就是分离鉴定。普遍的方法是采用Hoechst 33342染色干细胞,经流式细胞仪分选肺癌细胞系侧群(side population,SP)细胞的SP细胞分选技术,或者利用LTSCs特异性细胞表面分子标志CD133+/CD90+/EpCAM+等经磁珠或流式细胞仪分选LTSCs。然而这两种分选方法均存在自身局限性。SP法主要因为Hoechst染料的毒性,可能造成主群细胞自我更新能力及致瘤性低的假象。其次,分选后的SP细胞不能完全体现LTSCs的特性和活性,甚至不能在体外继续生长或体内成瘤。而采用细胞表面标志分离出来的LTSCs均一性不好,还可以细分成不同亚群,有些亚群的细胞根本不能成瘤,表明采用该方法筛选出来的不完全是LTSCs,或者是LTSCs存在着干性差别[7]。基于此,课题组设想建立一种高/低侵袭性肺癌干细胞(high/low invasion lung tumor stem cells,H/L-ILTSCs)模型,可以与目前的分选方法互为完善和补充,建立一种更加可靠的LTSCs。这对于LTSCs的机制研究及病理治疗均有重要的意义,为研究肺癌的侵袭和转移机制提供了新的思路。
材料与方法
1材料:(1)主要试剂:人小细胞肺癌细胞系NCI-H446购上海中科院典型培养物保藏中心。DMEM/F12(1∶1)培养基购自Gibco公司。RPMI-1640培养基购自天津润泰科技发展有限公司。胎牛血清(fetal bovine serum,FBS)购自Hy-Clone公司。Transwell小室购自coring公司。Matrigel胶购自BD公司。胰蛋白酶、MTT购自碧云天生物科技有限公司。NOD-SCID免疫缺陷裸鼠购自上海中科院实验动物中心。CD133、CD44磁珠及流式抗体分别购自Miltenyi及BD公司。(2)细胞培养:将NCI-H446细胞用RPMI-1640培养液培养,内含10%胎牛血清、青霉素100U/ml和链霉素100mg/L,置37℃,5%CO2环境下培养备用。
2.方法:(1)高/低迁移性的NCI-H446细胞的分离:取对数生长期NCI-H446细胞及未涂Matrigel胶的transwell小室,参照Tie等[8]文献操作。直接将NCI-H446细胞悬液加到上室,常规培养24h后,分别取出侵袭小室上、下室细胞。将穿过膜(下室)的细胞扩增培养后再次通过未涂Matrigel胶的transwell小室,获取迁移能力高的下室细胞;将未穿过膜(上室)的细胞扩增培养后再次通过未涂Matrigel胶的transwell小室,获取迁移能力低的上室细胞。如此反复10次后,分离得到高/低迁移能力的NCI-H446细胞。(2)高/低侵袭转移性的NCI-H446细胞的分离:取上述分离得到的对数生长期高/低迁移能力的NCI-H446细胞及涂有Matrigel胶的transwell小室。直接将高迁移能力的NCI-H446细胞悬液加到上室,常规培养24h后,取出侵袭小室下室细胞,获得高侵袭转移能力的NCI-H446细胞;将低迁移能力的NCI-H446细胞悬液加到上室,常规培养24h后,取出侵袭小室上室细胞,获得低侵袭转移能力的NCI-H446细胞。(3)H/LILTSCs、H/L-ILTSCs的分离:CD133、CD44为肺癌干细胞表面标志采用磁珠分选法。高侵袭转移性NCI-H446肺癌细胞筛选CD133+/CD44+细胞为高侵袭转移能力NCI-H446肺癌干细胞;低侵袭转移能力NCI-H446肺癌细胞筛选CD133+/CD44+细胞为低侵袭转移能力NCI-H446肺癌干细胞。参照Miltenyi公司试剂盒说明书,将高/低侵袭性NCIH446肺癌细胞计数,加入CD133、CD44等磁珠混匀,冰上放置30min后,加CD133/2(293C3)-PE、CD44-FITC染色孵育5min,进行磁珠分选后流式细胞仪上检测纯度。(4)H/LILTSCs的鉴定及侵袭转移特性分析:①MTT比色法检测HILTSCs、L-ILTSCs及NCI-H446细胞的生长增殖能力:收集对数生长期细胞,每孔加入200μl,铺板使待测细胞调密度103~104/孔。5%CO2,37℃ 孵育,过夜后在 3、6、12、18、24、30、36、42、48h等不同时间点,每个时间点设5个复孔。每孔加20μlMTT溶液(5mg/ml),继续培养4h,小心弃去孔内培养液。加入150μl二甲基亚砜,低速振荡10min,使结晶物充分溶解。在酶联免疫检测仪OD 490nm处测量各孔的吸光值。酶联免疫检测仪测定各孔的吸光度(A)值,以时间为横轴,A值为纵轴,绘制细胞生长曲线;②Transwell肿瘤侵袭实验分析H-ILTSCs、L-ILTSCs及NCI-H446细胞的侵袭转移能力:取分离得到的高/低侵袭转移能力的NCI-H446细胞及NCI-H446细胞,在侵袭小室上室加对数生长期细胞1×104个/毫升,用含0.5%胎牛血清DMEM/F12培养基培养。下室加入含10%胎牛血清DMEM/F 12培养基。每组细胞重复3个样本,常规培养48h后取出小室,擦去微孔膜上层细胞后结晶紫染色,显微镜下观察膜下层细胞并计数。采用结晶紫染色,计数5个视野下的平均穿膜数(%);③采用免疫缺陷动物成瘤能力对H-ILTSCs、L-ILTSCs及NCI-H446细胞进行鉴定:取对数生长期细胞及4~8周NOD-SCID免疫缺陷小鼠,按1∶1比例与Matrigel混合。皮下注射100μl。每周1次观察肿瘤生长状况,至肿瘤直径≥1cm或者观察期达4周时将小鼠断颈处死,观察各组小鼠有无肿瘤形成,摘取皮下肿瘤检查瘤体生长形态、直径、质地、活动度。
3.统计学方法:应用SPSS 13.0软件处理数据,实验结果用均数±标准差±s)表示,实验重复至少3次。两组资料均数比较采用t检验,多组均数比较采用单因素方差分析,P<0.05为差异有统计学意义。
结 果
1.H-ILTSCs、L-ILTSCs细胞的磁珠分选的纯度:H-ILTSCs、L-ILTSCs及 NCI-H446细胞CDl33+/CD44+细胞的比例分别为(94.85±2.62)%、(94.03±1.53)%、(9.48±2.14)%。其中H-ILTSCs、L-ILTSCs细胞 CDl33+/CD44+比例均高于培养的NCI-H446细胞,差异有统计学意义(P<0.01)。而 H-ILTSCs、L-ILTSCs细胞 CDl33+/CD44+比例没有差别(P>0.05)。故 H-ILTSCs、L-ILTSCs细胞的磁珠分选的纯度较高,达到了90%以上,见图1。
2.采用MTT法检测H-ILTSCs、L-ILTSCs的生长增殖能力:连续培养2天的吸光度值绘制生长曲线。MTT检测结果显示,随着时间的延长 HILTSCs、L-ILTSCs及NCI-H446细胞的吸光度值是逐渐增高的。在相同的时间内,H-ILTSCs的吸光度值较L-ILTSCs及NCI-H446细胞明显增高,显示更强的体外增殖能力,差异具有统计学意义(P<0.01)。而L-ILTSCs、NCI-H446细胞增殖速度相当,无明显差异(P>0.05)。因此,H-ILTSCs的细胞增殖能力很强,远高于L-ILTSCs和NCI-H446细胞,见图2。
3.采用transwell肿瘤侵袭实验鉴定H-ILTSCs、L-ILTSCs细胞的侵袭转移能力:取相同H-ILTSCs、L-ILTSCs细及NCI-H446细胞密度通过Transwell小室侵袭实验发现,H-ILTSCs、L-ILTSCs及NCIH446细胞镜下5个视野细胞平均穿膜数分别是402±40、42 ±3、59±4。H-ILTSCs的穿膜数是NCI-H446细胞的近7倍,是L-ILTSCs的近10倍,差异具有统计学意义(P<0.01)。而L-ILTSCs与NCI-H446细胞的平均穿膜数差异无统计学意义(P>0.05)。因此,H-ILTSCs的细胞侵袭转移能力最强,远高于L-ILTSCs和NCI-H446细胞,见图3。

图2 H-ILTSCs、L-ILTSCs及 NCI-H446细胞的生长增殖曲线
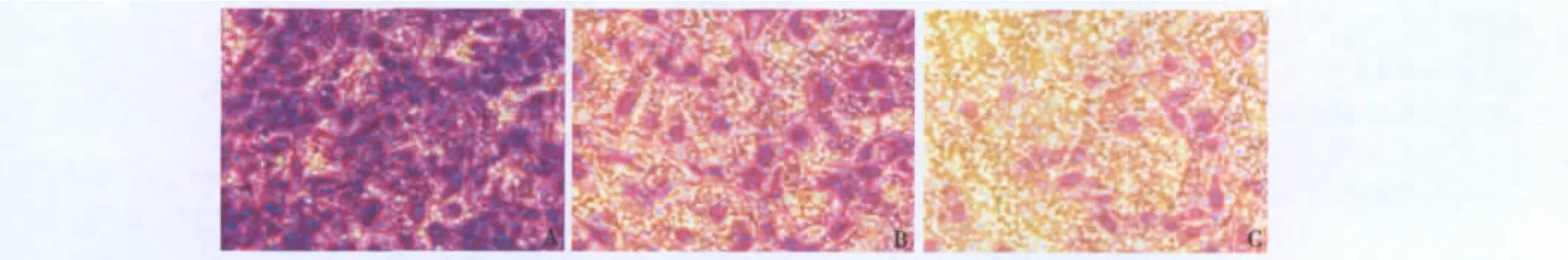
图3 Transwell侵袭实验比较H-ILTSCs、L-ILTSCs及NCI-H446细胞的侵袭转移能力(×400)
4.H-ILTSCs、L-ILTSCs细胞免疫缺陷动物成瘤能力鉴定:接种 H-ILTSCs、L-ILTSCs及 NCIH446细胞裸鼠在6周后可观察到形成明显的移植瘤,成瘤率100%。同样以5×105细胞数量接种的情况下,H-ILTSCs形成的移植瘤体积为2380.6±685.86mm,L-ILTSCs形成的移植瘤体积为2380.60±685.86mm,而NCI-H446细胞形成的移植瘤体积为354.40±67.62mm。因此,H-ILTSCs细胞形成的移植瘤体积大于L-ILTSCs及NCI-H446细胞的移植瘤体积(P<0.01),L-ILTSCs注射裸鼠形成的移植瘤体积与NCI-H446细胞无明显差别(P>0.05)。因此,H-ILTSCs相比L-ILTSCs细胞具有更强的干性特征,其裸鼠成瘤能力远高于L-ILTSCs及NCIH446细胞,见图4。
讨 论
LTSCs是肺癌研究领域的最新前沿,LTSCs的研究不但有助于了解肺癌的发生发展、复发转移,同时可能对肺癌的临床诊断及治疗带来重大突破。它为肿瘤研究开辟了一个新的视野,这将彻底地颠覆肿瘤的既往治疗策略。然而,LTSCs从标志物筛选、细胞分选到培养技术,从基本生物学特性、启动肿瘤发生、侵袭转移机制到检测和治疗意义,都还存在诸多科学问题亟待解决。
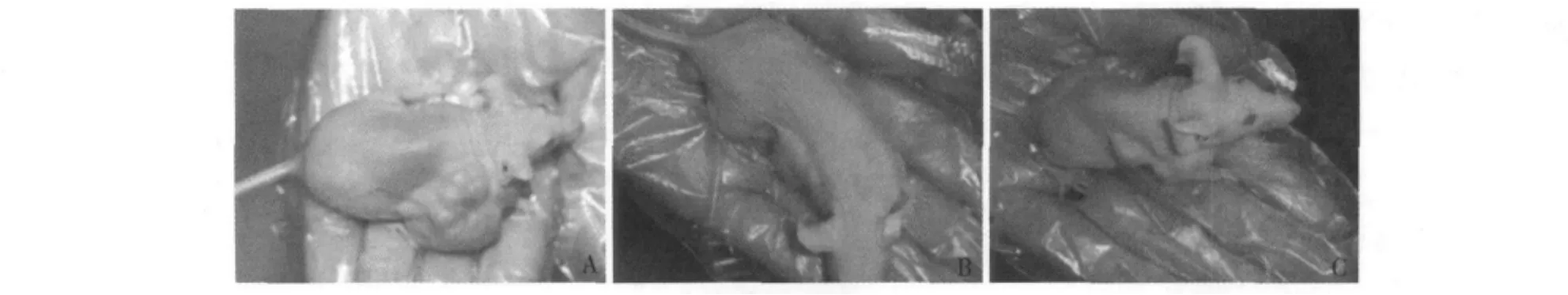
图4 H-ILTSCs、L-ILTSCs及NCI-H446细胞免疫缺陷动物成瘤能力比较(移植5×105细胞,6周)
我们知道,肿瘤侵袭和转移启动中的一个关键过程是上皮细胞—间质细胞转化(epithelial-mesenchymal transition,EMT),EMT以上皮细胞极性丧失并获得间质细胞表型和运动能力为特征,可调控肿瘤侵袭、转移,并可能诱导TSCs的形成。一些学者认为肿瘤转移不再是恶性肿瘤进展过程中的晚期事件,原位癌或未恶变的上皮细胞即有转移的能力[9]。Peter[10]证实成熟的上皮细胞和转化了的癌细胞经过EMT能够获得干细胞特性。Hermann等[11]进一步判断EMT过程中关键细胞可能是TSCs,完成这种转移的癌细胞实际上是转移性 TSCs或侵袭性 TSCs。Mani[12]也认为EMT可能使乳腺癌细胞同时具有转移和干细胞特性的通路,导致转移的肿瘤细胞在转移位置成长为肉眼可见的肿瘤。George等[13]采用原代培养及永生化的前列腺癌细胞系,经流式细胞仪通过CD44+等表面标志筛选前列腺癌细胞亚群,通过Matrigel肿瘤侵袭实验和NOD/SCID免疫小鼠体内成瘤能力证实CD44+前列腺癌细胞具有侵袭性,基因芯片分析侵袭性前列腺癌细胞具有干细胞基因组特征,属于前列腺TSCs。Hermann等[14]利用人胰腺癌细胞作为模型,用原代和永生化细胞系识别出了一小群类似于干细胞的肿瘤细胞,其表达CD133和趋化因子受体4(chemokinereceptor 4,CXCR4),当研究人员将这些细胞注射入小鼠中时,小鼠形成肿瘤并很快发生转移,说明CD133+和CXCR4+癌干细胞是肿瘤转移所必需的。陈宏昌等[15]发现 CK7-/CK20+/CEA+/SCCA-表达的UP-LN1癌细胞为TSCs,同时大量阳性表达CD133、ABCC1、ABCC4、ABCG2 等常见 TSCs标志,其表达CD133+和CXCR4+的TSCs具有侵袭和转移潜能,TSCs可被CXCR4诱导成为转移性TSCs。
因此,本课题组基于TSCs前期研究成果,首次提出“H/L-ILTSCs”的概念,认为这可能是肺癌发生远处转移的基础及源头。以H/L-ILTSCs为重点研究对象,揭示肺癌侵袭、转移、复发的源头,在研究思路和研究内容上具有创新性。那么,如何建立H/LILTSCs细胞模型呢?肿瘤侵袭和转移启动中的一个关键过程是上皮细胞-间质细胞转化(epithelialmesenchymal transition,EMT),EMT 是以上皮细胞极性丧失并获得间质细胞表型和运动能力为特征,可调控肿瘤侵袭、转移,并诱导TSCs的形成。Milena认为在肿瘤发展过程中,发生EMT改变的肿瘤细胞浸润、转移、成瘤能力均大为增强,并获得了干细胞特性。由上可知,分化成熟的上皮细胞和癌细胞能够通过EMT获得干细胞特性,反之,TSCs能否发生EMT而获得强大的运动能力从而决定肿瘤的侵袭和转移,这种疑问成为我们课题思路及技术实施的关键点。
据报道,CD133、CD44代表原始的、未分化的标志,可作为分选 LTSCs的侯选标志。选择 CD133、CD44细胞表面蛋白磁珠分选来识别和分离LTSCs。通过流式分析纯度发现NCI-H446细胞中CD133+/CD44+的细胞比例为(9.48±2.14)%,远低于分选出来的CD133+/CD44+细胞比例为90%以上的H/L-ILTSCs。在transwell侵袭实验中,发现高度表达CD133+/CD44+的H-ILTSCs侵袭能力明显高于L-ILTSCs及原肺癌细胞NCI-H446。
本实验阐明H-ILTSCs的生长增殖,侵袭转移及成瘤能力均高于L-ILTSCs及NCI-H446细胞。而L-ILTSCs的生长增殖,侵袭转移及成瘤能力与NCI-H446没有显著差别。提示NCI-H446细胞中可以分离和富集H/L-ILTSCs。课题组建立了一种更为可靠的H/L-ILTSCs模型,且二者存在着干性差别。
肿瘤的恶性程度与其细胞的生物学特性密切相关,恶性程度越高的肿瘤细胞体外生长增殖和迁徙转移能力越强;反之,恶性程度低的肿瘤细胞的体外生长增殖和迁徙转移能力越弱。因此,在未来的肿瘤防治研究或药物筛选中,应该强调针对H-ILTSCs的治疗作用,力求将H-ILTSCs全部清除。此外,H/L-ILTSCs的提出为下一步研究肺癌细胞转移的相关分子机制打下基础。
1 中国疾病与癌症报告2010[EB/OL].http://oncotherapy.us/pdf/cn.diseases.pdf
2 Julian R,Ping Y,Stephen DC,et al.Non-Small Cell Lung Cancer:Epidemiology,Risk Factors,Treatment,and Survivorship[J].Mayo Clin Proc,2008,83(5):584-594
3 Kim CF,Jackson EL,Woolfenden AE,et al.Identification of bronchioalveolar stem cells in normal lung and lung cancer[J].Cell,2005,121(6):823-835
4 Dalerba P,Cho RW,Clarke MF.Cancer stem cells:models and concepts[J].Annu Rev Med,2007,58(1):267-284
5 Wicha MS.Cancer stem cells and metastasis:lethal seeds[J].Clin Cancer Res,2006,12(19):5606-5607
6 Hermann PC.Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer[J].Cell Stem Cell,2007,1(3):313-323
7 林叔陈,张凤春,张雁云,等.乳腺癌干细胞的研究进展[J].肿瘤,2008,28(8):719-722
8 Tie J,Pan YL,Zhao LN,et al.MiR-218 Inhibits Invasion and Metastasis of Gastric Cancer by Targeting the Robo1 Receptor[J].Plos Genetics,2010,6(3):e1000879
9 Klein CA.Cancer:the metastasis cascade [J].Science,2008,321(5897):1785-1787
10 Peter ME.Let-7 and miR-200 microRNAs:guardians against pluripotency and cancer progression[J].Cell Cycle,2009,8(6):843-852
11 Hermann PC,Huber SL,Heeschen C.Metastatic cancer stem cells:a new target for anti-cancer therapy[J].Cell Cycle,2008,7(2):188-193
12 Mani SA.The epithelial-mesenchymal transition generates cells with properties of stem cells[J].Cell,2008,133(4):704-715
13 George J,Klarmann EM,Hurt LA,et al.Invasive prostate cancer cells are tumor initiating cells that have a stem cell-like genomic signature[J].Clin Exp Metastasis,2009,26:433-446
14 Hermann PC,Huber SL,Herrier T,et al.Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer[J].Cell Stem Cell,2007,1(3):313-323
15 Chen HH,Hsieh CH,et al.Characterization of naturally occurring floating cells and adherent cells within the CEA-producing UP-LN1 carcinoma cell line in vitro:identification of cancer stem cells with metastatic potential[J].Chang Gung University,2008,5(3):188-200
