阿托伐他汀对实验性自身免疫性脑脊髓炎大鼠体内IL-4表达的影响
2012-05-14万志荣杜继臣
杨 静,万志荣,杜继臣
(航天中心医院神经内科,北京 100049)
实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)是多发性硬化(multiple sclerosis,MS)的理想动物模型,后者是以中枢神经系统白质脱髓鞘病变为特点的自身免疫性疾病,呈慢性病程且倾向于年轻人罹患,是重要的神经系统疾病之一。但目前用于治疗MS的药物大多由于疗效局限、缺乏特异性、毒副作用大等原因限制了其临床应用。因此在EAE的基础上寻找疗效可靠、不良反应小且廉价的药物是我们目前研究的主要方向。1995年,Kobashigawa[1]等最早发现他汀类药物具有免疫调节作用。之后美国加州大学的Zamvil等[2]通过对他汀类药物的全面研究,欣喜地发现广泛用来降低胆固醇的他汀类药物也许能够治疗 MS。但目前国内应用他汀类药物治疗 EAE/MS的研究报道很少。本实验是在建立EAE模型的基础上,探讨不同剂量的阿托伐他汀对EAE神经功能的保护作用及其可能的机制,为临床应用提供重要的理论和实用价值。
1 材料与方法
1.1 实验动物
Wistar大鼠,6~8周龄,体质量 180~200g,雌性;豚鼠,体质量(400±50)g,雌雄不限。
1.2 主要试剂
立普妥(阿托伐他汀钙片,大连辉瑞制药有限公司),碾成粉末状,用蒸馏水溶解;白细胞介素(interleukin,IL)-4放射免疫试剂盒(解放军总医院科技开发中心放射免疫所);羊毛脂、液体石蜡油(国药集团化学试剂有限公司);卡介苗(北京生物制品研究所)等。
1.3 免疫抗原及动物模型的制备[3]
取新鲜豚鼠脊髓,与冰生理盐水制成50%(质量/体积)的脊髓生理盐水匀浆,后与完全福氏佐剂(CFA,每毫升含6mg卡介苗)混合成油包水抗原乳剂。取上述抗原乳剂 0.5ml,分别注入 Wistar大鼠的四足掌胶质垫及背部皮下。
1.4 实验分组及药物干预
未做免疫诱导的大鼠(10只)为正常对照组。免疫诱导后的大鼠(90只)随机分为 EAE模型组,小剂量治疗组和大剂量治疗组,每组30只。每组分别于免疫诱导后第1天开始以生理盐水、2mg/kg及8mg/kg计算的阿托伐他汀灌胃。各组又根据病程分为14d、21d、28d三个亚组,每小组10只大鼠。
1.5 症状观察及神经功能评分
观察大鼠每日体质量变化、精神状态及活动情况,并进行神经功能评分,采用Hooper的7分评分标准[4]:0分:正常;1分:被毛不光整,尾部无力;2分:尾部瘫痪;3分:尾部瘫痪+后肢无力;4分:尾部瘫痪+后肢部分瘫痪;5分:后肢完全瘫痪;6分:四肢瘫痪;7分:濒死状态或死亡。
1.6 留取标本
各组均于免疫诱导后第14天(发病期)、第21天(恢复期)、第28天(复发期)处死动物,留取血清并保存。
1.7 观察阿托伐他汀对EAE病情的影响
分别记录各组发病率、发病时间、大鼠的体质量变化并进行神经功能评分。
1.8 观察阿托伐他汀对EAE病理损伤的影响
留取的脊髓组织经处理切片,行HE染色,光学显微镜下观察组织中血管周围炎性细胞浸润的情况。
1.9 IL-4的测定
取各组大鼠血清,应用IL-4放射免疫试剂盒,按实验说明,用GC-911γ放射免疫计数器测定大鼠血清中IL-4的含量。
1.10 统计学处理
所得数据经SAS软件进行统计学处理,数据用均数±标准差表示;多组计量资料均数的比较应用方差分析;各组之间率的比较用卡方检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 EAE模型的建立情况
免疫诱导后的大鼠于第 14天左右陆续出现肢体无力、瘫痪等症状,第17天左右疾病达高峰,病程持续 7~9d。EAE总发病率达 76.67%,其中经阿托伐他汀治疗后发病率明显下降至33.33%(表 1)。在观察时间较长(第 28天)的条件下大鼠发病率达100%,复发率也达到了70%,而经阿托伐他汀治疗后复发率降至 30%(表 2)。
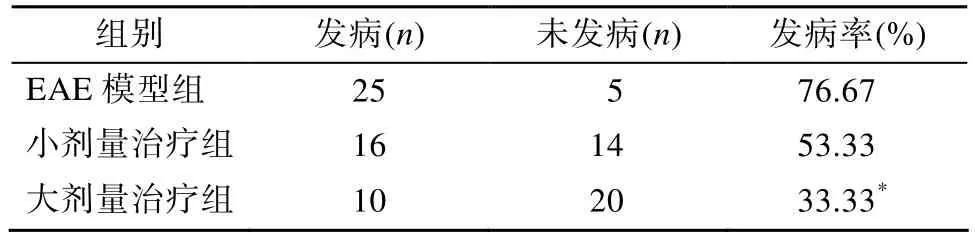
表1 各组大鼠第14天EAE发病情况Table 1 Establishment of EAE rat models in different groups on day 14

表2 第28天组大鼠EAE复发情况Table 2 EAE rats in different groups on day 28
2.2 阿托伐他汀对EAE大鼠神经功能的影响
表3结果表明,大剂量治疗组的最高评分均值和总和评分均值都显著低于EAE模型组(P<0.05),因此,8mg/kg阿托伐他汀治疗可使 EAE大鼠神经功能损伤明显减轻。
表3 各组大鼠神经功能评分比较Table 3 Neurological deficits score in different groups(n=30,±s)

表3 各组大鼠神经功能评分比较Table 3 Neurological deficits score in different groups(n=30,±s)
注: 小剂量治疗组: 2mg/kg阿托伐他汀; 大剂量治疗组: 8mg/kg阿托伐他汀。与EAE模型组比较,*P<0.05
组别 最高评分均值 总和评分均值EAE模型组 3.3±0.5 42.1±25.7小剂量治疗组 2.8±0.3 39.6±14.7大剂量治疗组 1.8±0.2* 22.2±14.4*
2.3 阿托伐他汀对EAE病理损伤的影响
图 1表明,发病第 14天时光学显微镜下可见EAE大鼠中枢神经系统内有大量炎性细胞浸润形成血管袖套,三组比较,EAE模型组炎症细胞浸润数目明显高于大剂量治疗组(P=0.01),而与小剂量治疗组之间炎症细胞浸润数目的差异没有统计学意义(P=0.08)。

图1 各组大鼠脊髓组织病理改变Figure 1 Spinal histopathological changes of rats in different groups (HE ×100)
2.4 各组大鼠血清IL-4含量测定结果
表4结果表明,EAE大鼠血清内IL-4含量于疾病复发期(第28天)时最低,恢复期(第21天)增加到最高值。大剂量(8mg/kg)阿托伐他汀可明显增加机体内的血清IL-4含量(P<0.05)。
表4 各组大鼠IL-4测定结果Table 4 Serum IL-4 levels in different groups (n=30,µg/L,±s)

表4 各组大鼠IL-4测定结果Table 4 Serum IL-4 levels in different groups (n=30,µg/L,±s)
注: 小剂量治疗组: 2mg/kg阿托伐他汀; 大剂量治疗组:8mg/kg阿托伐他汀。与EAE模型组比较,*P<0.05; 与第14天比较,#P<0.05; 与第21天比较,△P<0.05
组别 第14天 第21天 第28天EAE 模型组 0.42±0.18△ 0.57±0.33# 0.19±0.13△小剂量治疗组 0.41±0.27△ 0.52±0.33# 0.21±0.02△大剂量治疗组 0.51±0.27△ 0.78±0.59# 0.48±0.35*△
3 讨 论
他汀类药物对于MS的疗效主要来自对其动物模型EAE的研究。Youssef等[5]及Nath等[6]先后在EAE模型的基础上观察了他汀类药物对MS的治疗作用,之后一系列人类免疫细胞的体外实验[7]和多中心的临床研究[8]都证明他汀类药物参与免疫反应的多个环节对 MS有治疗作用。临床常用的他汀类药物种类较多,本实验选用了不良反应发生率较低的阿托伐他汀进行治疗,同时它也是各种他汀类药物中参与免疫反应环节最多的一种[9]。
我们在对国内外 EAE模型进行了大量研究的基础上[10],选用国内数量充足,价格便宜的 Wistar大鼠进行诱导,增加了免疫原的用量,并提高了完全福氏佐剂中卡介苗的含量,使得EAE总的发病率达76.67%,28天组由于观察时间较长,发病率达到100%,复发率也高达70%,成功地建立了多病程的EAE模型,为进一步的研究分析奠定了基础,也使我们的实验结果更加真实可信。
从实验结果观察EAE的整体发病情况:大鼠在免疫诱导后14天左右发病,17天时达高峰,21天左右缓解,28天时部分大鼠处于疾病的复发期。阿托伐他汀可以明显降低EAE的发病率和复发率,缩短病程,但不能显著推迟首次发病的时间。对大鼠神经功能评分进行分析,发现各组分值高低与病程一致,而将不同组中每只患病大鼠高峰期时评分进行比较,结果显示大剂量治疗组评分明显低于模型组,证实阿托伐他汀可以明显降低疾病的严重程度,减轻其临床症状。但应用小剂量阿托伐他汀治疗后不能明显改善大鼠的神经功能,考虑其对EAE的治疗必须在足够浓度下才能发挥作用,这一结果与国外报道相符[11]。
IL-4主要由Th2细胞产生,曾被命名为B细胞生长因子-1,不仅能促进B细胞的分化与增殖;还能够诱导T淋巴细胞增殖,促使Th0淋巴细胞向Th2淋巴细胞转化,并促使Th2类细胞因子的产生[12,13]。在EAE的研究中 Khoury等[14]发现IL-4能抑制Th1细胞的活化及炎性细胞因子的产生,进而促使EAE的恢复,故是EAE的负向调节因子。本实验结果为三个时间点比较显示,第 21天组大鼠血清中 IL-4含量明显高于第14天和第28天组(P<0.05),而第14天与第28天组大鼠血清中IL-4含量之间的差异无统计学意义(P>0.05)。三组比较,EAE模型组 IL-4含量明显低于大剂量治疗组(P<0.05),而与小剂量治疗组比较IL-4含量的差异无统计学差异(P>0.05)。本实验中EAE模型组血清IL-4含量的分析显示,当动物处于发病初期时血清中IL-4含量与空白对照组相比显示出明显的降低,说明IL-4在疾病早期就发挥了一定作用。而当第 21天时,动物多处于疾病的缓解期,神经功能缺损程度也明显好转时,IL-4水平也出现明显升高且与空白对照组已无差异。当第28天时,模型组10只动物中有7只出现了临床症状的二次发作,并且在处死时大部分仍然处于疾病的活动期,IL-4水平出现下降,且明显低于空白对照组的水平。上述实验结果说明,动物血清中细胞因子IL-4参与了疾病损伤的修复过程,而且IL-4的水平变化和疾病的活动性呈负相关。在两个治疗组中也分别对第 14天、第 21天、第 28天三个时间点进行比较,小剂量治疗组IL-4水平在三个时间点分别和EAE模型组相比均有数值上的升高,但没有达到统计学差异。大剂量阿托伐他汀治疗后,可以显著提高疾病各个时期IL-4的表达,在整个疾病过程中起到保护机体,促进神经损伤恢复的作用,也体现了药物作用的持续性[15]。
综合本实验结果可以发现,阿托伐他汀可以明显降低EAE的发病率和复发率,缩短病程,减少疾病对机体的神经功能损害,促进病情缓解。而这些作用与其提高机体中IL-4的含量紧密相关。同时发现阿托伐他汀对EAE的治疗作用是剂量相关性的,只有足够大的药物浓度才能达到其治疗目的,但仅通过本实验还不能确定其安全有效的用药剂量。因此要实现将他汀类药物应用于 MS的治疗,仍需进行大量的动物实验及临床实践。
[1]Kobashigawa JA,Katznelson S,Lacks H,et al.Effect of pravastatin on outcomes after cardiac transplantation[J].N Engl J Med,1995,333(10): 621-627.
[2]Zamvil SS,Steinman L.Cholesterol-lowering statins possess anti-inlammatory activity that might be useful for treatment of MS[J].Neurology,2002,59(7): 970-971.
[3]董 梅,刘瑞春,郭 力,等.多病程 Wistar大鼠实验性变态反应性脑脊髓炎的病理研究[J].脑与神经疾病杂志,2004,12(6): 416-419.
[4]Hooper DC,Scott GS,Zborek A,et al.Uricacid,aperoxynitrite scavenger,inhibits CNS inflammation,blood-CNS barrier permeability changes,and tissue damage in a mouse model of multiple sclerosis[J].FASEB J,2000,14(5): 691-698.
[5]Youssef S,Stuve O,Patarroyo JC,et al.The HMG-CoA reductase inhibitor,atorvastatin,promotes a Th2 bias and reverses paralysis in central nervous system autoimmune disease[J].Nature,2002,420(6911): 78-84.
[6]Nath N,Giri S,Prasad R,et al.Potential targets of 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitor for multiple sclerosis therapy[J].J lmmunol,2004,172(2):1273-1286.
[7]Kieseier BC,Archelos JJ,Hartung HP.Different effects of simvastatin and interferon beta on the proteolytic activity of matrix metalloproteinases[J].Arch Neurol,2004,61(6):929-932.
[8]Vollmer T,Key L,Durkalski V,et al.Oral simvastatin treatment in relapsing-remitting multiple sclerosis[J].Lancet,2004,363(9421): 1607-1608.
[9]Bonetti PO,Lerman LO,Napoli C,et al.Statin effects beyond lowering——are they clinically relevant[J]? Eur Heart J,2003,24(3): 225-248.
[10]邢清和,王永铭,郑远荣.影响EAE动物模型建立的因素分析[J].中国临床神经科学,2000,24(1): 305-306.
[11]Bellosta S,Via D,Canavesi M,et al.HMG-CoA reductase inhibitors reduce MMP-9 secretion by macrophages[J].Arterioscler Thromb Vasc Biol,1998,18(11): 1671-1678.
[12]Stuve O,Prodhomme T,Slavin A,et al.Statins and their potential targets in multiple sclerosis therapy[J].Expert Opin Ther Targets,2003,7(5): 613-622.
[13]Stuve O,Youssefs S,Steinman L,et al.Statins as potential therapeutic agents in neuroinflammatory disorders[J].Curr Opin Neurol,2003,16(3): 393-401.
[14]Khoury SJ,Hancock WW,Weiner HL.Oral tolerance to myelin basic protein and natural recovery from experimental autoimmune encephalomyelitis are associated with downregulation of inflammatory cytokines and differential upregulation of transforming growth factor beta,interleukin 4,and prostaglandin E expression in the brain[J].J Exp Med,1992,176(5): 1355-1364.
[15]Aktas O,Waiczies S,Smorodchenko A,et al.Treatment of relapsing paralysis in experimental encephalomyelitis by targeting Th1 cells through atorvastatin[J].J Exp Med,2003,197(6): 725-733.
