低钙透析液对于持续性非卧床腹膜透析老年患者动力缺失性骨病的疗效分析
2012-05-14王建文谢丽华
刘 骏, 张 浩, 王建文, 孙 剑, 胡 静, 谢丽华
(中南大学湘雅三医院肾内科, 长沙 410013)
近十余年来, 对于慢性肾脏病(chronic kidney disease, CKD), 尤其是终末期肾病患者的肾性骨病(renal osteodystrophy, ROD)的治疗逐渐重视, 治疗的重点集中于抑制甲状旁腺激素(parathyroid hormone, PTH)分泌、纠正钙磷代谢异常, 使作为磷鳌合剂的大剂量的钙盐(醋酸钙/碳酸钙为主)和活性维生素D被广泛使用[1]。这些治疗导致ROD分类呈现两极化趋势, 即混合性骨病和骨软化症日益减少, 动力缺失性骨病(adynamic bone disease, ABD)患者逐渐增多。ABD和PTH增多性骨病, 即高转化型骨病(high-turnover bone disease, HTBD)为两种最常见ROD类型[2], ABD正逐渐成为ROD的一种常见类型, 大约占ROD的21%~55%[1,4,9], 这一观点已经获得多项研究证实。有研究显示, 由于透析人群中糖尿病患者和老年人血清骨保护素的增加以及骨骼对于PTH的拮抗作用增强, 使得该类人群中ABD的发病率明显高于其他人群[3]。糖尿病和老龄患者在腹膜透析患者构成比中占有相当高的比例, 因此, 腹膜透析患者中ABD的发生率较血液透析患者高, 达到甚至超过60%[5,6]。由于高钙血症为ABD的主要生化特征, 当钙磷乘积明显增加, 特别是>75 mg2/dl2时, 将加重软组织的转移性钙化, 尤其是血管钙化。当血管钙化表现在脑血管和冠状动脉时, 将明显增加心脑血管事件的发生率和死亡率, 从而大大降低腹膜透析患者的生存率[2]。糖尿病患者和老年患者的心脑血管事件发生率在临床上则更为突出。国外的近期研究发现, 使用低钙透析液可以升高患者血浆全段PTH(intact PTH, iPTH)水平, 从而增加骨转运来达到治疗ABD的目的[7,8]。因此, 本研究使用了低钙透析液, 观察其是否能够提高ABD的老年腹膜透析患者血浆iPTH水平, 影响并纠正钙磷代谢异常, 评估其对老年腹膜透析患者ABD治疗的疗效和安全性。
1 对象与方法
1.1 对象
在本腹膜透析中心长期规律随访的维持性腹膜透析的老年患者中选取ABD患者, 入选年龄>60岁、透析方式为持续性非卧床腹膜透析, 透析龄≥3个月。排除标准: 患有恶性肿瘤(如多发性骨髓瘤、淋巴瘤等)、原发性甲状旁腺功能亢进症以及长期使用噻嗪类利尿剂、糖皮质醇激素或免疫抑制剂治疗的患者。入选24例患者, 男15例, 女9例, 平均年龄(72.1±6.7)岁(61~88岁), 平均透析龄(11.09±7.96)月(3~34月)。其中原发病为慢性肾小球肾炎6例, 糖尿病肾病13例, 高血压肾病5例。ABD的诊断标准: 根据美国肾脏基金会制定的慢性肾脏病及透析的临床实践指南Ⅱ(Kidney Disease Outcomes Quality Initiative of the National Kidney Foundation,NFK-K/DOQI), 由骨活检证实或iPTH<100 ng/L。骨质疏松症诊断标准: 骨密度(bone mineral density,BMD)低于同性别峰值骨量的2.5SD以上。
1.2 方法
由百特PD2透析液[钙1.75 mmol/L, 钠132 mmol/L,氯96 mmol/L, 镁0.25 mmol/L, 乳酸盐40 mmol/L]改为百特PD4透析液[钙1.25 mmol/L, 钠132 mmol/L,氯96 mmol/L, 镁0.25 mmol/L, 乳酸盐40 mmol/L]治疗。每周透析量平均(49.8±6.2)L(42~56 L), 同时使用碳酸钙或者不含钙的磷鳌合剂(Renage1)降低血磷。回顾分析第1, 2, 6, 9, 12, 15, 18个月血浆iPTH、血钙、血磷、钙磷乘积、碱性磷酸酶(alkaline phosphatase, AKP),同时在治疗前及第6, 12, 18个月测定患者左手前臂的BMD; 观察患者使用低钙透析液的耐受性和不良反应。其中血浆iPTH由放射免疫法测定, BMD由单光子骨矿物质密度测定仪测定。
1.3 统计学处理
全部数据采用SPSS10.0统计软件进行分析处理。计量数据资料以±s表示, 计数资料以绝对例数或百分率表示, 采用配对t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 使用低钙透析液治疗后血浆iPTH水平变化
治疗后第1个月血iPTH水平开始上升, 第2个月血iPTH水平明显上升(P<0.01; 表1), 第6, 9, 12月逐步上升, 在第12至18个月中保持稳定, 并且在治疗目标安全范围内(150~300 ng/L), 与治疗前相比,差异有统计学意义(P<0.01; 表1)。在治疗的第12个月内iPTH水平上升至150~300 ng/L的患者所占比例随着时间推移逐渐增加, 提示骨转运水平得到改善。在治疗12个月以后, 达标率较第12个月无明显变化(表2)。治疗期间未出现1例血浆iPTH水平超过治疗目标范围(>300 ng/L)。
2.2 治疗后钙磷代谢和AKP的变化
治疗后第2个月血钙水平、血磷水平以及钙磷乘积分数均有明显下降, 有显著性差异(P<0.01; 表1);第6, 9, 12月均较治疗前降低; 且血钙、血磷、钙磷乘积达到NFK-K/DOQI标准(血钙2.1~2.37 mmol/L, 血磷1.13~1.78 mmol/L, 钙磷乘积<55mg2/dl2)比例均较治疗前升高(表2), 而在随后的6个月(第12~18个月)内保持稳定。治疗前后AKP有明显升高,(P<0.05; 表1)。在整个治疗过程中, 低钙血症发生率较低, 共18例(约占全部记录血钙次数的9%),且大部分出现在治疗后期, 发生在治疗12个月后14例(占全部低钙血症事件77.6%), 且多数为无症状性低钙血症。
2.3 治疗后BMD的变化
BMD测定骨质疏松发生率增加12.5%(由治疗前13例, 增加至16例)。
表1 使用低钙透析液治疗后iPTH、钙磷代谢、AKP的变化Table 1 Change of iPTH, serum calcium, serum phosphorus, and AKP level after abdominal dialysis using low-calcium dialysate (n=24,±s)
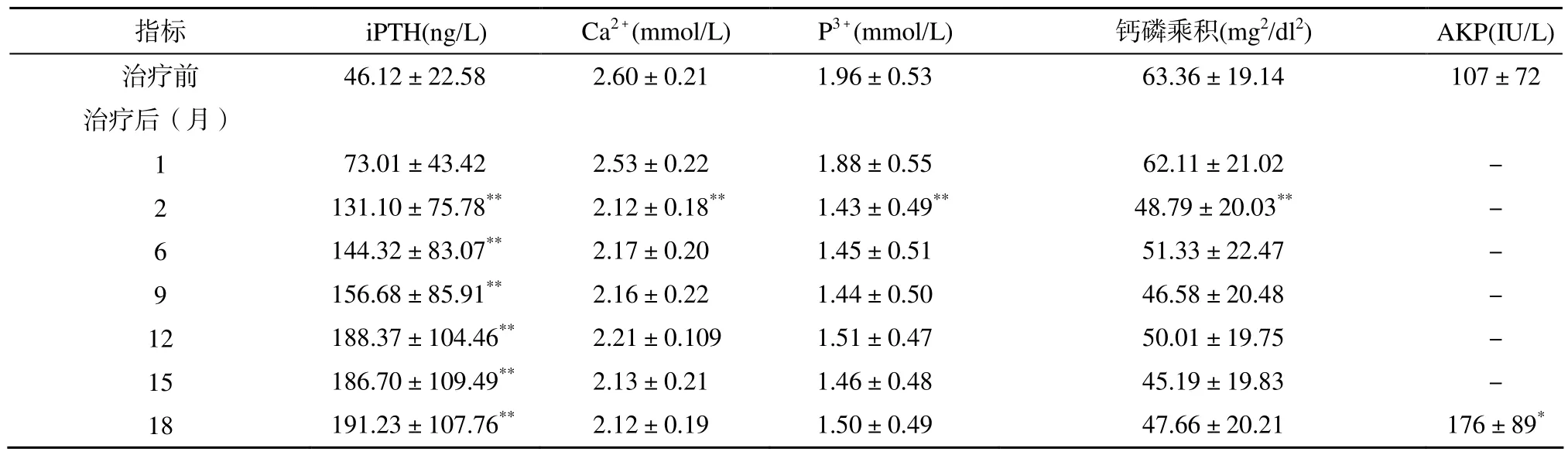
表1 使用低钙透析液治疗后iPTH、钙磷代谢、AKP的变化Table 1 Change of iPTH, serum calcium, serum phosphorus, and AKP level after abdominal dialysis using low-calcium dialysate (n=24,±s)
注: iPTH:全段甲状旁腺激素;AKP:碱性磷酸酶。与治疗前比较, *P<0.05, **P<0.01
指标 iPTH(ng/L) Ca2+(mmol/L) P3+(mmol/L) 钙磷乘积(mg2/dl2) AKP(IU/L)治疗前 46.12±22.58 2.60±0.21 1.96±0.53 63.36±19.14 107±72治疗后(月)1 73.01±43.42 2.53±0.22 1.88±0.55 62.11±21.02 -2 131.10±75.78** 2.12±0.18** 1.43±0.49** 48.79±20.03** -6 144.32±83.07** 2.17±0.20 1.45±0.51 51.33±22.47 -9 156.68±85.91** 2.16±0.22 1.44±0.50 46.58±20.48 -12 188.37±104.46** 2.21±0.109 1.51±0.47 50.01±19.75 -15 186.70±109.49** 2.13±0.21 1.46±0.48 45.19±19.83 -18 191.23±107.76** 2.12±0.19 1.50±0.49 47.66±20.21 176±89*
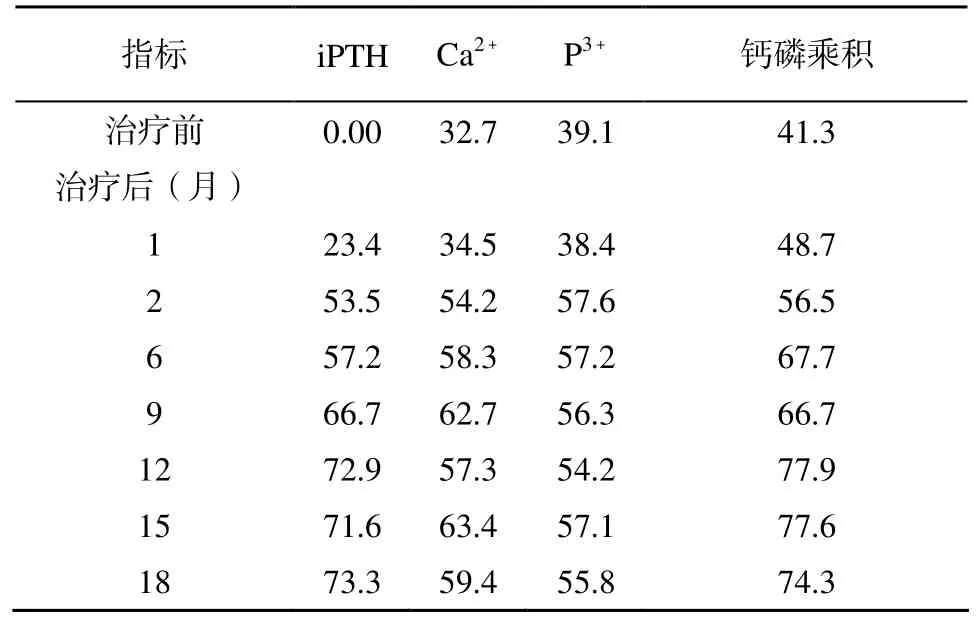
表2 使用LCD治疗后钙磷代谢和iPTH达到目标值的患者比例Table 2 Standard-reaching rate of calcium and phosphate metabolism and iPTH (n=24, %)
3 讨 论
从1980年开始人们初步认识ABD[9], 直到1995年为止, 据有关文献统计, ABD在ROD的诊断类型中所占比重不足2%[2,10]。但是, 随着大剂量钙盐作为磷鳌合剂和高钙透析液的频繁使用以及积极的维生素D治疗, 在1995年后通过骨组织病理学研究发现ABD正逐渐成为常见的ROD临床类型, 而且大部分患者的发病与铝中毒无关[1,10], 因此, 有学者认为该病的发生与使用钙盐和维生素D治疗过度有关[2,11]。但是, ABD的病理生理和发病机制目前仍不清楚。近期的相关研究发现, ABD的发生可能与PTH受体的下调、破骨细胞抑制因子减少和血清骨保护素增多有关[3,9]。
ABD患者同时存在骨矿化障碍和骨生成障碍,对骨组织微裂缝修复能力差, 较易发生髋骨和脊椎的骨折; 更重要的是, ABD患者骨组织对血钙的缓冲能力差, 容易引起体内钙磷负荷过重, 促使转移性钙化的发生[2,11]。转移性钙化较常见于软组织和血管, 终末期肾病与动脉硬化、心血管疾病相关关系研究表明, 血液透析患者动脉钙化积分高者, 其骨组织中破骨细胞和成骨细胞数量少, 血PTH水平低,表现为低转运性骨病特征[12]; 血磷水平的升高对于冠状动脉钙化的危险性与透析时间的影响相当(血磷每增加0.5 mmol/L相当于增加2.5年的血液透析时间)[13]; 钙磷乘积高者较数值低者死亡率明显增加(钙磷乘积>72 mg2/dl2的患者死亡率比钙磷乘积42~52 mg2/dl2者高34%)[14]。由此可见, 转移性钙化的加重将明显增加心血管事件的发生, 缩短腹透患者生存时间, 针对ABD的治疗, 减轻转移性钙化就显得尤为重要[2,15]。
NFK-K/DOQI建议对CKD 5期的ABD患者应给予治疗, 使其血浆iPTH水平升高, 以达到增加骨转运的目的[16]。本研究发现, 使用低钙透析液1个月后血iPTH水平较治疗前开始上升, 在第2个月显现出明显的疗效, 随着时间的推移, 患者血浆iPTH水平在第6, 9, 12个月逐步上升, 在第12至18个月中保持稳定, 并且保持在治疗目标安全范围内(150~300 ng/L), 与Sánchez等[7]的观察结果相一致。到观察结束时, 仍旧有70%以上的患者血浆iPTH达标, 显示低钙透析液治疗ABD有较好的疗效, 在整个观察过程中, 未出现1例血浆iPTH水平超过治疗目标范围(300 ng/L);治疗过程中观测到的低钙血症多数为无症状性低钙血症; 未出现严重的低钙性抽搐、精神状态改变、低血压以及骨折等情况, 与李芸等[17]观察相似。以上结果显示, 低钙透析液治疗老年腹透患者ABD有较好的安全性。
骨组织活检是诊断ABD的金标准, 大多数研究认为骨活检结果与血浆iPTH水平有良好的相关性[4],故本研究将血浆iPTH<100 µg/L作为诊断ABD的标准。根据文献报道[6], 血浆iPTH<150 µg/L对于诊断ABD灵敏度达91.6%, 特异度达95.2%, 阳性预告值达97%; 所以我们选择血浆iPTH 150~300 ng/L为治疗目标安全范围。本研究观测到, 治疗后AKP有明显升高, 也同样证明了治疗的有效性; 但是由于AKP<200 IU/L诊断ABD的特异度仅58%[17], 故研究中未在不同治疗时期连续检测AKP的数值变化。
本研究证明, 在患有ABD的老年腹膜透析患者中使用低钙透析液能有效地纠正高钙、高磷血症、调整钙磷乘积和升高血浆iPTH, 达到治疗ABD的目的, 具有较好的疗效和安全性。但是, 值得注意的是,在治疗患有ABD的老年腹透患者时, 骨质疏松发生率有可能增加, 这一点也是国外的相关研究所关注的[8,18]。我们建议定期监测血钙变化, 在治疗超过12个月时尤其重要。
随着 ABD发病率的日益增高, 现今对于 CKD的钙磷代谢紊乱治疗的重点已经由控制高磷血症逐渐转移至防治转移性钙化[2]。低钙透析液的使用可以有效治疗老年腹膜透析患者ABD, 但其能否延缓转移性钙化的发生以及对远期生存率的影响还有待进一步的研究。
[1]Couttenye MM, D'Haese PC, Deng JT,et al. High prevalence of adynamic bone disease diagnosed by biochemical markers in a wide sample of the European CAPD population[J]. Nephrol Dial Transplan, 1997, 12(10):2144-2150.
[2]Malluche HH, Mawad H, Monier-Faugere MC. The importance of bone health in end-stage renal disease: out of the frying pan, into the fire[J]? Nephrol Dial Transplant,2004, 19(suppl 1): 9-13.
[3]Doi S, Yorioka N, Masaki T,et al. Increased serum osteoprotegerin level in older and diabetic hemodialysis patients[J]. Ther Apher Dial, 2004, 8(4): 335-339.
[4]Sanchez CP. Adynamic bone revisited: is there progress[J]?Perit Dial lnt, 2006, 26(1): 48-43.
[5]Sherrard DJ, Hercz G , Pei Y,et al. The spectrum of bone disease in end-stage renal failure —— an evolving disorder[J].Kidney lnt, 1993, 43(2): 436-440.
[6]Carmen Sánchez M, Auxiliadora Bajo M, Selgas R,et al.Parathormone secretion in peritoneal dialysis patients with adynamic bone disease[J]. Am J Kidney Dis, 2000, 36(5):953-961.
[7]Sánchez C, López-Barea F, Sánchez-Cabezudo J,et al. Lowvsstandard calcium dialysate in peritoneal dialysis: differences in treatment, biochemistry and bone histomorphometry. A randomized multicentre study[J]. Nephrol Dial Transplant,2004, 19(6): 1587-1592.
[8]Haris A, Sherrard DJ, Hercz G. Reversal of adynamic bone disease by lowering of dialysate calcium[J]. Kidney Int, 2006,70(5): 931-937.
[9]Yokoyama K, Shigematsu T, Ogura Y. The pathophysiology of adynamic bone disease[J]. Clin Calcium, 2001, 11(8):1005-1013.
[10]Monier-Faugere MC, Malluche HH. Trends in renal osteodystrophy: a survey from 1983 to 1995 in a total of 2248 patients[J]. Nephrol Dial Transplant, 1996, 11(suppl 3):111-120.
[11]Cannata Andía JB. Adynamic bone and chronic renal failure:an overview[J]. Am J Med Sci, 2000, 320(2): 81-84.
[12]London GM, Marty C, Marchais SJ,et al. Arterial calcifications and bone histomorphometry in end-stage renal disease[J]. J Am Soc Nephrol, 2004, 15(7): 1943-1947.
[13]Raggi P, Boulay A, Chasan-Taber S,et al. Cardiac calcification in adult hemodialysis patients. A link between end-stage renal disease and cardiovascular disease[J]? J Am Coll Cardiol, 2002, 39(4): 695-701.
[14]Block GA, Hulbert-Shearon TE, Levin NW,et al.Association of serum phosphorus and calcium x phosphate product with mortality risk in chronic hemodialysis patients:a national study[J]. Am J Kidney Dis, 1998, 31(4): 607-617.
[15]Block GA, Port FK. Re-evaluation of risks associated with hyperphosphatemia and hyperparathyroidism in dialysis patients: recommendations for a change in management[J].Am J Kidney Dis, 2000, 35(6): 1226-1231.
[16]Moe SM. Management of renal osteodystrophy in peritoneal dialysis patients[J]. Perit Dial Int, 2004, 24(3): 209-216.
[17]李 芸, 朱彤莹, 田 菁, 等. 低钙透析液对腹膜透析患者动力缺失性骨病的治疗[J]. 复旦学报(医学版), 2007,34(2): 213-215.
[18]Ersoy FF. Osteoporosis in the elderly with chronic kidney disease[J]. Int Urol Nephrol, 2007, 39(1): 321-331.
