阿尔茨海默病CYP2D6*10基因多态性与多奈哌齐疗效
2012-05-14郑雪丽万丽丽
郑雪丽, 苗 雅, 钟 远*, 万丽丽
(上海交通大学附属第六人民医院:1老年科, 2药剂科, 上海 200233)
阿尔茨海默病(Alzheimer′s disease, AD)又称老年痴呆, 是严重影响老年人生活质量的常见疾病。多奈哌齐是目前治疗轻中度 AD的推荐药物,但在临床研究中发现其对不同的AD患者存在明显的疗效差异, 治疗有效率为20%~60%[1]。
CYP2D6是与多奈哌齐密切相关的代谢酶, 且是肝脏细胞色素 P450代谢酶家族中最具多态性的亚型, 研究表明 CYP2D6*10是黄种人最常见的基因多态性位点[2], 其外显子1上 C188→T的点突变可导致代谢酶的活性降低, 并且其基因突变频率存在明显的种族差异。国外有报道, 白种人 CYP2D6基因多态性与多奈哌齐的疗效有关[3,4], 但国内研究较少。本研究旨在探讨我国汉族人群 AD患者CYP2D6*10基因多态性与多奈哌齐的疗效关系, 为临床医生合理用药, 治疗AD提供更多的依据。
1 对象与方法
1.1 对象
2009年1月~2011年3月上海交通大学附属第六人民医院老年科门诊或住院患者及健康体检者。患者入组标准如下: (1)汉族, 年龄≥65岁; (2)由两名有经验的医师, 依据美国国立神经病学、语言障碍和卒中研究所及 AD和相关疾病协会的标准诊断的很可能为AD的患者; (3)神经心理学量表评估, 10分≤简易精神状态量表(mini-mental state examination, MMSE)评分≤23分, 临床痴呆评定量表评分≥1分, 总体衰退量表评分≥4分, Hachinski缺血量表评分<4分; (4)无胆碱类药物过敏史。体检者入组标准如下: (1)汉族, 年龄≥65岁; (2)神经心理学量表评估: MMSE≥29分。排除标准如下:(1)患任何引起痴呆的其他神经系统疾病如帕金森病、癫痫、脑外伤、肿瘤、感染、中毒等; (2)患符合美国精神病学会精神障碍诊断和统计手册诊断标准的其他精神疾病; (3)患头颅 CT、磁共振成像及血液等检查明确的非AD痴呆; (4)合并服用其他改善认知功能的药物; (5)合并服用其他影响CYP2D6酶功能的药物(其他抗胆碱酯酶药物、抗抑郁药、抗精神病药、β受体阻滞剂等)。符合入组标准的患者(AD组)110例, 男72例, 女38例, 平均年龄(80.6±4.9)岁; 健康体检者(对照组)124例, 男83例, 女41例, 平均年龄(80.2±4.7)岁。
1.2 干预方法
所有 AD患者睡前口服多奈哌齐(商品名: 安理申, 日本卫材株式会社), 5 mg/d, 1个月后, 耐受良好者剂量增加至10 mg/d, 干预治疗6个月。患者于服药前及治疗结束后, 由经过专业培训的医师对其进行认知功能测定, 随访的神经心理学量表为MMSE和 AD评定量表的认知分量表(Alzheimer disease assessment scale-cognitive subscale, ADASCog)。
1.3 CYP2D6*10基因型测定
应用限制性片段长度多态性-聚合酶链反应(restriction fragment length polymorphism-polymerase chain reaction, RFLP-PCR)方法测定CYP2D6*10基因型。
1.3.1 提取基因组 DNA 所有试验者, 空腹 12 h,取肘静脉血5 ml, EDTA抗凝, 利用基因组抽提试剂盒提取基因组 DNA, 分光光度计测定基因组 DNA的含量和纯度。
1.3.2 扩增目的基因片段 按照参考文献[5]设计引物: 上游引物 5′-CCATTTGGTAGTGAGGCAGGTAT-3’; 下游引物 5′-CACCATCCATGTTTGCTTCTGGT-3′。PCR 反应体系为: 0.5~1 µg DNA 模板、2 µl 10×缓冲液(含15 mmol/L MgCl2)、1 µl DMSO、1 µl 2.5 mmol/L dNTPs、10 µmol/L 上下游引物各 0.3 µl、0.25 µl Taq DNA 聚合酶(5U/µl), 用蒸馏水补至 20 µl。扩增循环参数: 94℃预变性5 min, 94℃变性30 s, 58℃退火30 s, 72℃延伸30 s, 共32个循环, 最后72℃延伸5 min。2%琼脂糖凝胶电泳检测PCR扩增产物(120V,30 min)。
1.3.3 酶切PCR产物及电泳 酶切体系为: PCR产物 5 µl、ddH2O 12.5 µl、限制性内切酶HphI (10 U/µl)0.5 µl、10×缓冲液 2 µl, 置 37.0℃水浴箱 12 h。5 µl酶切产物与1 µl 6×上样缓冲液混合, 行12%非变性聚丙烯酰胺凝胶电泳(150 V, 4 h)。
1.3.4 硝酸银染色及显影 电泳结束后, 凝胶采用0.1%AgNO3染色 15 min; 显影液(1.2%NaOH 和0.4%甲醛)显影5 min, 拍片观察。
1.4 血浆多奈哌齐浓度测定
所有患者服药6个月后, 空腹12 h, 取肘静脉血5 ml, EDTA 抗凝, 离心并分离血浆, -80℃保存待用。应用高效液相色谱-质谱法测定血浆多奈哌齐的稳态浓度。
1.4.1 色谱与质谱条件 色谱柱为C18柱; 流动相组成为: A相, 5 mmol/L甲酸胺和0.1%甲酸水溶液, B相, 乙腈, pH4.0; 流速0.4 ml/min, 柱温32℃, 进样量5µl; 采用正离子方式, 多重反应监测扫描。
1.4.2 溶液配制与样品处理 精密称取多奈哌齐对照品5 mg, 以50%甲醇溶解并定容, 制成1 g/L的贮备液; 精密称取尼罗替尼 2 mg, 以甲醇溶解并定容,制成0.2 g/L的贮备液。量取储备液适量稀释至1µg/L,作为含内标沉淀溶液。取血浆样品30 µl, 加5 mmol/L甲酸胺, 0.1%甲酸溶液 30 µl, 振摇, 再加含内标的0.1%甲酸乙腈溶液120 µl, 振摇, 15 970g离心10 min,取上清层进样分析。
1.4.3 线性范围 取空白血浆加入多奈哌齐系列浓度工作溶液, 制成浓度为0.2, 0.5, 1.0, 2.0, 5.0, 10.0,20.0, 50.0, 100.0µg/L的血浆样品, 按照1.4.2项的方法处理后进样。以样品峰面积与内标峰面积的比值A为纵坐标, 浓度c为横坐标, 进行线性回归, 回归方程为: c=0.0687×A+0.0526,r=0.9981, 表明多奈哌齐在线性范围内线性关系良好。
1.4.4 保留时间及定量限 多奈哌齐及内标的保留时间分别为6.1 min和6.6 min; 血浆中多奈哌齐的最低定量浓度为0.2µg/L 。
1.5 统计学处理
使用SPSS13.0统计软件进行统计学分析。所有计量资料用±s表示, 两组计量资料比较采用t检验, 两组以上计量资料比较采用单因素方差分析,计数资料采用卡方检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 CYP2D6*10基因型及等位基因频率分布
CYP2D6*10的PCR扩增片段为272 bp(图1),该片段中存在限制性内切酶HphI的酶切位点, 如果出现 C188→T突变, 则在 T188位点上形成第二个HphI酶切位点。聚丙烯酰胺凝胶电泳检测酶切产物时, 野生型基因(C/C)可检测到213 bp和59 bp酶切片段, 突变杂合子(C/T)可检测到213 bp, 112 bp,101bp和59 bp酶切片段, 突变纯合子(T/T)为可检测到112 bp, 101 bp和59bp酶切片段(图2)。
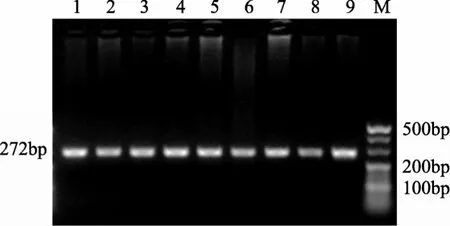
图1 CYP2D6*10 PCR扩增产物琼脂糖电泳图谱Figure 1 Agarose gel electrophoresis of CYP2D6*10 PCR amplification fragment
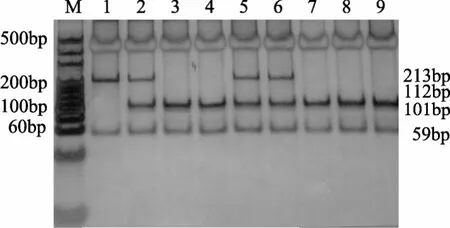
图2 CYP2D6*10三种基因型非变性聚丙烯酰胺凝胶电泳电泳图谱Figure 2 Non-denaturant polyacrylamide gel electrophoresis of CYP2D6*10 three genotypes
AD组110例患者中96例完成6个月随访, 其余 14例由于腹泻、失眠等副作用失访。96例患者中C/C型27例、C/T型25例、T/T型44例; C和T的等位基因频率为 41.1%和 58.9%。对照组 124例完成随访, 其中C/C型25例、C/T型44例、T/T型55例; C和T的等位基因频率为37.9%和62.1%。AD组与对照组的CYP2D6*10基因型和等位基因频率卡方检验, 显示差异均无统计学意义(P>0.05;表 1)。
2.2 多奈哌齐血药浓度与认知量表评分
AD患者按照CYP2D6*10基因型不同分为C/C组、C/T组和T/T组, 3组在性别、年龄、受教育时间及治疗前MMSE和ADAS-Cog评分的比较, 差异均无统计学意义(P>0.05), 表明3组基线资料基本匹配, 具有可比性(表2)。
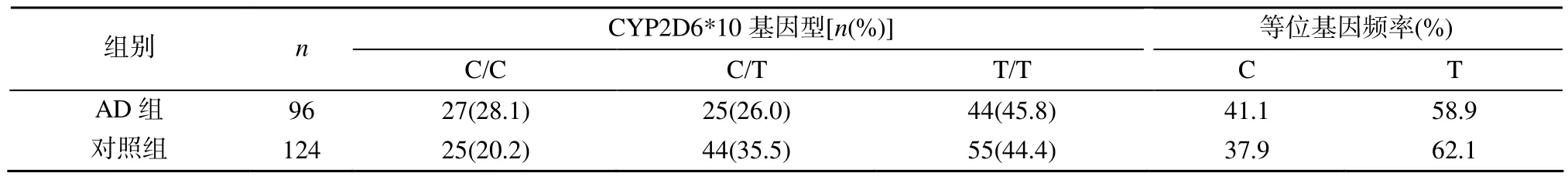
表1 CYP2D6*10基因型及等位基因频率分布Table 1 Genotypes of CYP2D6*10 and distribution of allele frequency
表2 3组间基线资料比较Table 2 Demographic and cognition scores of three CYP2D6*10 genotypes (±s)
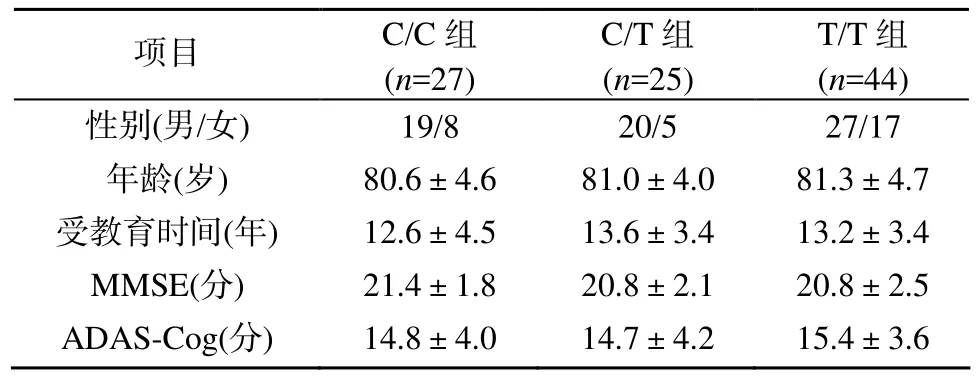
表2 3组间基线资料比较Table 2 Demographic and cognition scores of three CYP2D6*10 genotypes (±s)
项目 C/C组(n=27)C/T组(n=25)T/T组(n=44)性别(男/女) 19/8 20/5 27/17年龄(岁) 80.6±4.6 81.0±4.0 81.3±4.7受教育时间(年) 12.6±4.5 13.6±3.4 13.2±3.4 MMSE(分) 21.4±1.8 20.8±2.1 20.8±2.5 ADAS-Cog(分) 14.8±4.0 14.7±4.2 15.4±3.6
服药 6个月后, CYP2D6*10基因突变组(C/T和 T/T组)的血药浓度分别为(50.0±12.7)μg/L和(59.0±13.0)μg/L, 而野生型基因组(C/C组)的血药浓度为(40.1±14.0)μg/L, 3组间比较差异均有统计学意义(P<0.05; 表3)。
表3 血药浓度及认知量表比较Table 3 Donepezil Cp and cognition scores of different CYP2D6*10 genotypes (±s)
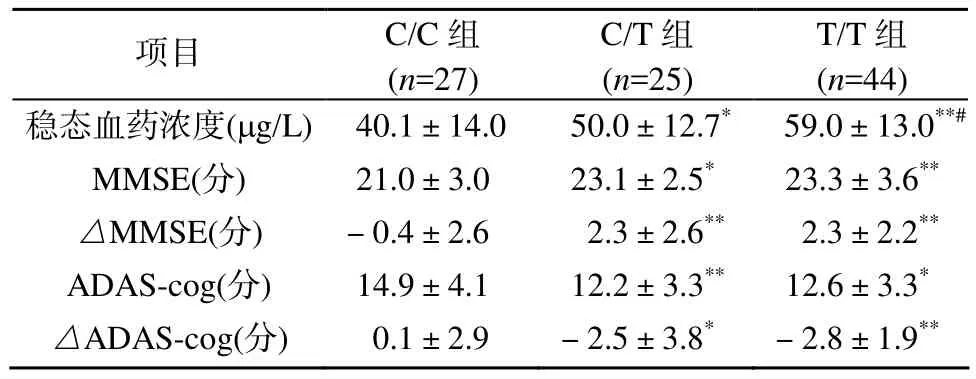
表3 血药浓度及认知量表比较Table 3 Donepezil Cp and cognition scores of different CYP2D6*10 genotypes (±s)
注: 与C/C组比较, *P<0.05, **P<0.01; 与C/T组比较, #P<0.05
项目 C/C组(n=27)C/T组(n=25)T/T组(n=44)稳态血药浓度(μg/L) 40.1±14.0 50.0±12.7* 59.0±13.0**#MMSE(分) 21.0±3.0 23.1±2.5* 23.3±3.6**△MMSE(分) -0.4±2.6 2.3±2.6** 2.3±2.2**ADAS-cog(分) 14.9±4.1 12.2±3.3** 12.6±3.3*△ADAS-cog(分) 0.1±2.9 -2.5±3.8* -2.8±1.9**
C/T组和T/T组的MMSE和ADAS-Cog评分与C/C组比较差异均有统计学意义(P<0.05);△MMSE比较, C/T组和T/T组约增加2.3分, 而C/C组约下降0.4分, 前两组与C/C组比较差异均有统计学意义(P<0.01);△ADAS-Cog比较, C/T组和T/T组分别约下降2.5分和2.8分, 而C/C组约增加了0.1分,前两组与 C/C组比较,差异均有统计学意义(P<0.05,P<0.01; 表 3)。
3 讨 论
某些研究表明, AD患者的年龄、性别、受教育时间和基础认知水平的差异对多奈哌齐疗效有一定程度的影响[6], 而个体代谢药物的酶基因多态性对多奈哌齐的疗效差异性也是目前研究的重点[3,4], 故本研究排除了上述年龄等因素, 探讨了 CYP2D6基因多态性与多奈哌齐的疗效的关系。
CYP2D6基因位于 22q13.1~13.2, 根据酶活性的不同将个体分为四种表型: 弱代谢者(poor metabolizers, PM)、中间代谢者(intermediate metabolizers, IM)、泛代谢者(extensive metabolizers,EM)和超快代谢者(ultra rapid metabolizers, UM)[7]。人群中约 80%为 EM, 但其他表型却存在明显的种族差异, 其中白种人7%~10%为PM, 5%为UM, 而亚洲人最常见的突变类型是IM, PM仅0.94%[8]。有报道, 白种人AD患者, 服用多奈哌齐3个月测定其CYP2D6基因型、血药浓度及MMSE评分, 结果发现, UM者的血药浓度明显低于EM者, 且临床疗效差于EM者[3]; 此外有学者发现, CYP2D6多态性位点 rs1080985C→G点突变导致代谢酶的活性增强,并且量表评分表明, 多奈哌齐对基因突变型患者的疗效差于野生型患者[4]。国内有研究表明, 70例AD患者服用多奈哌齐 6个月, 血药浓度高的患者反而临床疗效差[9]。除此之外, 国内外未见类似报道, 并且上述研究结果存在争议, 仍需进一步研究。
文献报道, CYP2D6*10基因突变频率中国大陆人群为 48.0%~70.0%[2,10]、日本人 40.8%[11]、白种人仅1.5%[12]。本研究表明, 对照组的基因突变频率为62.1%, 与上述报道吻合, 并且与AD组比较差异无统计学意义, 表明 AD患者基因突变率与正常人群相似。此外, 研究表明, CYP2D6*10基因突变组的血药浓度明显高于野生型基因组, 并且前者的认知评分明显优于后者, 但突变纯合子(T/T组)和突变杂合子(C/T组)的认知评分差异却没有统计学意义。我们考虑, 虽然测出T/T组和 C/T组的血药浓度具有差异性, 但由于血药浓度并不是唯一影响药物疗效的因素, 并且纳入研究的样本量相对偏小,研究周期较短, 并且目前量表评分带有一定主观性,故两组的疗效无统计学差异。
本研究表明, 多奈哌齐对汉族人群 AD患者CYP2D6*10基因突变型的疗效好于野生型患者, 并且其基因突变频率较高, 故测定该基因多态性可以指导临床医生合理选择药物剂量, 对野生基因型疗效差的患者可及早增加药物剂量, 但该研究结果仍需大样本、多中心的证据支持。此外, 探讨多奈哌齐的治疗机制及与其疗效的相关性也是我们继续研究的方向。
[1]Winblad B, Engedal K, Soininen H,et al. A 1-year,randomized, placebo-controlled study of donepezil in patients with mild to moderate AD[J]. Neurology, 2001,57(3): 489-495.
[2]Ji L, Pan S, Wu J,et al. Genetic polymorphisms of CYP2D6 in Chinese mainland[J]. Chin Med J (Engl), 2002, 115(12):1780-1784.
[3]Varsaldi F, Miglio G, Scordo MG,et al. Impact of the CYP2D6 polymorphism on steady-state plasma concentrations and clinical outcome of donepezil in Alzheimer's disease patients[J]. Eur J Clin Pharmacol, 2006, 62(9):721-726.
[4]Pilotto A, Franceschi M, D'Onofrio G,et al. Effect of a CYP2D6 polymorphism on the efficacy of donepezil in patients with Alzheimer disease[J]. Neurology, 2009, 73(10):761-767.
[5]Garcia-Barceló M, Chow LY, Chiu HF,et al. Genetic analysis of the CYP2D6 locus in a Hong Kong Chinese population[J]. Clin Chem, 2000, 46(1): 18-23.
[6]Haywood WM, Mukaetova-Ladinska EB. Sex influences on cholinesterase inhibitor treatment in elderly individuals with Alzheimer's disease[J]. Am J Geriatr Pharmacother, 2006,4(3): 273-286.
[7]Cacabelos R. Pharmacogenomics in Alzheimer's disease[J].Methods Mol Biol, 2008, 448: 213-357.
[8]Cacabelos R. Pharmacogenomics and therapeutic prospects in Alzheimer's disease[J]. Expert Opin Pharmacother, 2005,6(12): 1967-1987.
[9]Yang YH, Wu SL, Chou MC,et al. Plasma concentration of donepezil to the therapeutic response of Alzheimer's disease in Taiwanese[J]. J Alzheimers Dis, 2011, 23(3): 391-397.
[10]李 芹, 王 睿, 郭 雅, 等. 中国人群 CYP2D6基因多态性对美托洛尔药代动力学的影响[J]. 中国临床药理学与治疗学, 2008, 13(7): 796-802.
[11]Tateishi T, Chida M, Ariyoshi N,et al. Analysis of the CYP2D6 gene in relation to dextromethorphan O-demethylation capacity in a Japanese population[J]. Clin Pharmacol Ther, 1999, 65(5): 570-575.
[12]Sachse C, Brockmöller J, Bauer S,et al. Cytochrome P450 2D6 variants in a Caucasian population: allele frequencies and phenotypic consequences[J]. Am J Hum Genet, 1997,60(2): 284-295.
