不同培养方式和pH对草地早熟禾原生质体分裂和生长的影响
2012-05-13白生军马晖玲安惠惠
白生军,马晖玲,马 祥,安惠惠
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
草地早熟禾(Poa pratensis)是禾本科早熟禾属一种优质冷季型草坪草。草地早熟禾抗寒性较差[1],植物生殖方式复杂多样,常以兼性无融合生殖方式进行繁殖[2-6],有些品种无融合生殖率高达98%以上[3,6],有性杂交率低,很难获得杂种优势品种。以原生质体培养为基础和前提条件的体细胞杂交技术不失为选育草地早熟禾杂种细胞可行而有效的育种途径之一。Vander等[7]开创了草地早熟禾原生质体培养的先河,Kisten等[8]的研究进一步奠定草地早熟禾原生质体培养的基础,但目前来看,早熟禾体细胞杂交技术还不成熟,研究相对不够深入,仅获得一些阶段性成果[9,10]。
实验以草地早熟禾午夜2号(MidnightⅡ)、新格莱德(Nuglade)和橄榄球2号(RugbyⅡ)3个品种的优质愈伤组织为材料,研究不同培养方式和pH对原生质体分裂和生长的影响,探索不同品种原生质体的最佳培养方式,以期为进一步完善草地早熟禾的原生质体培养奠定基础。
1 材料和方法
1.1 实验材料
将3个草地早熟禾午夜2号、新格莱德和橄榄球2号品种的成熟种子接种于添加各品种诱导愈伤组织适宜浓度激素的 MS培养基上(午夜2号:1mg/L 2,4-D+0.3mg/L 6-BA;新格莱德:3mg/L 2,4-D+0.5 mg/L 6-BA;橄榄球2号:3mg/L 2,4-D+0.1mg/L 6-BA;),诱导并优化培养得到生长状态质地良好的愈伤组织。
1.2 实验方法
挑选各品种继代20次生长状态良好的愈伤组织1g,置10mL酶液(13%甘露醇CPW+1%的纤维素酶+1%的离析酶+0.3%的崩溃酶+0.3%的果胶酶和5mol/L的 MES,pH 5.8),25±1℃,50r/min摇床暗中酶解16h。用200目和300目尼龙网过滤混合液,离心5min,依次用CPW-13溶液和原生质体培养液清洗2~3次后用培养液调整原生质体密度为2×105个/mL后进行培养[11]。
用液体浅层培养和固液双层培养进行草地早熟禾原生质体培养。其中,液体浅层培养以KM8P为基本培养基,添加不同品种各自愈伤组织诱导时适宜浓度的激素(0.45μm微孔滤膜抽滤灭菌),将纯化得到的原生质体悬浮于其中,滴加2mL悬浮液到直径6cm的培养皿底部,形成一薄层,用保鲜膜封口,于26±1℃下,恒温培养箱中静置培养;固液双层培养法:在培养皿底部先铺8~10mL MS培养基(不添加激素,pH 5.8),再在上面滴加2mL含有原生质体的KM8P培养液进行浅层培养,用保鲜膜封口,于26±1℃下恒温培养箱中静置培养,每天轻轻晃动培养皿数次,使原生质体与氧气充分接触。KM8P培养液的pH值设置5.6、5.8、6.0共3个水平。
原生质体培养15d后在倒置显微镜下统计分裂频率。比较不同品种的草地早熟禾原生质体的分裂生长及再生能力差异。
原生质体分裂频率(%)=(分裂的原生质体数/接种原生质体数)×100
2 结果与分析
2.1 不同培养方式及培养基pH对3个品种原生质体分裂的影响
培养方式和培养基的pH对午夜2号原生质体的分裂生长均有影响。固液双层培养比液体浅层培养更能得到较高的原生质体分裂率(图1)。
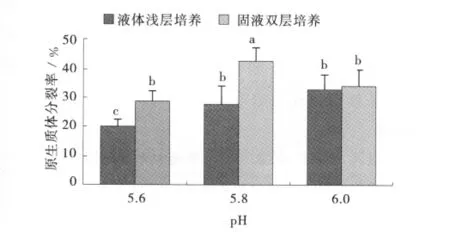
图1 不同培养方式和培养基pH对午夜2号原生质体分裂生长的影响Fig.1 Effect of different cultivation methods and pH of medium on growth of MidnightⅡprotoplast
pH对原生质体的分裂率具有明显影响。固液双层培养中,pH5.8时原生质体分裂率最大(42.8%),显著高于pH为5.6和6.0时的分裂率。研究表明,午夜2号原生质体培养过程中,最适宜的培养条件是固液双层培养方式,pH为5.8。
新格莱德的培养基pH为5.6时,原生质体分裂率在2种培养方式中均最低,而pH为5.8和6.0时,2种培养方式中原生质体分裂率相近,均在45%,固液双层培养,pH6.0时原生质体分裂率达到最大值,为50.1%(图2)。
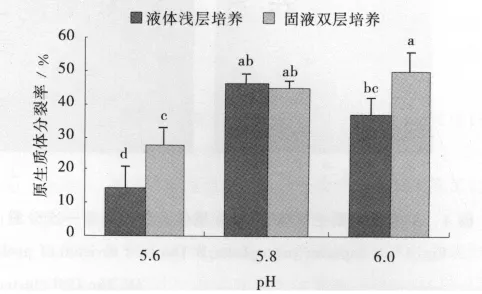
图2 不同培养方式和培养基pH对新格莱德原生质体分裂生长的影响Fig.2 Effect of different cultivation methods and pH of medium on growth of Nuglade protoplast
培养方式和pH对橄榄球2号原生质体分裂的影响不甚明显,原生质体分裂率均保持在22.5%~29.4%。同一pH值下,相对液体浅层培养,橄榄球2号原生质体培养采用固液双层培养可得到较高的原生质体分裂率;下层固体培养基和上层液体培养基pH均为5.8时,原生质体分裂率达到最大值,为29.4%(图3)。
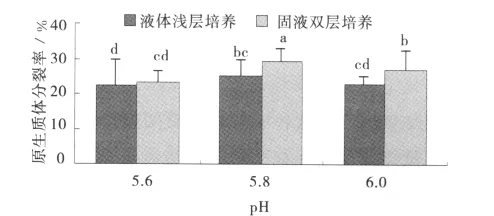
图3 不同培养方式和培养基pH对橄榄球2号原生质体分裂生长的影响Fig.3 Effect of different cultivation methods and pH of medium on growth of RugbyⅡprotoplast
2.2 3个草地早熟禾品种原生质体形态及其变化
原生质体培养初期,3个草地早熟禾品种的原生质体状态基本相似,在倒置显微镜下观察均表现为形状规则、边缘清晰、大小均一和内含物较多的特性(图4A)。培养2~3d后,可观察到原生质体再生细胞的第1次、第2次分裂(图4B,C)。随后再生细胞持续分裂,在低倍镜下即可观察到再生细胞形成的小细胞团(图4D)。比较3个品种原生质体分裂率发现,新格莱德原生质体的分裂率最高(图2),午夜2号略低于新格莱德(图1),而橄榄球2号原生质体的分裂率远低于前两者(图3)。
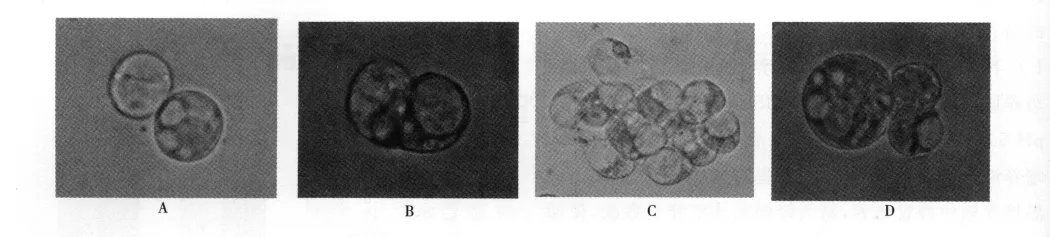
图4 A优质的原生质体;B原生质体再生细胞第一次分裂;C原生质体再生细胞第二次分裂;D原生质体分裂产生的小细胞团Fig.4 A Superior protoplasts;B The first division of protoplast-derived cell;C The second division of protoplast-derived cell;D The Cell clusters formed from protoplasts
3 讨论
3.1 不同培养方式对原生质体分裂和生长的影响
不同的培养方式为原生质体提供不同的生长环境,液体浅层培养适用于较易分裂的原生质体,操作比较简单,对原生质体损伤较小,能有效防止有害物质过多积累,且易于添加新鲜培养基。但该方法也存在诸如原生质体分布不均匀、原生质体粘连、难以定点观察原生质体等缺点。固液双层培养是对液体浅层培养的改善。培养过程中,固体培养基中的营养成分可以被上层液体中的原生质体吸收利用,同时,原生质体产生的有害代谢物可被固体培养基吸收,尤其在固体培养基中添加吸附剂时这种吸附作用更明显。黄文川等[12]研究了液体浅层培养和固液双层培养对烟草原生质体分裂率的影响,发现固液双层培养的原生质体分裂率显著高于液体浅层培养时的分裂率,当加厚双层培养基中的固相至液相厚度的4~5倍时,更有利于烟草愈伤组织的快速形成和植株再生。实验以2种培养方式对3个草地早熟禾品种的原生质体进行培养,结果表明,固液双层培养比液体浅层培养效果好,在固液双层培养中原生质体具有较高的分裂频率。
3.2 培养基pH对原生质体分裂和生长的影响
原生质体在液体培养过程中,被完全浸没在培养液中,液体培养基的pH值通过影响渗透压稳定剂活性而影响原生质体的分裂、生长,酶液的pH值条件主要影响溶壁酶系统和渗透压稳定剂活性[14]。当培养基pH低于6.0时,新格莱德原生质体分裂率下降,午夜2号和橄榄球2号原生质体在培养基pH为5.8时也达到最大分裂频率。这与马向东等[13]的研究结果一致,但金凌云研究[15]认为,原生质体再生率与pH关系不大,今后有待进一步研究。
3.3 基因型的差异与原生质体生长和分裂的影响
实验研究中,选取20次继代后第8d生长状态相近的愈伤组织进行原生质体游离和培养,培养条件和培养密度相同,但3个品种原生质体分裂率呈现出较大差异。培养初期未见品种间差异,持续培养发现橄榄球Ⅱ号再生细胞在培养过程中停止分裂生长,而新格莱德和午夜Ⅱ号再生细胞能持续分裂,长势良好。可见不同品种之间原生质体培养效果差异很大,赵小强[11]对于草地早熟禾原生质体培养的研究结果也证实了这一结论,可能是由于原生质体供体材料的生理状态的差异造成的[16]。故合适的基因型是进行草地早熟禾原生质体培养成功的重要条件[5]。
[1] 李显利,米福贵,闫立军,等.草地早熟禾不同品种抗旱性的评价分析[J].草原与草坪,2010,30(3):43-46.
[2] Akerberg E.Apomictic and sexual seed formation in poa pratensis L[J].Hereditas,1979,25:359-371.
[3] Bashaw E C.Apomixis and its application in crop improvement[M]//W R Fehr,H H Hadley,Hybridization of crop plants.New York:Amer.Madison Press,1980:455-633.
[4] Grazi F M.Observation on the mode of reproduction and embryology of poa pratensis L[J].Hereditas,1961,47:489-541.
[5] Hanna W W,E C Bashaw.Apomixis:its identification and use in planting breeding[J].Crop Science,1987,27(6):1136-1139.
[6] 殷朝珍,王兆龙,葛才林.草地早熟禾无融合生殖及其育种利用研究进展[J].草原与草坪,2006(1):18-23.
[7] Vander V,Zaal P,Creemers-Molenaar J.Regeneration of albino plantlets from suspension culture derived proto-plasts of Kentucky bluegrass(Poa protensis L)[J].Euphytica,1988(5):169-176.
[8] Kirsten Annette Nielsen,Else Larsen,Elisabeth Knudsen.Regeneration of protoplast-derived green plants of Kentucky Bluegrass(Poa pratensis L)[J].Plant Cell Report,1993(12):537-540.
[9] 马晖玲,赵小强,白小明.草地早熟禾午夜Ⅱ号原生质体培养及植株再生[J].草地学报,2010,18(1):103-107.
[10] 赵小强,马晖玲,林栋,等.草地早熟禾新格莱德胚性愈伤组织原生质体培养及植株再生的研究[J].草业学报,2010,19(2):55-66.
[11] 赵小强.草地早熟禾原生质体培养及体细胞的杂交[D].甘肃:甘肃农业大学,2009.
[12] 黄文川,杨其光.一种简化有效的普通烟草原生质体培养方法[J].西北农业大学学报,2000,28(6):101-103.
[13] 朱至清.植物细胞工程[M].北京:化学工业出版社,2003:25.
[14] 马向东.猴头菌原生质体制备条件的研究[J].河南科学,1995,13(1):65-69.
[15] 金凌云.蛹虫草原生质体诱变及主要活性物质提取工艺研究[D].陕西:西北农林科技大学,2010.
[16] 马晖玲,张崇浩,肖尊安,等.影响植物原生质体分裂的生理生化因素[J].甘肃农业大学学报,1998,33(1):42-46.
