玉米单倍体诱导与加倍方法研究
2012-05-10季洪强宋桂良付志远李卫华汤继华
季洪强,刘 慧,宋桂良,付志远,李卫华,汤继华
(河南农业大学农学院,河南郑州450002)
优良杂交种的选育与推广是世界玉米产量不断提高的重要保证,然而利用常规的育种方式选育一个优良玉米杂交种往往需要6~10 a的周期[1,2],无法满足生产上对品种更新换代的快速要求.玉米育种周期长的主要限制因素在于一个自交系的纯合往往需要6~8代,因此如何加速自交系选育过程中的基因型纯合是提高玉米育种效率的关键.而高等植物中存在的孤雌生殖和孤雄生殖现象为玉米自交系的加速选育提供了一条有效的策略.COE[3]最早报道自交系Stock 6的授粉后代中能够产生2.29%的孤雌生殖单倍体,随后许多学者对Stock 6的孤雌生殖单倍体的诱导效率进行了改良选择[4,5],并在 20 世纪育成了诱导率更高的孤雌生殖诱导系,玉米单倍体育种进入了实用化阶段,有效提高了玉米育种效率[6~8].中国玉米育种工作者先后开展了玉米孤雌诱导系的选育和加倍研究工作,选育出了农大高诱1号、高诱6号、吉高诱系3号等诱导概率较高的诱导系,并用于商业良种[9~11].但是,由于单倍体植株的诱导率和单倍体的加倍率是制约单倍体育种的关键因素,多数学者通过对不同单倍体诱导系的改良以提高诱导率[9~12],同时对单倍体的加速技术进行了大量研究,利用秋水仙素配合其它试剂进行种子、胚芽处理和利用除草剂如胺磺乐灵等方法进行幼苗处理均取得了较好的加倍效果[13~20].但是,这些方法操作相对较复杂,增加了实际应用过程中的难度.本研究拟在前人研究的基础上,探讨不同生态条件下的单倍体诱导率和加倍率,并对加倍方法进行改良,探索一套经济、便捷、高效、实用的玉米单倍体加倍方法.
1 材料与方法
1.1 试验材料
以自选孤雌生殖诱导系 TY1为父本,以农大108、郑单958、先玉 335、浚单 18、豫单 811 等 5 个优良玉米杂交种为母本,分别于2009年和2010年种植于河南农业大学科教园区(郑州)、海南基地(海南省三亚市乐东县九所镇山脚村)和甘肃基地(张掖地区玉米原种场),在母本吐丝后的第8天开始采用严格的人工授粉进行杂交诱导,并在种子达到生理成熟时收获,人工挑选单倍体子粒.
1.2 染色体加倍方法
将单倍体种子用体积分数3%的H2O2水浸泡10 min消毒后,用清水冲洗干净等待处理.单倍体的加倍采用3种方法.①干种子处理:加羟基脲26°C恒温处理6 h,再用清水冲洗干净(约2 h),用不同质量浓度的秋水仙素(0.2,0.4,0.6,0.8,1.0 g·L-1)和胺磺乐灵(质量浓度梯度 0.2,0.4,0.6,0.8,1.0 g·L-1)试剂(含 2%DMSO)处理 9 h,清水冲洗干净(约2 h)后播种.②萌动种子处理:先用清水浸泡10 h(26°C);然后放在发芽盒遮光培养12 h(种子萌动露白);再用干种子处理方法处理.③胚芽处理:待胚芽鞘长出2~3 mm时剪去.对剩余部分进行试剂处理;清水冲洗干净(约2 h)后直接播种.
1.3 单倍体雌雄育性的观察标准
抽雄后对凡能产生可散粉花药的植株记为雄性可育株,否则记为不育株.用正常二倍体玉米花粉给雄性不育株的雌穗授粉,授粉后能够结实的记为雌性可育株,不结实的记为雌性不育株.散粉率和结实率的计算方法如下:
散粉率/%=散粉株/成活单倍体总株数×100%
结实穗率/%=结实穗数/成活单倍体总株数×100%
2 结果与分析
2.1 不同基因型杂交种的单倍体诱导效果
对不同杂交种的单倍体诱导率进行方差分析(表1).结果表明,单倍体诱导率在3个地点间和5个品种间均达到了极显著水平.说明单倍体的诱导率不仅受被诱导基因型的影响,同时还与环境条件有密切的关系.
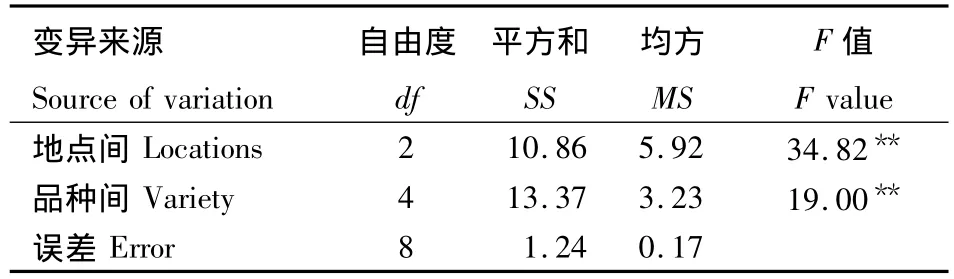
表1 不同杂交种在不同地点单倍体诱导率的方差分析Table 1 Variance analysis of haploid induction rate in different varieties three locations
从表2可以看出,诱导系TY1对同一品种在不同地点间的诱导率明显不同,海南的诱导率最高,与甘肃和郑州的诱导率相比达到了显著水平.而不同基因型杂交种的单倍体诱导率同样存在显著差异(表2),如958(4.48%)、浚单18(4.29%)和先玉335(4.14%)的平均诱导率与豫单811(3.14%)和农大108(2.06%)的平均诱导率达到了显著水平;而豫单811的平均诱导率与农大108相比同样达到了显著水平.
2.2 不同加倍方法的加倍效果分析
利用秋水仙素和胺磺乐灵分别对郑单958的单倍体进行了加倍处理,比较了3种加倍方法加倍后的植株成活率及散粉率.结果发现,随着秋水仙素含量的提高,干种子处理的单倍体加倍后的成活率未受到影响,但散粉率明显提高;萌动种子处理后的单倍体成活率也未受到影响,但散粉率先升后降;胚芽处理的单倍体处理后的成活率和散粉率都呈明显下降趋势(表3).而随着胺磺乐灵含量的提高,干种子处理的单倍体加倍后的成活率与散粉率的变化趋势与秋水仙素处理一致;萌动种子处理的单倍体成活率基本上未受影响,胚芽处理的单倍体加倍后的成活率逐渐下降,两者的散粉率都表现先升高后降低的趋势(表4).综合分析可以看出,用0.6 g·L-1的秋水仙素对萌动的玉米种子进行处理,其加倍效果最好,散粉率可以达71.25%(表3).
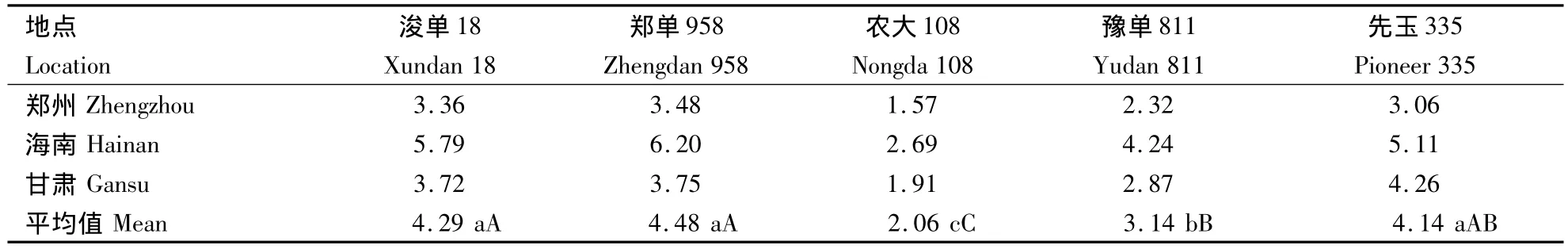
表2 不同品种不同地点的诱导率与多重比较分析Table 2 The haplod induction rate of different varieties at different locations and multiple comparison analysis %
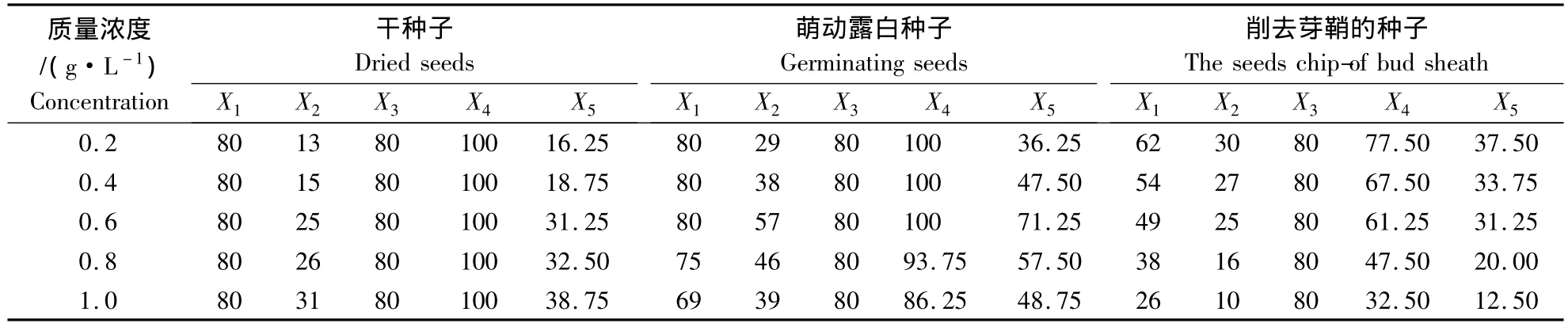
表3 郑单958单倍体在秋水仙素处理下的加倍效果Table 3 The doubled effect of Zhengdan 958 haploid under different Colchicine concentration treatment
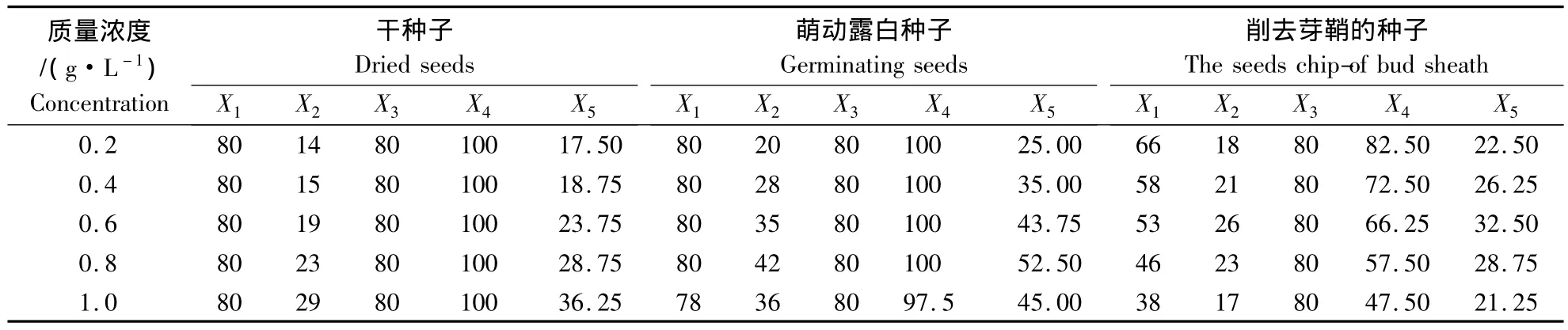
表4 郑单958单倍体在胺黄乐灵处理下的加倍效果Table 4 The doubled effect of Zhengdan 958 haploid under different Oryzalin concentration treatment
2.3 不同环境条件下单倍体的加倍率
用0.6 g·L-1的秋水仙素对不同杂交种诱导获得的单倍体萌动种子在甘肃省张掖地区原种场和海南省三亚市进行加倍率试验(表5).结果发现,不同玉米杂交种的单倍体加倍后的植株在2个环境条件下的散粉率和结实率存在一定的差异,浚单18和郑单958的单倍体在甘肃加倍后的植株散粉和结实率较高,分别达到了72.5%,71.25%和36.25%,38.75%.农大108的单倍体加倍后的植株散粉率和结实率在2个环境中均较低.但是,先玉335的单倍体在海南加倍后的植株散粉率和结实率要高于在甘肃的加倍效果,而其余4个杂交种的单倍体在甘肃加倍后的植株散粉率和结实率均高于在海南加倍后的效果.总体而言,在甘肃进行玉米单倍体的加倍效果要明显好于在海南的加倍效果.
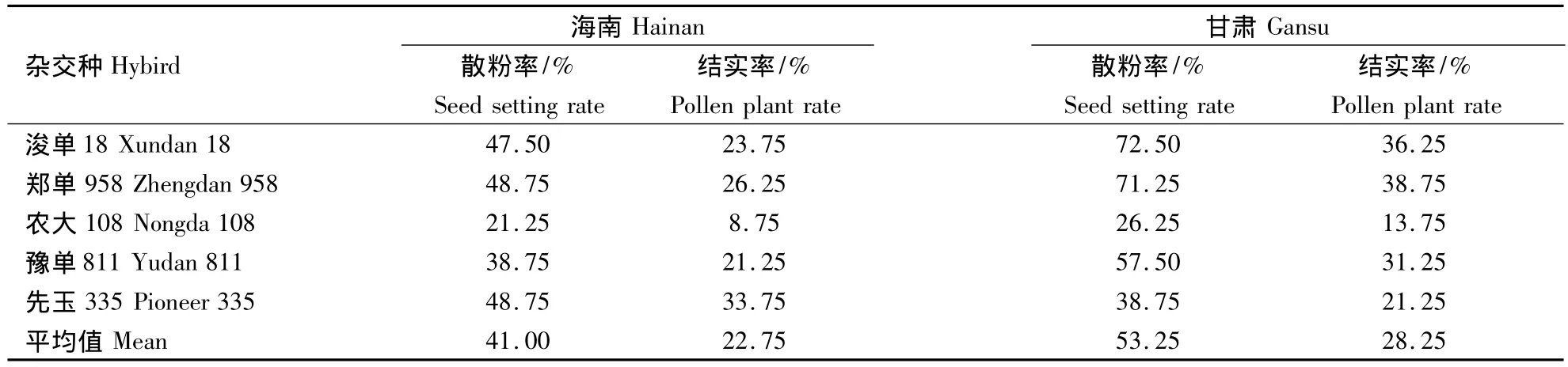
表5 不同地点间单倍体加倍后散粉率与结实率的比较Table 5 Comparison of the pollen plant rate and seed setting rate of haploid
3 讨论
多数研究证明,不同遗传背景的材料单倍体诱导率存在明显的差异[21~23].CHASE 认为,这种现象与被诱导材料的基因型有很大关系,是由于母本基因型所产生的雌配子中有害基因的概率不同所造成的,经过多代农艺性状改良的材料作母本比未经改良材料产生单倍体概率高[24].本研究发现,不但遗传背景影响着单倍体的诱导率,而且不同的环境条件同样在一定程度上影响着单倍体的诱导效率.由于中国多数玉米育种单位均在海南进行冬季加代,因此,应该在海南冬季开展单倍体的诱导工作,以提高单倍体的诱导效率.
玉米单倍体植株能否正常自交产生后代,取决于其雌雄育性是否恢复.正常情况下,单倍体雌穗的自然加倍率较高[9,25],而雄穗的自然加倍率较低,一般情况下在 10% 左右[7,17,26].因此,玉米单倍体的雄穗能否产生正常的花粉是制约单倍体加倍率的关键因素.为提高单倍体雄穗的加倍率,不同学者利用不同的方法对单倍体的加倍率进行了研究,提出了不同的单倍体加倍方法,单倍体雄穗的加倍率明显得到了提高[13~20],从而为商业化育种中的大规模应用提供保证.本研究在前人研究的基础上,探讨了利用不同质量浓度的秋水仙素对萌动的单倍体种子进行处理,与干种子处理相比,加倍率明显提高.同时,比人工剪去胚芽鞘处理幼苗具有较高的成活率,在单倍体育种中具有一定的实际应用前景.此外,本研究还发现,单倍体在甘肃省张掖地区具有较高的加倍效率.因此,应该充分利用中国的生态资源,在甘肃建立中国的玉米单倍体加倍育种基地,以有效提高玉米单倍体的加倍效率,加速玉米育种进程.
[1] LAWRENCE C J,WALBOT V.Translational genomics for bioenergy production from fuelstock grasses:maize as the model species[J].Plant Cell,2007,19(7):2091-2094.
[2] 刘纪麟.玉米育种学[M].第2版.北京:中国农业出版社,2002.
[3] COE E H.A line of maize with high haploid frequency[J].The American Naturalist,1959,93:381-382.
[4] SARKAR K R,PANKE S,SACHAN J K S.Development of maternal-haploidy-inducer lines in maize(Zea mays L.)[J].Indian J Agris Sci,1972,42:781
[5] AMAN M A,SARKAR K R.Selection for haploidy inducing potential in maize[J].Indian J Genet,1978,38(3):452-457.
[6] CHANG M T.Preferential fertilization induced from Stock 6[J].Maize Genet Coop Newslett,1992,66:99-100.
[7] SHATSKAYA O A,ZABIROV E R,SHCHERBAK V S.Autodiploid lines as sources of haploid spontaneous diploidization in corn[J].Maize Genet Crop Newslett,1994,68:51-52.
[8] BORDES J,DUMAS DE VAULX R,LAPIERRE A,et al.Haplodiploidization of maize(ZeamaysL.)through induced gynogenesis assisted by glossy markers and its use in breeding[J].Agronomiy,1997,17(5):291-297.
[9] 刘志增,宋同明.玉米单倍体雌雄育性的自然恢复以及染色体的化学加倍[J].作物学报,2000,26(6):947-952.
[10]刘志明,宋同明.玉米高频率孤雌生殖单倍体诱导系的选育与鉴定[J].作物学报,2000,26(5):570-574.
[11]才 卓,徐国良,刘向辉,等.玉米杂交诱导单倍生殖(单倍体)选育自交系技术规范[J].玉米科学,2009,17(5):1-4.
[12] WAN Y,WIDHOLM J.Effect of chromosome-doubling agents on somaclonal variation in the progeny of doubled haploids of maize[J].Plant Breeding,1995,114(3):253-255.
[13] WAN Y,DUNCAN D,RAYBURN A ,et al.The use of antimicrotubule herbicides for the production of doubled haploid plants from anther-derived maize callus[J].Theor Appl Genet,1991,81(2):205-211.
[14] KATO A.Chromosome doubling of haploid maize seedlings using nitrous oxide gas at the flower primordial stage[J].Plant Breeding,2002,121(5):375-377.
[15]STADLER J,PHILLIPS R,LEONARD M.Mitotic blocking agents for suspension cultures of maize black Mexican sweet cell lines[J].Genome,1989,32(3):475-478.
[16] KATO A.Induced single fertilization in maize[J].Sex Plant Reprod,1997,10(2):96-100.
[17] ZABIROVA E,CHUMAK M,SHATSKAIA O,et al.Technology of the mass accelerated production of homozygous lines in Russian[J].Kukuruza I Sorgo N,1996,4:17-19.
[18] DEIMLING S,ROBER F,GEIGER H.Methodology and genetics of in vivo haploid induction in maize[J].Vortr Pflanzenzüchtg,1997,38:203-224.
[19] GAYEN P,MADAN J K,KUMAR R,et al.Chromosome doubling in haploids through colchicine[J].Maize Genet Coop Newslett,1994,68:65.
[20] NEDEV T,GADEVA P,KRAPTCHEV B,et al.Colchicine-induced chromosome doubling of maternal haploids with in vitro culture[J].Maize Genet Coop Newslett,1999,73:80.
[21]李国良,苏 俊,李春霞,等.农大高诱1号对玉米不同种质和世代单倍体诱导频率的研究[J].玉米科学,2008,16(5):3-6.
[22] BORDES J,CHARMET G,DE VAULX R D,et al.Doubled-haploid versus single-seed descent and S1family variation for testcross performance in a maize population[J].Euphytica,2007,154(1/2):41-51.
[23] BORDES J,CHARMET G,DE VAULX R D,et al.Doubled haploid versus S1family recurrent selection for testcross performance in a maize population[J].Theor Appl Genet,2006,112(6):1063-1072.
[24] CHASE S S.Monoploidfrequencies in a commercial double cross hybrid maize,and in its component single cross hybrids and inbred lines[J].Genetics,1949,34(3):328-332.
[25] CHALYK S T,BYLICH V G,CHEBOTAR O D.Thansgressive segregation in the progen of a cross between two inducers of maize maternal haploids[J].Maize Genet Coop Newslett,1994,68:47.
[26]CHASE S S.Production of homozygous diploids of maize from monoploids[J].Agron J,1952,44:263-267.
