阳江原生态红树林土壤放线菌Streptomyces sp.strain V65的次级代谢产物*
2012-05-09向玲丽梁碧怡朱成波林永成
向玲丽,梁碧怡,朱成波,王 军,刘 岚,林永成
(1.中山大学药学院,广东 广州 510006;2.佛山市中医院,广东 佛山 528000;3.中山大学化学与化学工程学院,广东 广州 510275)
红树林土壤以其生境的特殊性养育了大量具有特色代谢产物的微生物类群,蕴含了微生物的多样性及其资源的珍稀性,引起了科学家研究的浓厚兴趣。近年来,国内外学者从红树林土壤中分离到多种微生物,并发现许多微生物的代谢产物具有抗菌活性[1],表明红树林土壤微生物的代谢产物中富含大量抗菌活性物质,有开发抗菌药物的潜力[2]。为了寻找新的抗结核药物先导化合物,课题组对广东沿海阳江、惠州等原生态红树林环境放线菌进行了初步分离纯化及抗分枝杆菌活性筛选研究。海洋放线菌Streptomycessp.strain V65是自阳江阳东县红树植物老鼠簕根际土壤中分离得到,该菌在前期筛选中显示出较好的抗菌活性,对其次级代谢产物的研究,找到了2个灵菌红素类化合物Undecylprodigiosin(Ⅰ) Metacycloprodigiosin(Ⅱ)和1个酰胺类化合物SW-B(Ⅲ)。
灵菌红素类化合物通常是陆地沙雷氏菌、放线菌及其它细菌产生的次级代谢产物,具有抗细菌、抗真菌、抗疟疾、免疫抑制和抗肿瘤等活性,已有其合成衍生物GX15-070作为抗癌药物,进入Ⅰ期临床研究[3]。近年,灵菌红素类化合物的用途已从药用走进工业领域,有许多关于这类化合物在纺织品着色应用方面的研究报道。与合成色素相比,这类化合物的红色瑰丽持久,且有抗菌、对人体健康无害等优点,吸引了大量学者的兴趣[4]。鉴于灵菌红素广泛的应用价值,从不同生态环境中寻找高产灵菌红素菌株的研究也受到国内外学者的关注[5-6]。本文首次报道了对阳江原生态红树林沉积物放线菌Streptomyces.strain V65次级代谢产物研究结果,在海洋生态学和天然产物资源学方面都有一定的意义。
1 材料与方法
1.1 实验试剂与仪器
实验试剂:石油醚、乙酸乙酯、甲醇、氯仿为分析纯试剂;硅胶GF254,柱层析硅胶(200~300目)为青岛海洋化工有限公司产品,Sephadex LH-20凝胶为美国GE Healthcare产品,反向硅胶ODS-A为日本Daiso公司产品;高氏Ⅰ号培养基:可溶性淀粉,KNO3,NaCl,K2HPO4,MgSO4·7H2O,FeSO4·7H2O,天然海水,琼脂。
实验仪器:Bruker AvanceIII 400 MHz核磁共振谱仪,LCQ DECA XP 型液相色谱-质谱联用仪,LCMS-IT-TOF高分辨质谱仪,JY98-III超声波细胞破碎仪。
1.2 样品采集、菌种分离、鉴定及培养
分离海洋放线菌V65的土壤样品采自阳江市阳东县东平镇莲北村原生态红树林红树植物老鼠簕根部;土壤样品采集方法[7]:在离目标树种0.5~1 m的范围内,用经过高压灭菌的钢铲采集离地面5~20 cm处的土壤,土壤样品采集后保存于无菌培养皿中,置于冰上保存,编号注明采样时间、地点、植物种类等,于当天运回实验室进行放线菌分离。
分离培养基为改良高氏(Gause’s)Ⅰ号[8],培养基中添加了w=50%陈海水;分菌方法采用划线纯化法;种属初步鉴定方法采用显微图片法,结果得出海洋放线菌V65为链霉菌属放线菌,暂命名为Streptomycessp.strain V65;纯化后的菌种4 ℃下保存在高氏(Gause’s)Ⅰ号培养基中。悬浮发酵培养基成份与菌种分离采用的培养基成分相同,不添加琼脂,pH 7.0,经121 ℃ (0.1 MPa ) 灭菌30 min,冷却到室温后接种,25 ℃振摇培养7 d,转速180 r/min,共发酵88 L。
1.3 粗提物制备
终止发酵后的发酵液用4层纱布过滤,滤液用等体积的乙酸乙酯萃取提取3次,萃取液低温减压浓缩蒸干,得到培养液粗提物;菌体用甲醇浸泡,超声波辅助提取4次,甲醇提取液低温减压浓缩蒸干,得到菌体粗提物。合并培养液及菌体粗提物,用石油醚-甲醇-水,乙酸乙酯-甲醇-水萃取分级,分别浓缩石油醚层,乙酸乙酯层及甲醇层,得到3份浸膏,对乙酸乙酯部位(约8 g)进行分离。
1.4 分离纯化
乙酸乙酯提取部位采用硅胶柱色谱技术粗分,洗脱液为氯仿-甲醇系统,氯仿/甲醇体积比为35∶1,分段收集,点板,含有红色斑点的馏分合并,再经Sephadex H-20凝胶柱色谱技术分离,洗脱液为甲醇系统,分段收集,点板,含有红色斑点的馏分合并,再用ODS柱色谱技术进一步纯化,水-甲醇系统梯度洗脱,在甲醇/水体积比为70∶30的洗脱液中得到化合物(Ⅲ),5 mg,甲醇/水体积比为90∶10的洗脱液中得到化合物(Ⅰ),10 mg,甲醇/水体积比为95∶5的洗脱液中得到化合物(Ⅱ),30 mg。
2 化合物结构鉴定
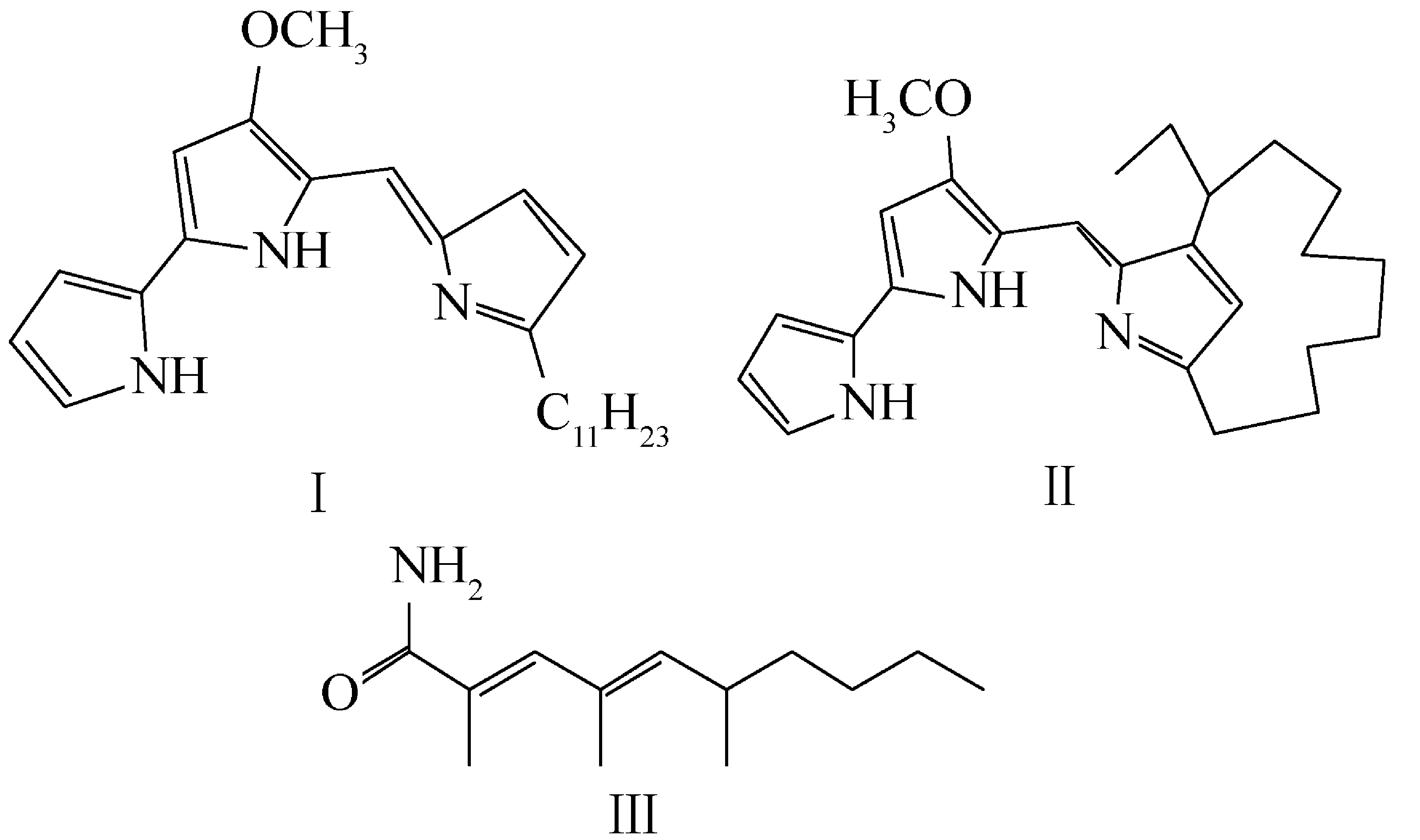
化合物Ⅰ:红色固体,易溶于氯仿、甲醇等有机溶剂,分子式C25H35N3O, HRESI-MS: [M+H]+m/z394.282 9 (计算值 C25H36N3O,394.285 8);1H NMR(400 MHz,CDCl3)δ: 12.85(s,1H),12.67(s,1H),12.63(s,1H),7.22(s,1H),6.97(s,1H),6.92(m,1H),6.81(t,2.8 Hz,1H),6.33(td,2,4 Hz,1H),6.12(dd,1.2,3.6 Hz,1H),6.05(d,1.6 Hz,1H),3.99(s,3H),2.91(t,7.6 Hz,2H),1.74(m,2H),1.62(m,2H),~1.22 (m,14H),0.85(t,6.8 Hz,3H);13C NMR(100 MHz,CDCl3)δ: 166.2(C),153.2(C),148.8(C),129.3(CH),127.5(CH),126.0(C),122.3(C),121.6(C),118.0(CH),116.3(CH),112.7 (CH),112.2(CH),93.0 (CH),58.8(CH3),31.9(CH2),29.6(CH2),29.6(CH2),29.5(CH2),29.4(CH2),29.3(CH2),29.3 (CH2),29.2(CH2) ,28.4(CH2),22.6(CH2),14.1(CH3)。经与文献[9]对比,确定化合物Ⅰ为Undecylprodigiosin。
化合物Ⅱ:红色固体,易溶于氯仿、甲醇等有机溶剂,分子式C25H33N3O,HRESI-MS: [M+H]+m/z392.266 4 (计算值C25H34N3O,392.270 2);1H NMR(400 MHz,CDCl3)δ: 12.69(s,1H),12.58(s,1H),12.52(s,1H),7.18(m,0.8 Hz,1H),7.01(s,1H),6.88(m,1H),6.30(td,2.4,3.6 Hz,1H),6.23(d,1.6 Hz,1H),6.07(d,1.6 Hz,1H),4.01 (s,3H),3.17 (m,1H),2.73(m,1H),2.52(m,1H),1.76~0.99(m,14H),0.85(t,7.2 Hz,3H),0.19(m,1H);13C NMR(100 MHz,CDCl3)δ: 165.7(C),154.1(C),150.2 (C),147.4(C),126.7(CH),125.9(C),122.2(C),120.5 (C),116.8 (CH),113.2(CH),112.3(CH),111.6(CH),92.8(CH),58.6(CH3),39.6(CH),34.3(CH2),29.8(CH2),28.9(CH2),27.2(CH2),26.7 (CH2),26.5(CH2),25.5(CH2),24.4(CH2),22.7(CH2),12.5 (CH3)。经与文献[10]比对,确定化合物Ⅱ为metacycloprodigiosin。
化合物Ⅲ:无定形白色固体,易溶于氯仿、甲醇等有机溶剂,分子式C13H23NO,1H NMR(400 MHz,CDCl3)δ: 6.83 (s,1H),5.73 (brs,2H),5.30(d,9.6 Hz,1H),2.44 (m,1H),2.02(d,1.2 Hz,3H),1.81(d,0.8 Hz,3H),1.25(m,6H),0.97(d,8.8 Hz,3H),0.89(t,6.8 Hz,3H);13C NMR(100 MHz,CDCl3)δ: 173.1(C),142.2(CH),140.2(CH),130.2(C),127.2(C),37.2(CH2),32.9(CH),29.9(CH2),22.9(CH2),20.9(CH3),16.6(CH3),14.2(CH3),14.2(CH3)。经与文献[11] 比对,确定化合物Ⅲ为抗菌素SW-B, (2E,4E) -2,4,6 -trimethyldeca -2,4 -dienamide。
3 讨 论
化合物Ⅲ的分子式是通过归属1H NMR和13C NMR中碳和氢的共振信号得到,经与文献[11]比对,确定其分子结构。在化合物Ⅲ的分子结构中有两个含一个季碳的双键,使得双键的Z-,E-构型无法通过烯烃质子的特征耦合常数来确定,经测试化合物Ⅲ的 NOESY谱,在NOESY谱中化合物Ⅲ的3-H(烯质子)与5-H(烯质子)有NOE相关信号,证实化合物Ⅲ分子中的两个双键为E-构型,结构最后确定为(2E,4E) -2,4,6 -trimethyldeca -2,4 -dienamide。化合物Ⅲ是手霉素类抗菌素的结构片段,本身具有多种抗农作物致病菌活性[11]。灵菌红素类化合物Ⅰ,Ⅱ分子结构中只含有2个吡咯环,因其1H NMR谱最低场处(δ~12.8)显示3个活泼质子吸收信号,猜测这两个化合物以盐的形式存在,通过X-能谱实验,结果给出化合物Ⅰ,Ⅱ中均含有氯元素,证实这两个化合物以盐酸盐的形式存在。
海洋生态环境生存着大量的微生物,这些微生产生的抗菌活性物质对维持海水生态平衡的机制尚未被深入研究。沈亚领等[12]研究了灵菌红素对引起海洋赤潮和淡水水华的有害藻类的除藻活性,结果表明,5.0 μg/mL灵菌红素能够在24 h内将新月菱形藻、中肋骨条藻、水华鱼腥藻和微小平列藻培养液中的藻类全部杀死,除藻活性高达100%。近年,从各种不同的海洋环境,如,海水[4]、海洋鱼类附着微生物[10]、大陆架沉积物[13]、红树林[14]等中都发现了许多产灵菌红素类化合物的海洋微生物,微生物的种属也是多种多样的。这些产灵菌红素类化合物的海洋微生物对海洋生态环境的意义,有待进一步研究。本文首次研究报道了分自广东阳江原生态红树植物老鼠簕根部土壤放线菌的次级代谢产物,这一工作不仅在开发新的药物资源方面,而且在海洋生态学方面都有一定的科学意义。
参考文献:
[1]何仁发,李明月,叶波平,等.木榄根际土壤来源的曲霉属真菌F5及其抗菌活性代谢产物[J].菌物学报,2010,9(5):732.
[2]杨晓洪,顾觉奋.红树林土壤微生物与其代谢产物研究进展[J].国外医药抗生素分册,2011,32(3):97-100.
[3]WILLIAMSON N R,FINERAN P C,GRISTWOOD T,et al.Anticancer and immunosuppressive properties of bacterial prodiginines[J ].Future Microbiology,2007,2(6): 605-618.
[4]ALIHOSSEINI F,JU K S,LANGO J,et al.Antibacterial colorants: characterization of prodiginines and their applications on textile materials[J].Biotechnol Prog,2008,24(3): 742-747.
[5]DUAN X H,FU Q,WEI B,et al.Isolation of a prodigiosin-producing strain and analysis of its pigments[J].Agricultural Science & Technology,2010,11(11/12): 25-27,72.
[6]SUNDARAMOORTHY N,YOGESH P,DHANDAPANI R,et al.Production of prodigiosin fromSerratiamarcescensisolated from soil[J].Indian Journal of Science and Technology,2009,2(10): 32-34.
[7]陈华,洪葵,庄令,等.海南红树林的微生物生态分布及细胞毒活性评价[J].热带作物学报,2006,27(1): 59-63.
[8]朱九滨,洪葵,庄令,等.红树林细胞毒活性放线菌的筛选及其所产活性物质的初步研究[J].华南热带农业大学学报,2005,11(3):5-8.
[9]LIU R,CUI C B,DUAN L,et al.Potentinvitroanticancer activity of metacycloprodigiosin and undecylprodigiosin from a sponge-derived actinomyceteSaccharopolysporasp.nov[J].Arch Pharm Res,2005,28(12): 1341-1344.
[10]KAWASAKI T,SAKUAI F,HAYAKAWA Y.A prodigiosin from the roseophilin producerStreptomycesgriseoWiridis[J].J Nat Prod,2008,71: 1265-1267.
[11]HWANG B K,LEE J Y,KIM B S,et al.Isolation,structure elucidation,and antifungal activity of a manumycin-type antibiotic fromStreptomycesflaveus[J].J Agric Food Chem,1996,44: 3653-3657.
[12]刘伯雅,魏东芝,鲁思然,等.灵菌红素对有害藻类的除藻活性研究[J].中国环境科学,2010,30(4):477-482.
[13]牛燕,郑立,田黎,等.海洋细菌S- 9801代谢产灵菌红素最佳培养条件的研究[J].中国海洋药物杂志,2009,28(3): 17-22.
[14]何碧娟,姜发军,许铭本,等.红树林细菌发酵产灵菌红素条件研究[J].广西科学,2010,17(4) : 373- 376.
