钌(Ⅱ)配合物合成、表征与DNA 相互作用及其抗氧化性研究*
2012-05-09闻伴康罗简胜潘堪尚
徐 丽,何 娟,闻伴康,罗简胜,潘堪尚
(广东药学院医药化工学院,广东中山 528458)
钌多吡啶金属配合物具有丰富的光物理﹑光化学性质,能够用来设计DNA分子探针,DNA分子光开关和特定位置的DNA断裂试剂[1]。近年来的研究表明钌(Ⅱ)多吡啶金属配合物还具有断裂和压缩DNA特性[2-3]。随着人们对金属配合物与DNA作用的深入研究,普遍认为小分子化合物与DNA的作用方式有共价结合和非共价结合,非共价结合包括静电作用、面式结合和插入结合三种作用机理,而许多重要的应用要求配合物以插入方式与DNA结合。本文设计合成了一个新颖的钌(Ⅱ)多吡啶配合物。在后续的研究中采用元素分析,质谱和1H NMR对其进行表征,用电子吸收光谱、黏度测试、Job-plot荧光滴定法等手段系统研究配合物与DNA作用机理。通过凝胶电泳实验进一步研究该配合物诱导pBR322DNA断裂及压缩pGL3 DNA。
1 实验材料,仪器与方法
1.1 试剂和仪器
所用化学试剂均为分析纯,使用前未经进一步纯化。小牛胸腺DNA购自华美公司,配合物用5 mmol/L Tris-HCl,50 mmol/L NaCl(pH=7.2)缓冲溶液配制。LCQ电喷雾质谱仪(ESMS,Finnigan),Perkin-Elmer240元素分析仪,Bruker DRX-500型核磁共振仪,Shimadzu UV-2501 PC型紫外-可见光谱仪,Ubbelodle黏度测定仪。
1.2 实验方法
紫外-可见吸收光谱实验中,在参比池和样品池中分别加入等量的DNA以消除DNA本身的吸收,当配合物的电子吸收光谱不再变化,此时吸收滴定达到饱和。配合物与DNA结合常数根据下列方程求得[4]
式中,εa,εf,εb分别是配合物与DNA结合、自由配合物和配合物与DNA结合达到饱和时的摩尔吸光系数,K为结合常数。测量黏度时,温度固定在(25±0.1)℃。测试液配制方法:固定DNA的浓度,逐渐增加配合物的浓度,相对黏度按下式计算
η= (t-t0)/t0
式中,t0为缓冲溶液流经毛细管所需时间,t为DNA溶液(含不同浓度的配合物)流经毛细管所需时间。以(η/η0)1/3对结合比率r(r=[Ru]/[DNA])作图。η0为未加配合物的溶液的相对黏度;配合物与CT DNA结合比的计算通过jot-polt荧光滴定曲线获得。配制钌配合物和CT DNA的混合溶液,使[配合物]/[CT DNA]的比值按一定的比例逐步递增,但保持它们的总浓度为 50 μmol/L。在500~750 nm范围监测配合物的荧光光谱变化。用460 nm光源激发,记录发射光波峰和发光强度。通过 Job-plot曲线找到配合物与CT DNA结合比。
1.3 琼脂糖凝胶电泳光断裂实验及配合物压缩pGL 3 DNA
将0.5 μg/μL pBR322 质粒DNA 溶液原液稀释为0.1 μg/μL,在0 ℃下保存。用TBE电泳缓冲液(pH 7.5)配制ρ=1.2%的琼脂糖凝胶。向容量200 μL 的eppendorf微量反应管加入1 μL pBR322DNA溶液,加入缓冲液,并加入1 μL 一定浓度的配合物溶液,再混匀并使反应液的终体积保持在10 μL。 然后用365 nm 波长的紫外光下照射30 min后,加入10×loading buffer 凝胶载样缓冲液1 μL。加样并使用成都比郎BG-Power-600型通用电泳仪在90 V,75 mA的恒压恒流下电泳90 min,结果用Alpha Innotech IS-5500全自动紫外与可见分析装置拍摄,并用BANDSCAN 生物图像分析系统进行处理。
1.4 抗氧化机理实验
抗氧化机理实验是依据Fenton体系产生羟基自由基,研究配合物(DMF介质中溶解)对清除羟基自由基的效果,进而推测配合物的抗氧化活性[5]。实验测试的5 mL溶液中含有如下物质:番红精(28.5 μmol/L),EDTA-Fe(Ⅱ)(100 μmol/L),双氧水(44.0 μmol/L),所测试的配合物(0.2~1.4 μmol/L)和磷酸盐缓冲液(67 mmol/L)。测试溶液在37 ℃水浴中孵育30 min后,在520 nm波长下测试吸光度值3次,求平均值。依据公式(Ai-A0)/(Ac-A0)× 100%计算配合物对羟基自由基的清除率而得知配合物的抗氧化能力的大小。式中,Ai是测试配合物存在时的吸光度值,Ac是配合物、EDTA-Fe(Ⅱ)和双氧水不存在时的吸光度值,A0是配合物不存在时的吸光度值。
1.5 配合物[Ru(dip)2(DBHIP)](ClO4)2的合成与表征
称取cis-[Ru(dip)2Cl2]·2H2O 0.436 g (0.5 mmol)和DBHIP 0.235 g (0.5 mmol)放入30 mL乙二醇中,加热至150 ℃氩气保护下反应8 h,得红色清液[ 6-7 ]。冷却至室温,过滤,加40 mL水稀释后,加入NaClO4的饱和溶液即产生大量红色沉淀,抽滤,干燥。将干燥后的粗产品用少量乙腈溶解,用中性氧化铝(200目)柱分离。用乙腈-甲苯(V∶V=3∶1)混合溶剂淋洗下收集红色组分。然后减压,蒸去溶剂,得红色晶体。产率65%。 C67H42N8Br2O9Cl2Ru元素分析计算值(w/%):C,56.08; H,2.95; N,7.81%; 实测值(w/%): C,55.94; H,2.76; N,8.02%。ES-MS (CH3OH)m/z: 1 335.5 [(M-ClO4)]+,1 235.7 [(M-2ClO4-H)]+,618.3 [(M-2ClO4)]2+。1H NMR(DMSO-d6)δ:9.13 (d,2H,J= 8.0 Hz),8.47 (s,4H),8.34 (d,4H,J= 5.5 Hz),8.27 (d,2H,J= 5.0 Hz),8.18 (d,4H,J= 5.5 Hz),7.91 (s,2H),7.82 (d,2H,J= 5.5 Hz),7.71~7.58 (m,20H)。
配合物的结构见图1。
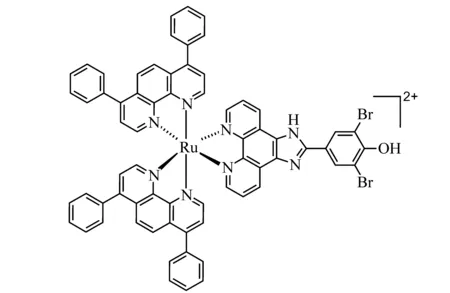
图1 配合物[Ru(dip)2(DBHIP)]2+的结构
2 结果与讨论
2.1 配合物与DNA相互作用的电子光谱研究
随着小牛胸腺DNA加入,配合物的电子吸收光谱发生减色和一定程度红移。对于配合物,金属到配体电荷跃迁(MLCT)峰(460 nm),在室温时减色率为22.3%,红移3 nm(图2),这是因为配合物的插入配体插入到DNA碱基对之间,与碱基对发生π电子堆积后,其π*空轨道与碱基的π电子轨道发生偶合,能级下降,从而导致π-π*跃迁能量减小,产生红移;同时,偶合后的π轨道因部分填充电子,使π -π*跃迁几率减小,产生减色效应。配合物与DNA作用的结合常数为K=1.91×104mol·L,配合物与DNA的结合常数与经典的嵌入键合配合物的键合常数(1.1×104~4.8×104mol·L)相近,这一结果说明配合物与DNA之间可能是通过插入作用结合的。
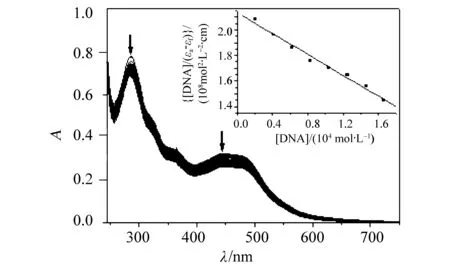
图2 Tris-HCl缓冲溶液中配合物与DNA 作用紫外可见光谱变化图
2.2 黏度测试
配合物与小牛胸腺DNA以插入方式结合时,DNA溶液的黏度增加,以部分插入方式与DNA结合时,DNA溶液的黏度降低;以静电或沟面方式结合时,DNA溶液的黏度变化不大。图3表示配合物与DNA作用黏度变化图。配合物是典型的DNA插入试剂,与DNA溶液作用时黏度明显升高。
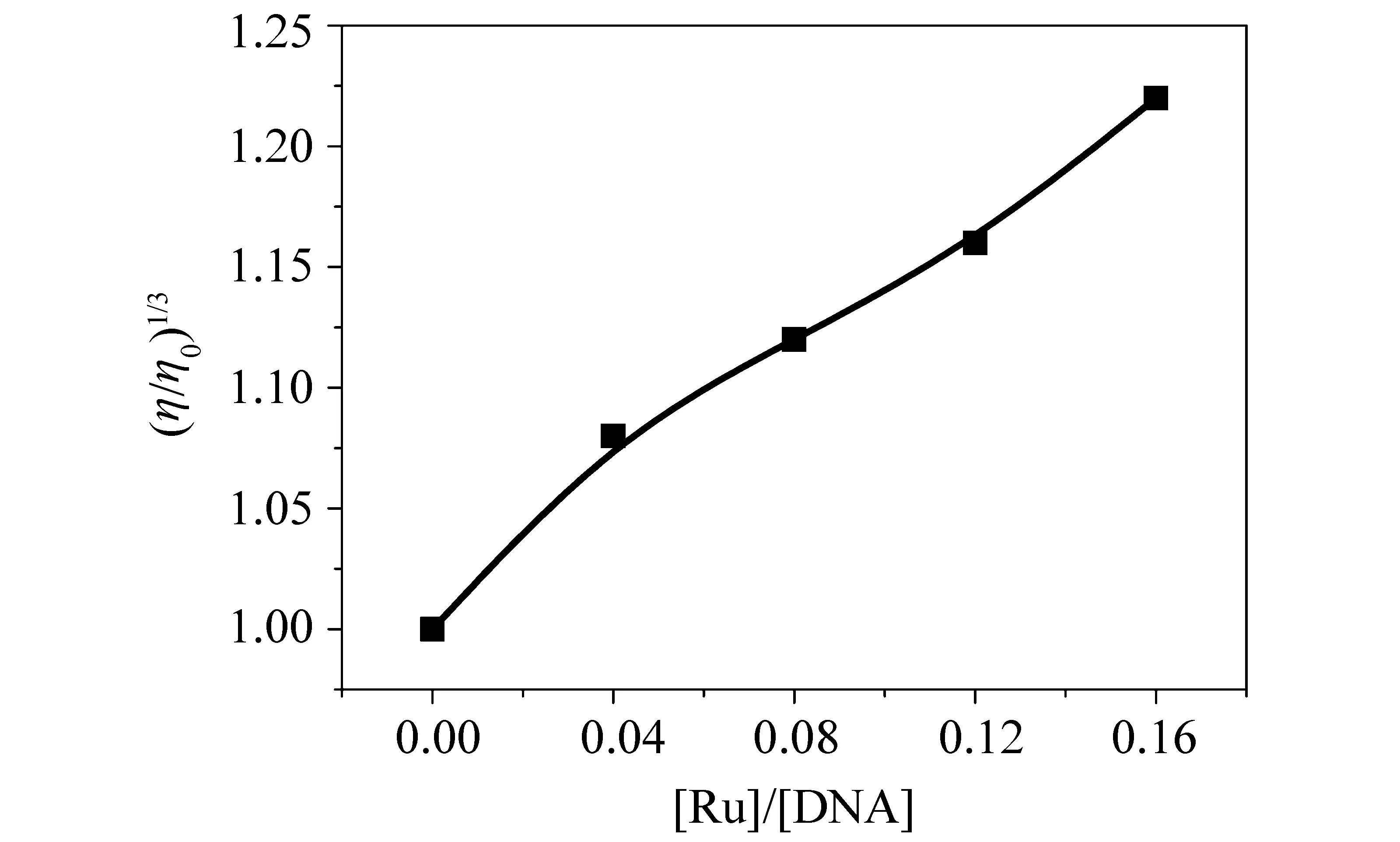
图3 恒温(25±0.1)℃,当溶液中[DNA]=0.25 mmol/L时,按照一定比例增加配合物浓度得到的黏度变化图
2.3 配合物与CT DNA相互作用的结合计量比
我们采用了Job-plot荧光滴定法确定配合物与CT DNA作用比例(如图4)[8]。不同比例但总浓度保持一致的系列配合物-DNA混合样品进行荧光光谱测定。读取配合物的特征发射峰值,将发射峰值对配合物的百分含量作图,拟合线的拐点相应x轴读数即为饱和反应的配合物的含量。结果显示配合物和CT DNA的Job-plot拟合线的拐点对应x值为0.63即配合物与CT DNA的结合比例为2∶1。
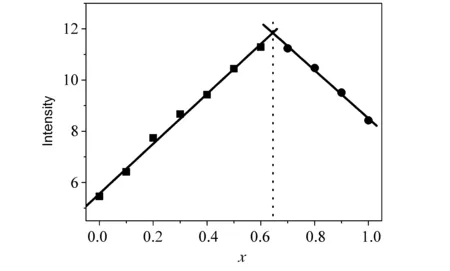
图4 配合物与DNA job-plot 荧光曲线图
2.4 配合物的不同浓度梯度对质粒DNA 的光切割影响
质粒DNA 通常有3种构型: Form Ⅰ 为共价闭环超螺旋型,其结构紧密,电泳迁移速率最快; Form Ⅱ 为开环缺刻型,双链中的一条出现了一个至几个切口,其结构松散,电泳迁移速率最慢;Form Ⅲ 型为开放的线状结构,DNA 双链在同一部位被切断,电泳迁移速率介于前两者。 在相同条件下,利用琼脂糖凝胶电泳法研究了在不同浓度情况下的配合物[Ru(dip)2(DBHIP)](ClO4)2与DNA 结合并经紫外线照射后对DNA 的切割情况,实验结果见图5。 由图可知,在365 nm 的紫外线照射下,不同浓度的[Ru(dip)2(DBHIP)](ClO4)2都具有光切割DNA 的性质。 研究结果表明随着浓度的增加,配合物对DNA 切割作用越来越强。图中pBR322 DNA 的Form Ⅰ型的量随着配合物浓度的上升不断被切割转化为Form Ⅱ 型。

图5 在365 nm 的紫外光照射30 min 后不同浓度配合物对pBR322 质粒DNA进行光切割的凝胶电泳图
2.5 配合物压缩pGL3 DNA
配合物与超螺旋质粒pGL3 DNA作用后,如果能诱导DNA发生缩合,DNA体积将增大,因而在凝胶中的迁移速率减少,迁移距离变短。随着配合物的浓度的增加,DNA的迁移距离逐渐减少直至为零,配合物能压缩DNA[9]。图6为配合物压缩pGL3 DNA的凝胶电泳实验图。从图中可以看出,在配合物的浓度≤ 4 mmol/L时,随着浓度的不断增大,Form Ⅰ逐渐变少;随着浓度逐渐增大到6 mmol/L时, Form Ⅰ已经完全消失。
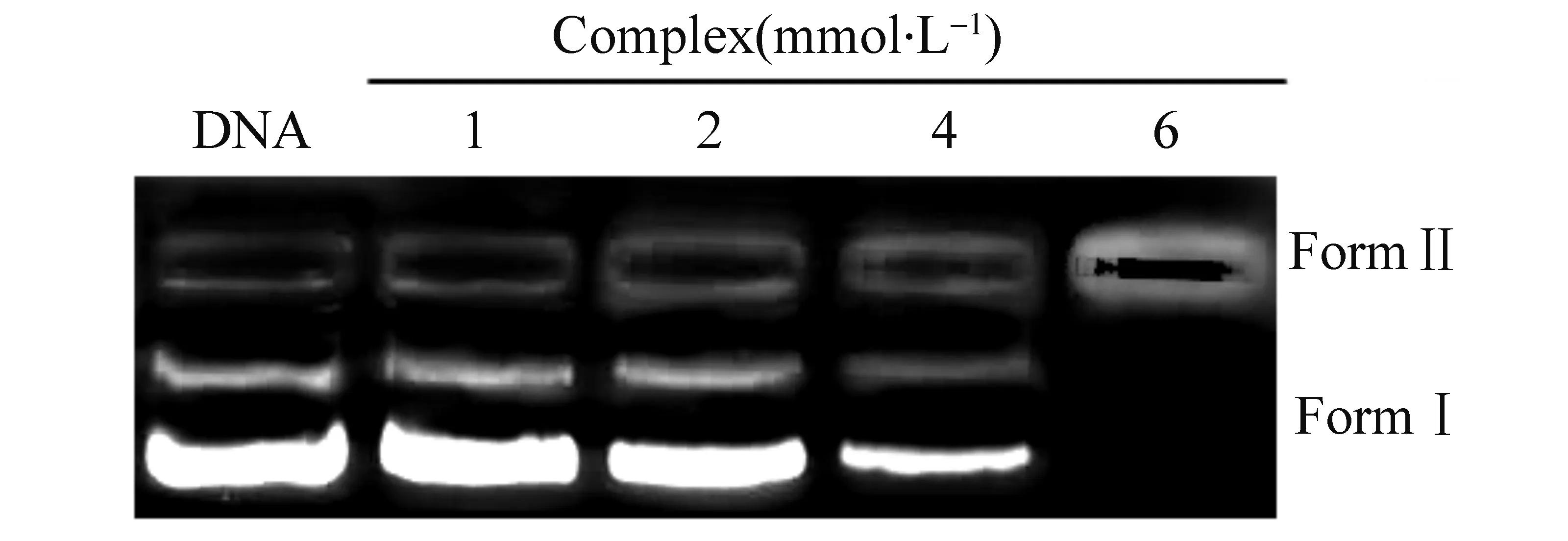
图6 配合物压缩DNA凝胶电泳图
2.6 配合物抗氧化机理研究
人体内的氧化还原反应主要是通过羟基自由基和超氧阴离子引起DNA的损伤。这种损伤是导致人衰老而且被认为是破坏性最强的损伤。因此,消除此类自由基是抗氧化性实验的主要目标。我们根据配合物消除羟基自由基能力的大小考察配合物的抗氧化性能力大小(图7)。当配体形成配合物以后,抗氧化能力明显增强。
3 结 语
本文合成了钌一个新的(Ⅱ)多吡啶配合物[Ru(dip)2(DBHIP)](ClO4)2,用元素分析、质谱和1HNMR进行表征,通过电子吸收滴定、黏度和Job-plot荧光滴定实验研究配合物与DNA作用,结果表明配合物与DNA之间以插入方式结合。进一步通过凝胶电泳实验研究表明配合物诱导pBR322DNA断裂及压缩pGL3 DNA。抗氧化性实验表明配合物在较低浓度时显示出较高的清除羟基自由基的能力,同时它的抗氧化能力强于配体。这主要是因为配体键合到中心金属离子形成配合物增强了配体的抗氧化性能。
参考文献:
[1]MAHESWARI P U,PALANIANDAVAR M.DNA binding and cleavage activity of [Ru(NH3)4(diimine)]Cl2complexes[J].Inorg Chim Acta,2004,357(4): 901-912.
[2]LIU Y J,LIANG Z H,LI Z Z,et al.Cellular uptake,cytotoxicity,apoptosis,antioxidant activity and DNA binding of polypyridyl ruthenium(II)complexes [J].J Organomet Chem,2011,696: 2728-2735.
[3]SUN B,GUAN J X,XU L,et al.DNA condensation induced by ruthenium(II)polypyridyl complexes[Ru(bpy)2(PIPSH)]2+and [Ru(bpy)2(PIPNH)]2+[J].J Inorg Chem,2009,48:4637-4639.
[4]WOLF A,SHIMER Jr G H,MEEHAN T.Polycyclic aromatic hydrocarbons physically intercalate into duplex regions of denatured DNA [J].Biochemistry,1987,26: 6392-6396.
[5]HICKMAN J A.Apoptosis induced by anticancer drugs [J].Cancer Metast Rev,1992,11:121-139.
[6]SULLIVAN B P,SALMON D J,MEYER T J.Mixed phosphine 2,2’-bipyridine complexes of ruthenium [J].Inorg Chem,1978,17: 3334-3341.
[7]LIU Y J,ZENG C H,LIANG Z H,et al.Synthesis of ruthenium(II)complexes and characterization of their cytotoxicityinvitro,apoptosis,DNA-binding and antioxidant activity.[J] Eur J Med Chem,2010,45: 3087-3095.
[8]JOB P.Formation and stability of inorganic complexes in solution [J].Ann Chim (Paris),1928,9: 113-203.
[9]MANN A.DNA condensation by poly-L-lysine at the single molecule level: role of DNA concentration and polymer length [J].Journal of Controlled Release,2008,125: 252-262.
