苯酚和二氧化碳合成碳酸二苯酯的热力学分析
2012-05-07李小鹏郑立辉宋光森范国枝胡廷平
李小鹏,郑立辉,宋光森,范国枝,胡廷平
(武汉工业学院化学与环境工程学院,湖北 武汉 430023)
碳酸二苯酯(DPC)是一种重要的碳酸酯,无毒、无污染,是有机化合物和高分子化合物的合成原料[1]。DPC的合成方法有光气法、氧化羰基法、酯交换法、尿素法和二硫化碳法[2]。 Li等[3]对苯酚和二氧化碳合成DPC的反应进行了研究,Fan等[4]研究了在四氯化碳存在下、以氯化锌作催化剂时合成DPC的反应,提出了可能的反应机理。
从热力学角度进行分析,找出合理的反应条件,以提高DPC的选择性和收率,对指导DPC的合成具有重要意义。为此,作者对以苯酚和二氧化碳为原料合成DPC的过程进行了热力学分析。
1 热力学分析方法的选择
对化学反应进行热力学分析,常用的方法有两种:一种是从ΔrG=ΔrH-TΔrS出发,计算不同温度下反应的标准摩尔吉布斯自由能的变化(ΔrG)和平衡常数,当反应物及产物处于液态时,根据经验公式估算不同温度下液体的蒸发焓、气态熵和液体熵[5,6],但估算的数值较多,比较繁琐;另一种是首先依据标准摩尔生成吉布斯自由能(ΔfGθ)的定义[7],根据理想气体状态热容等数据计算不同温度下反应物和产物的标准摩尔生成吉布斯自由能,然后计算反应的摩尔吉布斯自由能的变化(图1)。

i.物质种类 TK.温度 ps.温度为TK时物质的饱和蒸汽压
1.1 不同温度下的理想气体状态摩尔生成吉布斯自由能的计算
根据标准摩尔生成吉布斯自由能的定义计算不同温度下的理想气体状态摩尔生成吉布斯自由能。处于标准状态的单质及处于理想气体状态的相应化合物的热力学性质及理想气体状态恒压热容数据见表1。

表1 计算理想气体状态标准摩尔生成吉布斯自由能所需数据
将得到的各物质的理想气体状态的标准摩尔生成吉布斯自由能进行多项式拟合,得到:
ΔfGθ=L+MT+NT2
各物质的系数如表2所示。
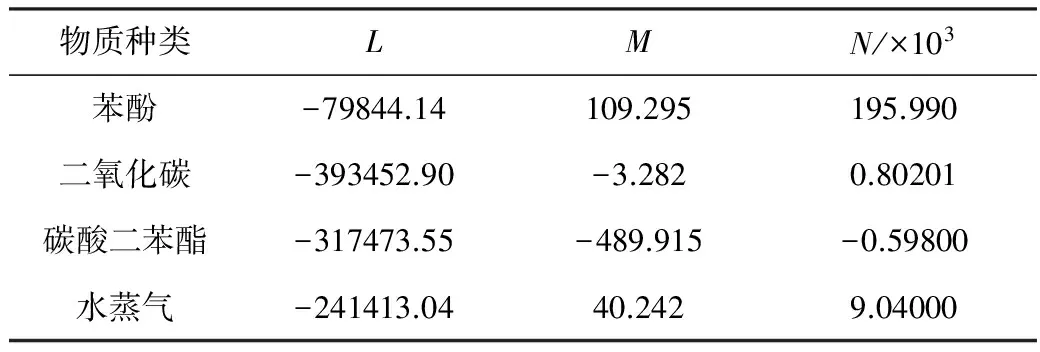
表2 理想气体状态标准摩尔生成吉布斯自由能随温度变化的系数
1.2 △G1(i,TK)、△G2(i,TK)的计算
△G1(i,TK)是理想气体状态摩尔吉布斯自由能随压力的变化,可由下式计算:

其中苯酚的饱和蒸汽压参照文献[11]计算,二氧化碳的饱和蒸汽压取8 MPa,水的饱和蒸汽压取自文献[8],DPC的饱和蒸汽压依据三参数对应态原理估算[12];DPC的物性参数取自文献[13],其余物质的物性参数取自文献[9]。
△G2(i,TK)是偏离摩尔吉布斯自由能,是指处于理想气体状态的物质变化到处于同温同压下实际气体状态的摩尔吉布斯自由能的变化,依据三参数对应态原理计算[12],物性参数如表3所示。

表3 物质的物性参数
△G3(i,TK)表示物质处于汽液两相平衡。按照相平衡原理,对苯酚、水蒸气及DPC来说,因为处于汽液平衡状态,△G3(i,TK)为零;对二氧化碳来说,因为不存在汽液平衡,故不考虑△G3(i,TK)。
2 结果与讨论
2.1 理论计算结果(表4)
表4计算结果中水蒸气和二氧化碳的数据是可靠的,误差主要来自于苯酚和碳酸二苯酯。
苯酚的摩尔生成吉布斯自由能随温度的升高而增大,甚至出现正值,这种变化趋势超出预期,但仍然是可信的,因为另一个表示理想气体状态苯酚摩尔生成吉布斯自由能与温度的关系公式[14]:
△fG(苯酚,TK)=-97.896+0.2114T+1.9980×10-5T2
该公式的摩尔生成吉布斯自由能的单位是kJ·mol-1,表现出相同趋势。
碳酸二苯酯的计算误差主要来自理想气体状态恒压热容数据。
由于所求温度下平衡常数是一个很大的正值,因此在计算温度范围内不考虑平衡常数随温度的变化,计算苯酚平衡转化率随二氧化碳与苯酚摩尔比的变化,结果见表5。

表4 计算结果

表5 苯酚平衡转化率随二氧化碳与苯酚摩尔比的变化
由表5可知,随二氧化碳与苯酚摩尔比的增大,苯酚平衡转化率逐渐升高;当二氧化碳与苯酚摩尔比大于2∶1后,苯酚平衡转化率变化不大。因此,二氧化碳与苯酚摩尔比以2∶1为宜。
2.2 验证实验
在相同条件下,反应温度对碳酸二苯酯收率的影响见表6。

表6 反应温度对碳酸二苯酯收率的影响
由表6可知,尽管所使用的催化剂不同,但实验结果与热力学分析是一致的,即高温有利于苯酚和二氧化碳转化生成碳酸二苯酯,温度在200 ℃以下为宜,但实验的收率偏低。文献[3]的结果也与热力学分析是一致的。
相同条件下,仅改变二氧化碳压力时,碳酸二苯酯收率与理论分析基本一致,这也证明了热力学分析所得到的结论是可靠的。尽管有个别数据点与上述分析矛盾,但并不妨碍分析结论的可靠性。
3 结论
根据经典热力学原理,计算了苯酚和二氧化碳合成碳酸二苯酯的反应在不同温度下的摩尔吉布斯自由能变化。结果表明:高温有利于苯酚和二氧化碳转化生成碳酸二苯酯,考虑到设备耐压及能耗,温度在200 ℃以下为宜;苯酚平衡转化率随二氧化碳与苯酚摩尔比的增大而升高;在其它条件相同时,升高二氧化碳压力对平衡有利。该方法计算简便、估算数据较少、准确度较高、思路通用性较强,可用于化学反应的热力学分析。
参考文献:
[1] Bottenbruch L,Farbenfabriken B G.Polycarbonate in Encyclopedia of Polymer Science and Technology(Vol 10)[M].New York:Wiley,1969:710-760.
[2] 陈志明,姜日元,牛俊,等.非光气法合成碳酸二苯酯研究进展[J].化工科技,2004,12(1):53-56.
[3] Li Zhenhuan,Qin Zhangfeng.Synthesis of diphenyl carbonate fr-om phenol and carbon dioxide in carbon tetrachloride with zinc halides as catalyst[J].Journal of Molecular Catalysis A:Chemical,2007,264(1-2):255-259.
[4] Fan Guozhi,Fujita Shin-ichiro,Zou Bing,et al.Synthesis of dip-henyl carbonate from phenol and carbon dioxide in the presence of carbon tetrachloride and zinc chloride[J].Catal Lett,2009,133(3-4):280-287.
[5] 邢爱华,张敏卿,何志敏,等.碳酸二甲酯与苯酚酯交换合成碳酸二苯酯热力学分析[J].化学工程,2006,34(11):40-43.
[6] 郭红霞,吕敬德,张波波.氧化羰基化法合成碳酸二苯酯过程热力学分析[J].上海化工,2008,33(3):7-10.
[7] 傅献彩,沈文霞,姚天扬.物理化学(第四版)[M].北京:高等教育出版社,1999:403.
[8] Smith J M,Van Ness H C,Abbott M M.Introduction to Chemical Engineering Thermodynamics[M].北京:化学工业出版社,2002:657-660.
[9] Poling B E,Reid R C,Prausnitz J M.The Properties of Gases and Liquids(5th Ed)[M].New York:McGraw-Hill,2001:3.14-3.18.
[10] Yaws Carl L.Handbook of Thermodynamics Properties Diagram(2nd Ed)[M].Houston,Texas:Gulf Professional Publishing,1996:381.
[11] Green D W,Perry R H.Perry′s Chemical Engineers′ Handbook(8th Ed)[M].New York:McGraw-Hill,2008:2.59.
[12] 陈新志,蔡振云,胡望明.化工热力学(第二版)[M].北京:化学工业出版社,2005:24.
[13] Margon V,Agarwal U S,Peters C J,et al.Phase equilibria of carbon dioxide with phenol and diphenyl carbonate[J].Supercritical Fluids,2003,27(1):25-30.
[14] Branan C R.Rules of Thumb for Chemical Engineers(3rd Ed)[M].Houston,Texas:Gulf Professional Publishing,2002:379.
