T LR 2、4/M yD 88通路相关分子mRNA在急性结肠炎小鼠结肠组织中的表达及意义
2012-05-06刘丽琼廖鑫凯
刘丽琼,聂 奎*,余 姣,廖鑫凯
(1.西南大学动物科技学院,重庆 400715;2.广安区畜牧食品局,四川 广安 638000)
炎症是机体的一种非特异性防御和消灭病原微生物的积极方式,属于固有免疫的一种特殊形式,同时也是一个病理过程。但当机体免疫功能出现紊乱时,各种免疫细胞将分泌超量促炎细胞因子,产生“细胞因子风暴”而导致动物死亡,易造成脑炎、肺炎、肠炎等全身各个器官的炎症反应,最终导致动物死亡。因此,了解炎症发生的分子机制对研发新的抗炎中(兽)药以及有效防治动物炎性疾病都具有重要意义。研究表明,在机体发生炎性反应的固有免疫反应应答中,Toll样受体(TLRs)扮演着重要角色。TLRs识别外源性配体或内源性分子后,将识别信号传递给MyD88接头蛋白,MyD88再将该信号传递给核因子-кB(NF-кB)并引起NF-кB活化,进而诱导炎症因子的表达来参与炎症反应[1]。但在炎症反应过程中TLRs/MyD88通路相关分子的关系尚不清楚。本试验采用Real-time RT-PCR方法研究TLR2、TLR4及其下游MyD88依赖的免疫信号通路的关键分子在小鼠感染急性结肠炎前后多个时段结肠组织中的转录水平,旨在了解固有免疫分子在炎症中的作用及抗炎机制,为研发新型抗炎中药提供参考。
1 试验材料
1.1 试验动物
6~7周龄的SPF级昆明小鼠30只,购于重庆医科大学实验动物中心(许可证编号为SCXK渝2007-0002),雌雄各半,体重为25±2 g,试验组24只,对照组6只。
1.2 主要试剂及仪器
2,4,6-三硝基苯磺酸(TNBS)购自 Sigma公司;RNAiso Plus、PrimeScriptTMRT reagent Kit、Ex Taq DNA聚合酶、SYBR®Primix Ex TaqTMⅡ均购自TaKaRa公司。Mini Opticon Real Time PCR仪由美国Bio-Rad公司生产。
2 试验方法
2.1 建立小鼠急性结肠炎模型
将24只小鼠适应性饲养1周,禁食24 h,用乙醚将其轻度麻醉,再用涂有液体石蜡直径为2 mm的自制灌肠器经肛门缓慢插入结肠处约4 cm,灌注2.5%的TNBS乙醇溶液5 mL·kg-1,捏紧肛门并倒提5 min,苏醒后常规饲养。其余6只作阴性对照。在造模前、造模后1、3、5、7 d分别处死6只小鼠,无菌采取结肠组织,并迅速保存于液氮。
2.2 引物设计与合成
根据GenBank收录的小鼠(Mus musculus)TLR2、TLR4、MyD88、NF-κB、TNF-α、IL-10和 β-actin的mRNA序列,利用Primer Premier 5.0和Oligo 6.0软件分别设计一对引物,并用NCBI的在线软件primer-blast分析各引物的特异性,引物由上海英潍捷基贸易有限公司合成。TLR2、TLR4等基因的Real-time PCR引物见附表。
2.3 总RNA的提取和cDNA的合成
按RNAiso Plus提取试剂盒说明书提取结肠组织总RNA,并反转录成cDNA。反转录体系为:5×PrimeScript®Buffer 2 μL,PrimeScript®RT Enzyme MixⅠ0.5 μL,Oligo dT Primer(50 μM)0.5 μL,Ran⁃dom 6 mers(100 μM)0.5 μL, Total RNA 2 μL,RNase Free dH2O up to 10μL。反转录条件如下:37℃15 min,85℃5 sec。反转录产物置于-20℃保存备用。
2.4 PCR扩增各基因片段
在25μL的PCR反应体系中,加入10×Ex Taq buffer(Mg2+Free)2.5 μL,dNTP Mixture(各 2.5 mM)0.5μL,MgCl2(25 mM)1μL,上下游引物(20μM)各0.5 μL,Ex Taq DNA聚合酶0.25 μL,cDNA 2μL,灭菌ddH2O加至25μL。PCR扩增程序为:94℃预变性 5 min;94 ℃ 45 s,58 ℃ 45 s,72 ℃ 1 min,35个循环;72℃延伸5 min。2%琼脂糖凝胶电泳检测PCR产物。
2.5 建立荧光定量PCR方法
紫外分光光度仪测定TLR2、TLR4、MyD88、NF-κB、TNF-α、IL-10和 β-actin PCR 产物的浓度,用EASY Dilution将各PCR产物作10倍梯度稀释,并以此作为模板进行荧光定量PCR扩增,建立标准曲线。20μL反应体系:SYBR®Premix ExTaqTMⅡ(2×)10μL,上下游引物(20μM)各0.4μL,DNA模板2.0 μL,灭菌ddH2O 7.2 μL。荧光定量PCR反应条件为:95℃预变性20 s;95℃5 s,60℃30 s,40个循环;Dissociation stage。然后进行融解曲线、标准曲线分析。
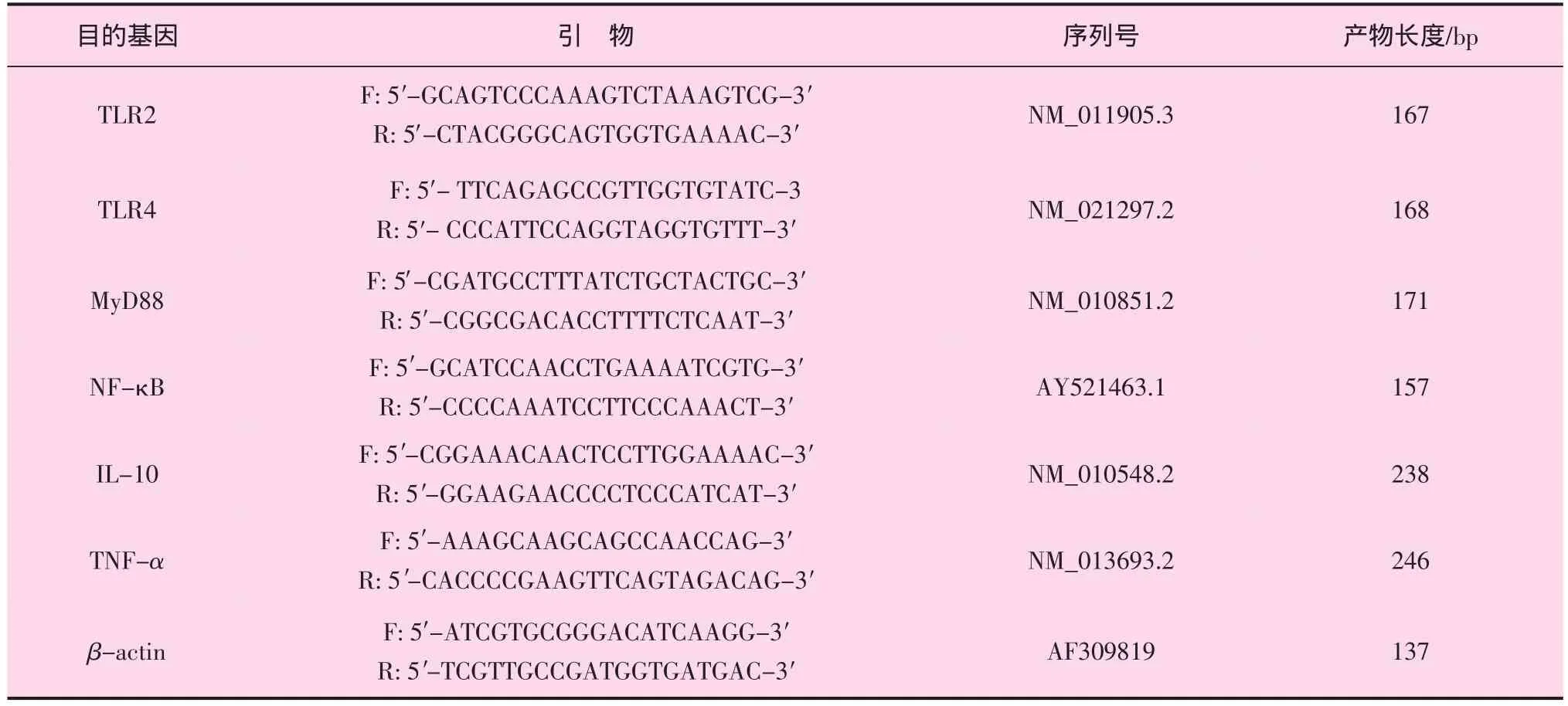
附表 TLR2、TLR4等基因的Real-time PCR引物
2.6 结肠炎小鼠结肠组织TLR2、4/MyD88信号途径相关分子mRNA表达量的检测
按2.3方法对造模前、造模后1、3、5、7 d的结肠组织进行RNA提取并反转录成cDNA。以cD⁃NA为检测模板,参照2.5的反应体系和反应条件检测 各 时 段 TLR2、 TLR4、 MyD88、 NF-κB、TNF-α、IL-10和β-actin mRNA的表达量。
2.7 数据处理
采用2-△△Ct方法分析试验数据,首先算出小鼠目的基因与内参基因β-actin的Ct差值(△Ct=△Ct目的基因-△Ctβ-actin),然后以小鼠造模前结肠组织的△Ct值为对照,用造模后4个时段的△Ct值减去造模前结肠组织的△Ct值即为△△Ct值,最后转化为相对差异倍数即QR=2-△△Ct[2]。
3 试验结果
3.1 小鼠结肠组织的总RNA提取
总RNA的提取结果见图1。
由图1可知,提取小鼠结肠组织的总RNA,经1%琼脂糖凝胶电泳,可见总RNA的特征性条带,由上至下依次为28S、18S及5S,见图1。
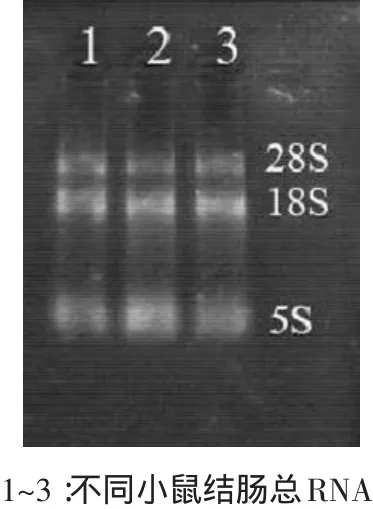
图1 小鼠结肠总RNA的琼脂糖凝胶电泳
3.2 TLR2、TLR4、MyD88等mRNAs的RT-PCR扩增
小鼠结肠各基因RT-PCR扩增结果见图2。

图2 小鼠结肠各基因RT-PCR扩增
由图2可知,以小鼠结肠组织为原料,进行TLR2、TLR4、MyD88、NF-κB、TNF-α、IL-10和β-actin的RT-PCR扩增反应,各PCR产物经2%琼脂糖凝胶电泳,可见与预期大小相符的单一目的条带。
3.3 TLR2、TLR4、MyD88等目的基因的融解曲线和标准曲线分析
通过融解曲线分析可知,TLR2、TLR4、MyD88、NF-κB、TNF-α、IL-10和管家基因 β-actin的融解温度分别为 82.0、83.5、85.5、87.5、82.0、78 和85.5℃,7个基因的融解曲线均为单峰,无杂峰和引物二聚体,说明PCR反应特异性好。标准曲线的扩增效率E值和相关系数R2值显示,TLR2(E=99.1%,R2=0.998),TLR4(E=99.0%,R2=0.997),MyD88(E=97.6%,R2=0.998),NF-κB(E=102.0%,R2=0.997),TNF-α(E=97.6%,R2=0.998),IL-10(E=100.2% , R2=0.997), β-actin(E=92.8% , R2=0.999)。
3.4 结肠炎小鼠结肠组织TLR2、4/MyD88通路相关分子mRNA的表达
结肠炎小鼠结肠组织TLR2、4/MyD88通路相关分子mRNA的表达见图3。
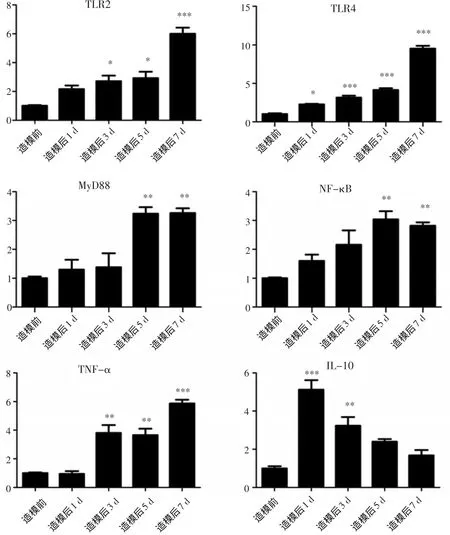
图3 TLR2、4/MyD88通路相关分子在小鼠感染结肠炎前后5个时段的相对表达量
由图3可知,试验数据经SPSS 15.0分析后发现,TLR2 mRNA在造模后3、5 d的表达量与造模前的表达量均呈显著差异(P<0.05),造模后7 d的表达量与造模前呈极显著差异(P<0.001);TLR4 mRNA造模后1 d的表达水平显著高于造模前(P<0.05),造模后3、5、7 d的表达水平与造模前的差异为极显著(P<0.001);MyD88在造模5、7 d的表达量与造模前相比具有显著差异(P<0.05);NF-κB mRNA的分析结果同MyD88;TNF-α在造模后的mRNA表达量显著高于造模前(除造模1 d外)(P<0.01);IL-10在造模后1、3 d的mRNA表达量与造模前具有显著差异(P<0.01),在造模后5、7 d的mRNA表达量与造模前差异不显著(P>0.05)。
4 讨论
Ruslan等提出的模式识别受体理论表明,机体固有免疫不是简单机械的应答外界刺激的一种低等应答形式,而是通过模式识别受体(PPRs)识别病原相关分子模式(PAMPs)而触发[3]。对PRRs的研究最多的是位于细胞表面或内涵体上的TLRs,其起到信号传递的作用,在免疫应答的诱导和炎性反应中发挥重要作用,通过MyD88依赖型信号通路和TRIF依赖型信号通路来激发固有免疫反应,而MyD88依赖信号通路是介导机体炎性固有免疫反应的主要途径。TLRs识别PAMPs后,通过胞内区的TIR结构域与MyD88 C端的TIR结构域结合将该信号传递给MyD88,MyD88 N端的死亡结构域又通过募集下游含死亡结构域的信号分子使信号向下传递,激活NF-кB,促进多种促炎细胞因子如IL-1β、IL-6、TNF-α等基因的转录和表达,抑制抑炎因子如IL-4、IL-10的表达,引发炎症反应。
本试验采用实时荧光定量RT-PCR法对结肠炎小鼠结肠组织TLR2、TLR4及其下游MyD88、NF-кB、TNF-α、IL-10 mRNA表达情况进行了检测。在造模后1 d,小鼠结肠组织的TLR2和TLR4表达比造模前显著增强,推测此时机体可能通过上调TLR2、TLR4的表达来激活下游信号分子,进而激发免疫应答。在造模后3、5、7 d,TLR2、TLR4的mRNA上调更为明显,第7天达到顶峰,提示机体免疫应答反应呈增加趋势,与程晓磊等采用RT-PCR方法研究结肠炎大鼠结肠中TLR2/4基因表达显著高于正常大鼠的结果类似[4]。董六一等用克雷伯杆菌接种大鼠后,肺组织MyD88 mRNA与TLR2/4转录水平呈正相关,均出现高表达[5]。而本试验中,MyD88在造模后1、3 d的表达略有增强,但在5、7 d异常高表达,表明MyD88也参与小鼠结肠炎的发病。NF-кB在造模后1 d开始出现上调,在造模后5 d相对表达量最高,显著高于造模前(P<0.05)。此结果与张超贤报道的NF-кB mRNA在溃疡性结肠炎大鼠体内表达量与正常大鼠无显著差异(P>0.05)不相同[6]。推测可能由于种属差异、检测方法不同等原因导致结果出现偏差。TNF-α和IL-10分别是促炎细胞因子和抑炎细胞因子,二者在炎症反应中的表达成负相关性。IL-10 mRNA在结肠炎小鼠肠上皮细胞中的表达量低,但高于正常小鼠。此次试验结果也表明了TNF-α与IL-10的动态变化关系,与前学者的研究结果相符。
5 小 结
在机体发生炎性反应的固有免疫应答中,TLR2、4能通过MyD88依赖信号通路来激发应答反应。因此,在动物炎性疾病的防治方面,可考虑通过阻断TLRs、MyD88、NF-кB等节点分子的信号传递研发抗炎药物。
[1] Stefan K D,Brian M F.The role of Toll-like receptors in chronic infl ammation[J].The International Journal of Biochemistry&Cell Biology,2010,42(4):506-518.
[2] Schmittgen T D,Livak K J.Analyzing real-time PCR data by the comparative CTmethod[J].Nat Protoc,2008(3):1 101-1 108.
[3]Ruslan M,Charles A,Janeway Jr.How does the immune system distinguish self from nonself[J].Seminars in Immunology,2000,12:185-188.
[4] 程晓磊,杜立阳,刘清芳,等.复方青黛颗粒对溃疡性结肠炎模型大鼠结肠toll样受体2,4基因表达的影响[J].中国中西医结合消化杂志,2011,19(1):14-17.
[5] 董六一,汪春彦,吴常青,等.金荞麦对克雷伯杆菌肺炎大鼠肺组织中TLR2/4,MyD88 mRNA和IκB-α表达的影响[J].中国中药杂志,2011,36(2):200-204.
[6] 张超贤,郭李柯,郭晓凤.溃疡性结肠炎模型大鼠NF-κB活性、NF-κB mRNA及TNF-αmRNA的表达及芪倍合剂的干预作用[J].西安交通大学学报,2011,32(3):319-323.
