天然牡蛎壳纳米体复合型骨材料修复桡骨缺损的研究
2012-04-24李振威谢丽丽曹阳王璐萍孔令妍薛恩兴彭磊
李振威,谢丽丽,曹阳,王璐萍,孔令妍,薛恩兴,彭磊
(1.浙江温州医学院临床系,浙江 温州 325000;2.浙江温州医学院附属二院骨科,浙江 温州 325000;3.海南医学院附属医院创伤中心 ,海南 海口 570102)
随着当今社会骨创伤、肿瘤切除、感染率的逐年升高,造成人们骨缺损的现象越来越常见。骨缺损如果范围较小,骨端可以经自身修复而愈合,但如果骨缺损范围较大,则不可能自身修复。自体骨移植被称为骨移植的金标准,但供区易发生疼痛和感染等并发症(8%~10%);异体骨移植可出现免疫排斥反应,导致骨移植失败;二者骨来源均有限,移植骨的形状很难与缺损区的解剖形状相符,会影响日后的功能。目前临床上常用的医用硫酸钙可注射型植骨材料 MIIG X3(minimally invasive injectable graft X3,美国WRIGHT公司)已经通过众多成功的动物实验和临床应用证实生物相容性、骨传导性良好[1],是一种安全有效的骨移植替代物,但其吸收速度仍稍快于自身骨替代速度[2],且机械强度仍显不足,还不适用于大段或承重骨的缺损修复[3],另外,MIIG X3目前价格较贵,不利于临床推广应用。因此 ,有必要开发新的生物骨替代材料。
我们发现温州近海牡蛎壳具有资源丰富,结构致密,强度与皮质骨相当,Currey等[4]测定牡蛎壳的强度数据与文献中牛的皮质骨相当,Mount证实牡蛎壳的形成是由粒细胞不断分泌的无机盐堆积而形成的矿物质盐[5],其近纳米颗粒的形成与骨沉积有相似的特点,颗粒中 CaCO3成分占到95.994%。最早关于牡蛎作为生物材料的报道是在1965年,研究表明将其植入小鼠体内没有任何不良反应[6]。将牡蛎壳作为新的骨替代材料的原料成为科学上的可能,将活性天然牡蛎壳和医用硫酸钙可注射型植骨材料复合制成新型仿生材料,通过将其植入兔桡骨缺损处,对其生物相容性、修复效果等方面作出评价。
1 资料与方法
1.1 牡蛎壳复合型骨材料制备步骤 取温州乐清湾无污染海域近江牡蛎,除去其内容物后留外壳。流水下冲刷清洗 3次,自然条件下风干。将风干后的牡蛎壳置于 40%乙酸溶液中浸泡 2h,取出后于流水下冲刷 3次,然后置于流水下冲洗24 h。蒸馏水清洗 3次,于自然条件下风干。机械方法将牡蛎壳碾压成颗粒状,分别用 40目和 100目过滤筛过滤,得到约0.15 mm大小的牡蛎壳粉末。采用溶液共混法制备:把消磨后的牡蛎壳碳酸钙粉剂放入乙醇和氯仿中48h进行脱脂,再浸泡在双氧水中进行脱蛋白处理,完成好以上的脱抗原处理后将牡蛎壳碳酸钙粉剂与 MIIG塑形剂按 1∶5混合,固化后期在预制品表面嵌入成孔材料,并采用熔解成孔材料的方法在预制品表面形成直径达 200~400μm的孔隙,并用排液法测定孔隙率为 40%~50%。根据实验动物的骨缺损,制作直径0.5 cm、长度1.0 cm略带圆饼状的人工桡骨替代材料。预制品常规高温高压消毒后备用。把制作好的骨材料进行扫描电镜观察,证实诱导新生骨生长的骨材料的基础性能:骨板交通及近纳米颗粒的组成 (见图1)。
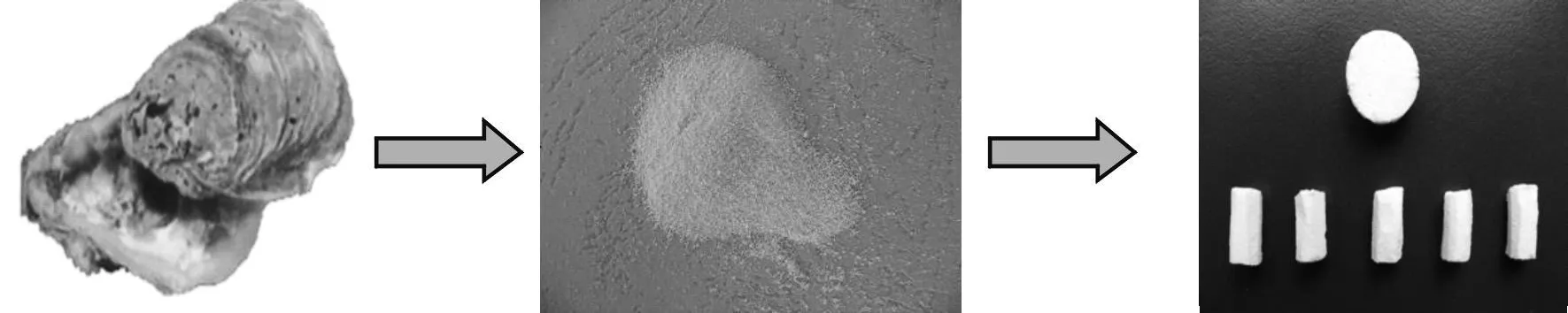
图1 牡蛎壳复合型骨材料的制备过程
1.2 牡蛎壳复合型骨材料体内生物相容性试验
1.2.1 实验动物及动物模型 将制备完成的骨材料在生物力学测试机上进行抗压力、抗剪力和抗扭力等检测。选择36只日本健康成年纯种大耳白兔作为实验动物,体质量为 2.5~3.3 kg,将实验动物随机分成 A、B、C三组 (每组 12只),使用 0.1 g/mL水合氯醛 4 mL/kg进行耳缘静脉注射麻醉 ,手术制备出双侧桡骨骨缺损模型,桡骨骨缺损大小为1.0cm;A组植入取自髂骨的自体骨,为对照组 1,B组植入MIIG人工骨,为对照组 2,C组植入相同大小牡蛎壳人工骨,为实验组,术后予以抗感染治疗,分别在第2、4、8、12周末时随机处死动物,每组每批处死 3只(A、B组左侧桡骨为实验对象,C组右侧桡骨为实验对象)。
1.2.2 体内生物相容性检测 观察收集动物术后饮食、活动、手术切口愈合情况及植入骨材料周围组织生长结合情况等资料。通过X线摄片观察兔桡骨中段骨材料植入区和骨组织结合情况,材料周围骨质密度及钙化情况。分别对三组进行组织学检测,通过 HE染色光学显微镜观察实验组与对照组 1、2植入区新骨形成、骨愈合、生物相容性等情况。
1.2.3 生物力学检测 术后12周,常温常压下,取三组各3只兔,处死后取出双侧桡骨,一起用 IN STRON生物力学测试系统进行三点抗弯强度测试,跨距40mm,加载速度5mm/min,应力下降 50%~60%停止加载 ,比较三组桡骨的抗弯曲强度。
2 结 果
2.1 扫描电镜观察骨材料交通 牡蛎壳体骨材料是由直径在 100~300nm的近纳米颗粒成团簇状构成,其团簇结构成肉眼无规则形式。其表面上不规则地排列着直径在200~400 μm的孔洞,这些孔洞是由不规则的片状层构成。骨材料板间有相互沟通的管道系统相联系,最宽的管道达 600 nm,平均在 300 nm之间,这和人体骨的骨板、哈佛氏管与浮克曼管的数量、密度、形状、孔径、走向规律相类似。骨材料板状体是不规则排列的,主要以横、纵两个方向排列为主。从结构力学的角度上来说,这种结构具有很大的稳定性,既可以抗压又可以抗拉,强化了整体的结构(见图2)。
2.2 牡蛎壳复合型骨材料体内生物相容性试验结果
2.2.1 大体标本及X线摄片结果(A组自体骨组、B组MIIG组、C组牡蛎壳复合型骨材料组) 术后动物饮食良好,活动正常。术后1~3 d步态不稳,以后逐渐恢复正常。伤口愈合良好,无一例感染或积液,不用拆线,线结10 d左右自行脱落,无化脓、感染,无意外死亡。
植入后 2周,术区伤口愈合,仅缝线处有轻微红肿。A、B、C组在桡骨植入床中有轻微的松动、但无塌陷,表面被骨膜完整包裹,包裹 C组骨材料的骨膜及软组织无坏死和积液,表面的孔隙中充满未完全机化的血凝块及肉芽组织,A、B组则较少。 X线摄片,骨材料与自体骨组织均为高密度影,B、C组植入区内骨材料的密度低于周边正常骨组织。材料与桡骨缺损之间边界清晰,移植区投射分界影像明显,未见明显的骨修复迹象。
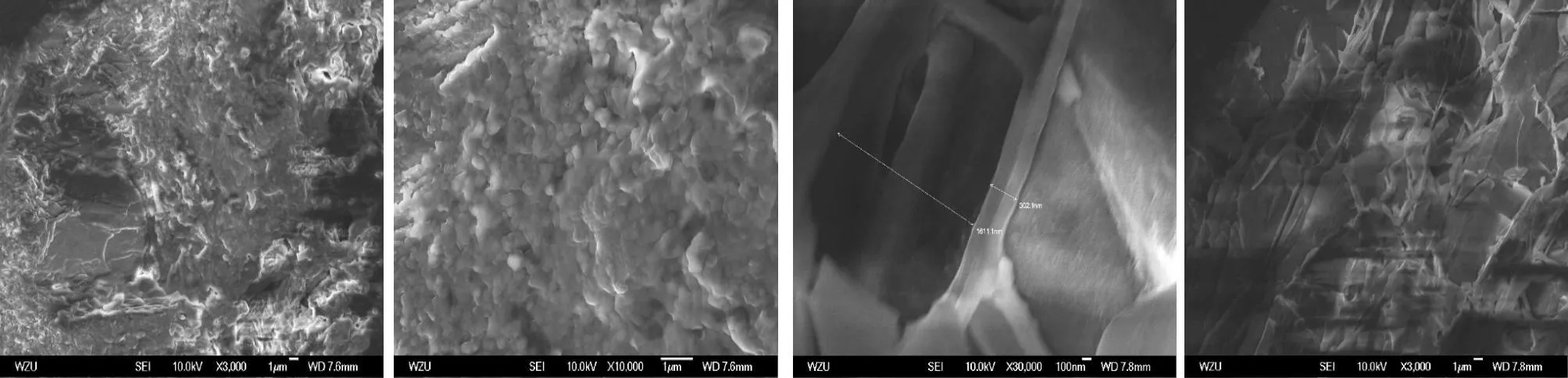
图2 骨材料孔洞、骨板交通、近纳米颗粒结构
植入后 4周,B、C组骨材料在植入床内无移位及松动,C组术区表面软组织膜包裹完整,结缔组织较2周时密度明显增加,骨材料外侧可见粉红色的肉芽软组织钉突长入骨材料表面的小孔内,钉突及软组织易从骨材料表面分离,B组长入骨组织内的肉芽组织呈淡粉红色模糊状。X线摄片,C组骨材料与骨组织相邻处有大量骨痂形成,缺损骨断面因改建而变的圆钝,并有新生毛细血管及肉芽组织长入,呈不透明状,包裹骨材料的骨膜及软组织无坏死和积液,B组少量骨痂,A组缺损明显(见图3)。
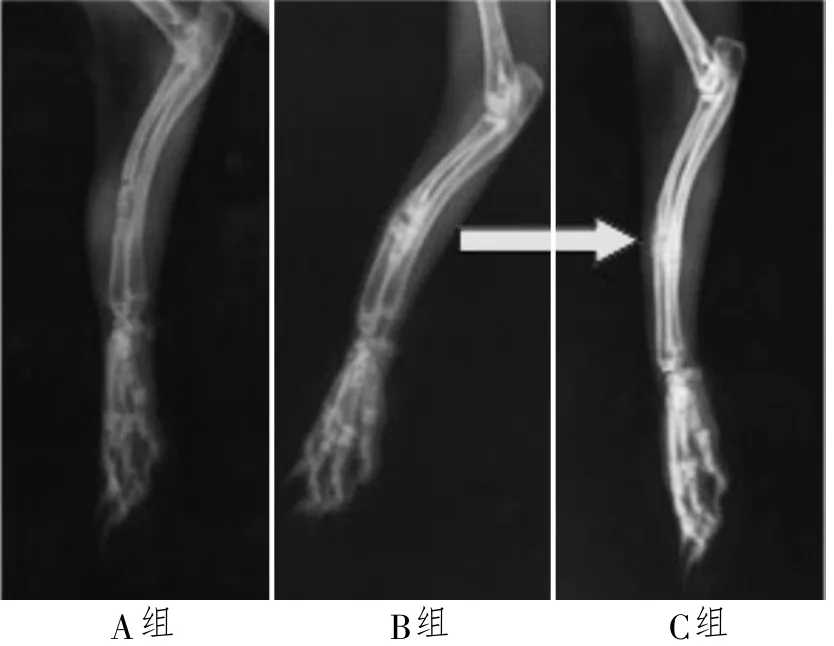
图3 各组 4周 X线片显示,牡蛎壳复合型骨材料组移植区投射分界影像 (‘→′处)
植入后8周,B、C骨材料仍被较厚的软组织包裹完全,无松动及移位现象,A组骨缺损有少量骨痂生成,无愈合。长入骨材料表面的结缔组织钉突强度及韧性增加,可以从骨材料表面完整的撕脱,其中 C组的血管成分明显减少,C组桡骨表面形态及质地结构与 A组十分接近。
植入后 12周,B、C组骨材料与相邻组织结合紧密,包裹骨材料的组织质地较韧、硬度增加,两者间界线消失,无法完整分开。剖面可见兔桡骨植入区域内的硬组织厚度增加,人工桡骨周边形成一层质地较软组织硬的致密层。C组桡骨表面形态及质地结构与无损组织无明显的差别,已恢复到正常的组织形态。X线片观察,C组骨材料-骨界面之间的透射分界影像消失,而 A、B组投射分界影像还是明显存在,植入区内 B、C骨材料的密度高于周边正常骨组织(见图4)。
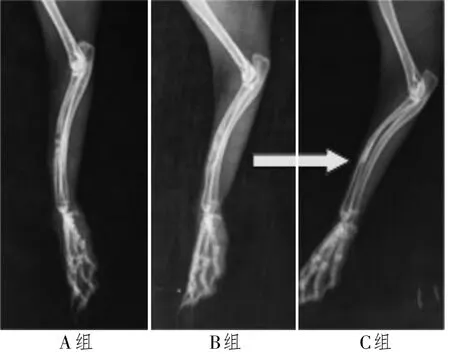
图4 各组 12周 X线片显示,牡蛎壳复合型骨材料组移植区投射分界影像(‘→′处)
2.2.2 组织学检测 苏木精-伊红染色光学显微镜观察结果:B、C组植骨区的新生骨面积随着时间的推移逐渐增加,植骨区的材料剩余面积随着时间的推移逐渐减少,且降解速度相对较快(见表1)。植入4周时镜下观察C组可见周边明显有成骨细胞分泌的新生骨基质形成 (见图5),而 B组则形成模糊新生软骨基质(见图6)。植入8周时镜下观察C组植骨区有较多的成骨和血管长入材料中,成骨区内可见到锥状骨陷凹样结构和骨细胞,管状结构明显增多。骨材料周围大多被大量梭形细胞占据,并有血管长入,新生的骨单位形状不规则,周围的骨质尚未完全钙化,接近皮质骨的骨单位较成熟,骨膜下的则更幼稚(见图7)。B组与 C组相似,但不如 C组成骨活跃。术后12周 C组骨材料基本降解,植入区内基本被新生组织填满,可见大量成骨细胞、脂肪细胞 (见图8)。
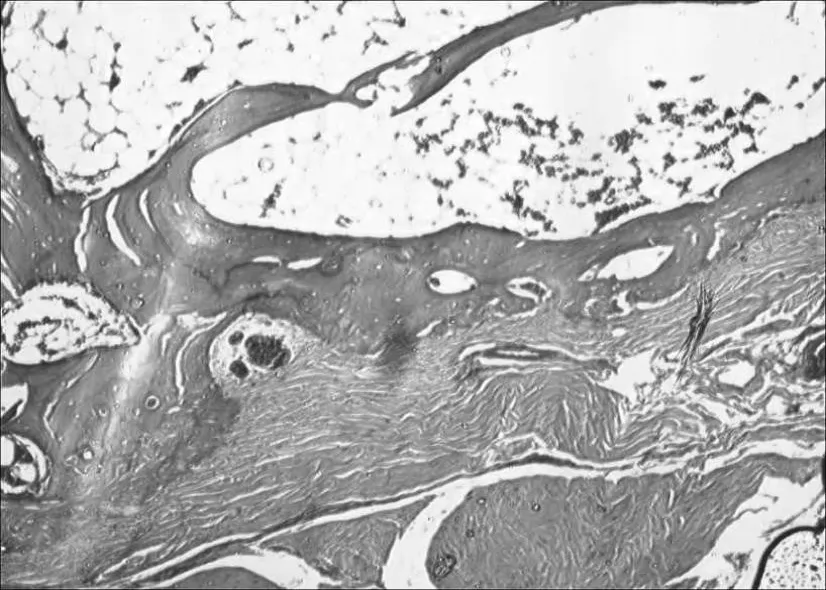
图5 培养 4周 C组可见明显骨基质形成(苏木精-伊红染色,× 50)
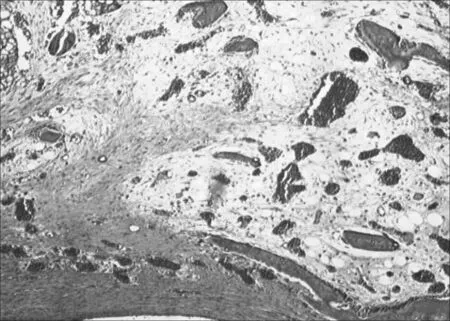
图6 培养 4周 B组可见模糊骨基质形成(苏木精-伊红染色,×50)
分别在第 2、4、8、12周测量 B、C组新生骨面积和剩余骨面积,计算剩余骨面积和新生骨面积,使用 SPSS15.0统计软件,通过多组数据方差分析,C组选择显著性T=0.05,前者 P=0.042,后者 P=0.001,都有显著性差异,得出随着时间的推移,新生骨正在逐步代替骨材料的结论,与 B组相似具体数据见表1。横向对比两组的新生骨面积在2、4、8周时没有显著性差异 t<0.05,在 12周时有显著性差异 t> 0.05,横向对比两组的骨材料剩余颗粒面积 2周时没有显著性差异 t> 0.05,在 4、8、 12周时有显著性差异 t< 0.05。
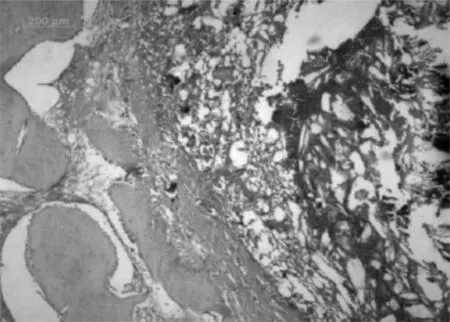
图7 培养8周 C组骨材料周围见大量新骨形成,材料开始降解(苏木精-伊红染色,×50)
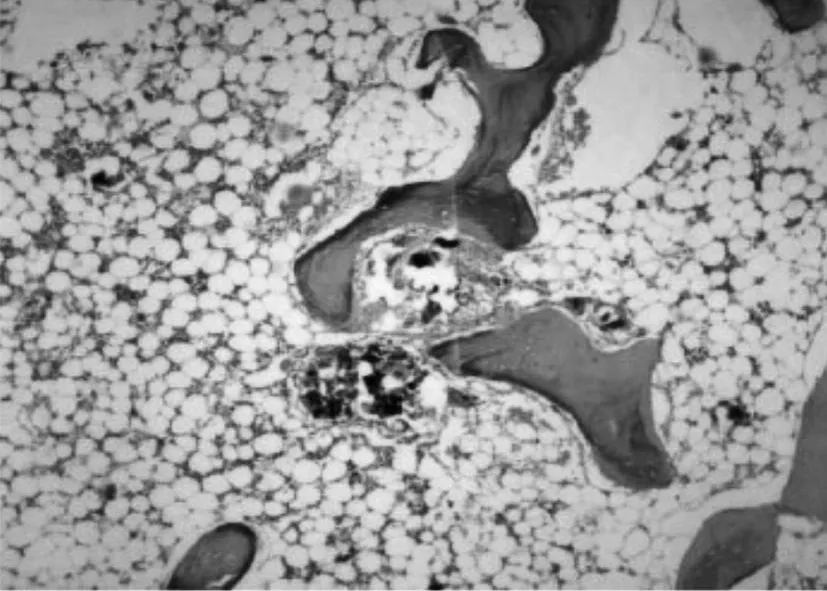
图8 术后 12周 C组 HE切片,仅见极少量材料残余(HE染色,× 50)
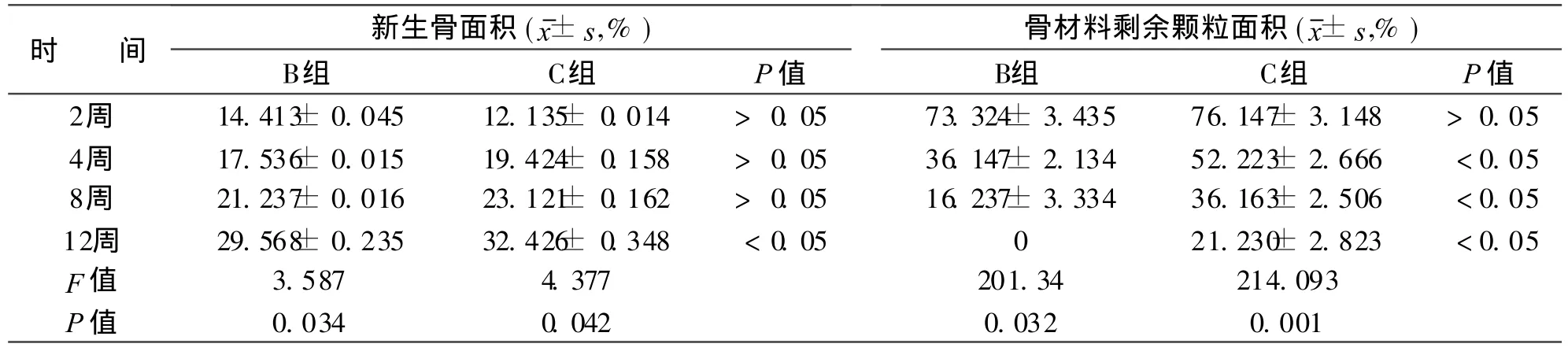
表1 牡蛎壳骨材料和MIIG骨材料植入区新生骨面积百分数和骨材料剩余颗粒面积百分数的数值
2.2.3 生物力学检测 牡蛎壳复合型材料的抗弯曲强度为(46.43± 1.57)M Pa,MIIG组为 (41.20± 2.75)M Pa,自体骨为(47.07±2.40)MPa,牡蛎壳复合型骨材料组与 MIIG组 (P<0.05),MIIG组与自体骨组(P<0.05),有统计学意义,牡蛎壳复合型骨材料组与自体骨组(P>0.05),无统计学意义。
3 讨 论
牡蛎属于软体动物门的双壳纲,全世界的牡蛎有 18属100多种,我国大概有20种,全世界年产量在80万吨以上。牡蛎壳资源广泛,来源丰富,取材不破坏生态环境。牡蛎壳含有丰富的微量元素和大量氨基酸[7]。1997年,美国 FDA[8]已经批准将牡蛎作为原始材料加工成为牡蛎碳酸钙补钙剂。2002年牡蛎钙获得国家卫生部批号。说明其具有较好的皮质骨替代潜能。
实验通过大体扫描电镜观察,牡蛎壳复合型骨材料横断面可以观测到5~20层致密的骨板样结构,呈同心圆柱排列,板厚度在 200~300nm之间,板间由相互沟通的管道系统相联系,最宽的管道达 600 nm,平均在 300 nm左右,这和人体骨的骨板、哈佛氏管与浮克曼管的数量、密度、形状、孔径、走向规律相类似。用排液法测得的骨材料孔隙率高达 40%~50%左右。当孔隙超过30%以后,孔隙之间可达到互相连通,新骨组织可以从材料表面长入内部,形成网络状结构。骨材料抗压强度为45~49M P。孔隙率控制在30%~50%,既能达到孔之间相通,又能满足临床初期对材料强度的要求,有效地发挥材料的支架作用[9-14]。这种多孔结构形成的材料三维通道增大了材料与受植区组织器官的接触界面,有利于加速界面结合的反应过程,为新骨组织长入材料中提供通道和容纳场所,并为携带骨诱导物质(骨形态发生蛋白、骨髓)提供空间。该材料可根据需要通过预制或注塑的方式成形,具有良好的可操作性。植入后即可为缺损区的软组织提供足够的硬组织保护。
大体标本表明,兔桡骨修复早期为肉芽组织长入材料表面的孔隙内,而后形成钉突样结构,4周时牡蛎壳复合型骨材料外侧可见粉红色的肉芽软组织钉突长入骨材料表面的小孔内,医用硫酸钙组有淡粉红色较模糊肉芽组织长入骨组织内。随着植入时间的推移与材料结合更加紧密,最终材料与新生骨直接结合。X线摄片,本研究中修复材料的密度略低于正常兔桡骨,2周时X线摄片观察到移植区内密度影低于周边;8周时牡蛎壳复合型骨材料与骨组织相邻处有大量骨痂形成,缺损骨断面因改建而变得圆钝,医用硫酸钙组有少量骨痂,自体骨组缺损明显。12周时牡蛎壳复合型骨材料组骨材料-骨界面之间的透射分界影像消失,而 A、B组投射分界影像还是明显存在,高密度影像明显高于周围骨床,这表明牡蛎壳复合型骨材料可以更好地阻止结缔组织的长入,起到三维支架的作用,在兔桡骨缺损区域内引导形成新生骨,新生骨与材料影像叠加形成密度增高影像。
组织学检测表明:牡蛎壳复合型骨材料的空隙之间相互联通能为成骨细胞提供良好的摄取营养、生长和黏附空间。4周时有明显骨基质生成,而医用硫酸钙则只有模糊骨基质生成,表明牡蛎壳骨诱导性相对较好,8周时牡蛎壳复合型骨材料组新骨形成和骨材料降解都较明显,并可见大量血管,内含丰富的红细胞,医用硫酸钙组材料降解更加明显,自体骨组未见成骨。术后12周时,牡蛎壳复合型骨材料组基本降解,植入区内基本被新生组织填满,可见大量成骨细胞、脂肪细胞,而医用硫酸钙组则完全降解,新生骨面积也相对牡蛎壳组小。这表明植入牡蛎壳复合型骨材料比医用硫酸钙组降解相对较慢,诱导骨生成相对较快,可以更持久的为大段骨缺损提供支架作用。生物力学测试显示术后12周实验组与自体骨比较抗弯曲强度测试无明显差别而优于医用硫酸钙组,显示了较好的材料成骨能力。
本实验组下一步将在牡蛎壳复合型骨材料中植入骨形态发生蛋白和成骨细胞,在体外实验探究牡蛎壳复合型骨材料是否对人体组织细胞生长、代谢、增殖产生影响,从无毒、无热原、无刺激作用、不引起溶血反应、无致癌性和致畸作用等方面证明牡蛎壳复合型骨材料的良好生物相容性。
本实验证明牡蛎壳复合型骨材料相对现今常用医用硫酸钙骨材料有着更好的生物学特性、骨诱导性、成骨能力,并能更持久的提供支架作用修复骨缺损。所以初步认为天然牡蛎壳纳米体复合型骨材料具备骨缺损修复材料所需的良好生物学特性。
[1] Gitelis S,Piaseaki P,Turner T,et al.Use of a calcium sul-fate based bone graft substitute for benign bone lesions[J].Orthopedics,2001,24(2):162-166.
[2] Bell W H.Resorption characteristics of bone and bolie substitutes[J].Oral Surg Oral Med Oral Pathol,1964(17):650-657.
[3] 刘 平,徐宏光,王弘,等.硫酸钙生物骨水泥在填补骨缺损手术中的应用 [J].皖南医学院学报,2010,29(2):98-100.
[4] Currey JD,Zioupos P,Davies P,et al.Mechanical properties of nacre and highly mineralized bone[J].Proc Biol Sci,2001,268(1462):107-111.
[5] Mount AS,Wheeler AP,Paradkar RP,Snider D Hemocyte-mediated shell mineralization in the eastern oyster[J].Science,2004,304(5668):297-300.
[6] Simkiss K.The organic matrix of the oyster shell[J].Comp Biochem Physiol,1965,16(4):427-435.
[7] 陈玉枝,林舒.牡蛎壳与龙骨成分的分析[J].福建医科大学学报,1999,33(4):432-433.
[8] Yoon GL,Kim BT,Kim BO,et al.Chemical mechanical characteristics of crushed oyster-shell[J].Waste Manag,2003,23(9):825-834.
[9] Tsai CH,Lin RM,Ju CP,et al.Bioresorption behavior of tetracalcium phosphate-derived calcium phosphate cement implanted in femur of rabbits[J].Biomaterials,2008,29(8):984-993.
[10] Strauss EJ,Pahk B,Kummer FJ,et al.Calcium phosphate cement augmentation of the femoraI neck defect created after dynamic hip screw removal[J].Orthop Trauma,2007,21(5):295-300.
[11] Barralet JE,Gaunt T,Wright AJ,et al.Effect of porosity reduction by compaction on compressive strength and microstructure of calcium phosphate cement[J].Biomed Mater Res,2002,63(1):1-9.
[12] Korovessis P,Repantis Tf Petsinis G,et al.Direct reduction of thoracolum bar burst fractu Fes by means of balloon kyphoplasty with calcium phosphate and stabilization with pedicle-screw instrumentation and fusion[J].Spine,2008,33(4):100-108.
[13] Qi X,Ye J,Wang Y.Improved injectability and in vitro degradation of acalcium phosphate cement containing poly(1actide-c0-glycolidel microspheres[J].Acta Biomater,2008,4(6):1837-1845.
[14] Del Valle S,Mifio N,Mu Roz F,et al.In vivo evaluation of an injectable[J].Macroporous Calcium Phosphate Cemer,2007,6(9):208-209.
