胚胎发育不良性胶质神经上皮肿瘤病理和影像分析(附7例报告)
2012-04-20吴晔詹仁雅
吴晔詹仁雅
·论 著·
胚胎发育不良性胶质神经上皮肿瘤病理和影像分析(附7例报告)
吴晔*詹仁雅△
目的探讨罕见中枢神经系统肿瘤——胚胎发育不良性胶质神经上皮肿瘤的临床病理及影像学特征,以提高诊断的准确性。方法回顾性分析2001年1月至2011年12月7例外科手术后病理证实的胚胎发育不良性胶质神经上皮肿瘤的临床表现、影像学特点、手术方法、组织学特点及免疫组化结果。结果肿瘤4例位于颞叶,2例位于额叶,1例位于侧脑室及三脑室。具有特征性的“三角征”、“脑回征”等影像学表现和“特异性胶质神经元成分”的病理学表现。全部病例经显微手术治疗,随访1至10年,癫痫控制良好,肿瘤未见复发及转移,效果满意。结论胚胎发育不良性胶质神经上皮肿瘤具有特征性的影像学和病理学表现,病理组织学“特异性胶质神经元成分”对其诊断和鉴别诊断具有重要价值。
胚胎发育不良性胶质神经上皮肿瘤 病理 影像
Daumas-Duport等[1]按独特的病理类型于1988年首次命名并报道了胚胎发育不良性胶质神经上皮 肿 瘤 (dysembryoplastic neuroepithelial tumor,DNT)。DNT是罕见的中枢神经系统肿瘤,其发病
率占神经上皮性肿瘤的0.2%~1.2%[2]。本文总结7例显微外科手术后经病理证实的DNT的临床资料,以探讨其临床病理及影像学特征。
1 资料与方法
1.1 一般资料浙江大学医学院附属第一医院2001年1月至2011年12月收治手术后经病理证实的7例DNT,其中男4例,女3例,年龄10~38岁,平均(21±3)岁。DNT诊断及分型参照WHO分类标准(2007)[3]。临床表现为颅内压增高1例;癫痫发作6例,均为部分性发作(3例为复杂部分性发作,3例为单纯部分性发作);精神障碍1例。
1.2 方法收集7例DNT的影像学、病理学资料及治疗方法。并对7例患者肿瘤组织蜡块,厚4 μm切片,常规HE染色,并用Envision法进行免疫组织化学染色。抗体包括S-100蛋白,突触素(synaptophysin,Syn),胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP),Ki67。以阳性肿瘤细胞数>10%为阳性,镜下观察结果并计算每张切片内的Ki-67指数。
2 结果
2.1 影像学资料本组均行CT及MRI检查。4例肿瘤位于颞叶 (2例位于颞叶内侧,1例位于颞叶外侧),2例位于额叶,1例位于室间孔区 (向侧脑室及三脑室生长);肿瘤直径0.8~5.2 cm。CT平扫表现为幕上及脑室内类圆形、分叶状、楔形或不规则状假性囊肿,1例可见钙化。MRI表现为T1WI低信号或等、低混杂信号,T2WI高信号,FLAIR序列呈低信号,边缘和分隔呈高信号改变;1例病灶表现为“三角征”,其形态为宽基底朝外,尖部向内的三角形,其内信号均匀;2例表现为“脑回征”,呈脑回样灰质区长T1、长T2信号改变,与脑脊液信号相近;MRS显示病灶区域胆碱峰减低,邻近实质区各波谱改变无明显异常;所有病例无明显占位效应,瘤周无水肿;GDPA无强化或轻度网格状强化;由于肿瘤阻塞室间孔,1例患者合并脑室扩大积水。见图1。
2.2 手术方法7例均在显微镜下切除肿瘤。术中可见局部脑回肿胀,肿瘤边界清楚,呈胶冻状,质软,色灰白,血供不丰富。肿瘤切除前后应用皮层脑电图监测致痫灶,根据致痫灶与病变的关系确定手术范围。位于非功能区的病灶行扩大切除,切除肿瘤和皮质发育不良脑组织。而对于功能区的肿瘤仅行病灶切除,然后采用多软膜下横纤维切断术处理致痫灶。
2.3 病理特征肉眼观察:肿瘤呈半透明胶冻状或凝胶状,部分有囊性变。
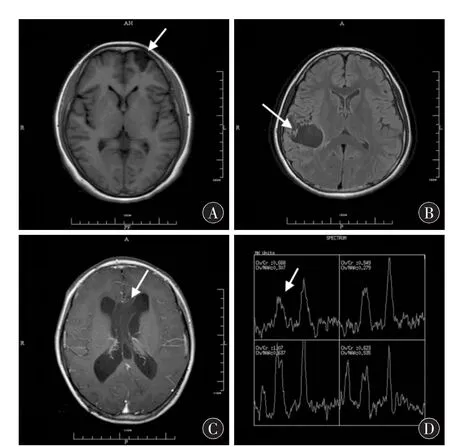
图1 DNT影像学图像。A:T1WI呈低信号,表现为宽基底朝外,尖部向内的“三角征”(箭头所示);B:FLAIR见假性囊肿,瘤周不完整高信号环,囊壁边缘实质部分表现为肥皂泡状脑回样的“脑回征”(箭头所示);C:透明隔及两侧脑室前角间占位,GDPA无明显强化,合并脑室积水(箭头所示);D:MRS显示病灶区域胆碱峰减低(箭头所示)。
组织学观察:肿瘤由多少不等的少突胶质样细胞、成熟神经元和星形细胞混合构成“特异性胶质神经元成分”,以少突胶质样细胞为主。少突胶质样细胞的形态较为一致,核圆形或椭圆形,伴核周空晕,胞质较少,呈“鱼眼”样。4例肿瘤呈多结节状结构,3例的神经胶质结节以少突胶质样细胞为主,1例以星形细胞为主。5例伴皮质发育不良,表现为皮层结构紊乱,正常分层消失,神经元形态及大小异常。2例可见砂粒体。肿瘤组织内可见大量的毛细血管呈枝芽状增生,周围少突胶质样细胞聚集成假菊形团,1例可见内皮细胞增殖及肿瘤细胞异型性,但仅限于神经胶质结节内,未见坏死灶及核分裂像。病理分型结果:2例简单型,5例复杂型。见图2。
免疫组织化学染色结果:S-100蛋白在少突胶质样细胞的胞核中阳性表达;Syn在神经元及部分少突胶质样细胞的胞浆内阳性表达;GFAP在少突胶质样细胞表达阴性,而散在的星形细胞表达阳性。极少数瘤细胞核Ki-67表达阳性,阳性率为0 ~1.5%,且阳性表达的细胞主要位于神经胶质结节,少突胶质样细胞少见。见图2。
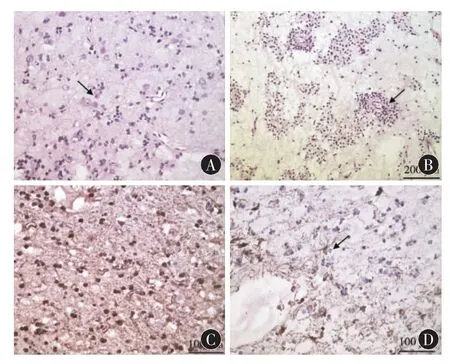
图2 DNT病理学图像。A:可见“特异性胶质神经元成分”(箭头所示),由少突胶质样细胞、成熟神经元和星形细胞混合构成,中间被黏液样基质分开(HE×400);B:复杂型DNT,少突胶质样细胞形成毛细血管周围的假菊形团(箭头所示)(HE×200);C:S-100蛋白在少突胶质样细胞中呈强阳性表达(×400);D:GFAP在星形细胞中呈阳性表达(箭头所示),而少突胶质样细胞呈阴性表达(×400)。
2.4 预后及随访本组全切除5例,次全切除2例,无手术死亡,均未行放化疗。术后1例出现视野缺损,2个月后逐渐好转,1例精神障碍患者术后明显好转,脑室DNT患者术后颅内高压症状消失,6例癫痫患者控制结果EngelⅠ级4例,Ⅱ级2例。随访12~120个月,所有患者未见肿瘤复发及转移。
3 讨论
DNT是罕见的中枢神经系统肿瘤,于1988年由Daumas-Duport等[1]首先报道,2007年WHO分类将其归入神经元和混合性神经元-胶质肿瘤,定为WHOⅠ级[3]。近年来DNT逐渐被人们认识和重视,但将DNT按低级别胶质瘤误诊误治,并造成严重后果的情况仍时有发生。
DNT多发生于幕上,以颞叶最常见 (约占50%[3]),其次为额、顶、枕叶,也可发生于其他部位。文献对尾状核、透明隔、小脑、脑干的DNT均有报道[4]。DNT好发于青少年,临床过程相对较长,多以反复发作的药物难治性癫痫 (复杂部分性发作为主)为首发症状甚至是其惟一症状。
DNT的影像学表现为:①病变多位于幕上皮质及皮质下,边界清晰,常显示为假性囊肿,可伴有钙化。典型的DNT假性囊肿T1WI呈低信号或等、低混杂信号,T2WI呈高信号,FLAIR边缘和分隔呈高信号而囊液呈低信号,其囊液信号与脑脊液信号有明显差异。DNT的假性囊肿常位于皮质或皮质下,病理学上表现为“特异性胶质神经元成分”,当假性囊肿位于新皮质时,位置多较肿瘤的其他部分表浅。钙化多位于肿瘤深部,常伴有肿瘤强化或出血。②特征性的“三角征”及“脑回征”:“三角征”即冠状位MRI观察肿瘤表现为宽基底朝外,尖部向内的三角形;“脑回征”表现为肥皂泡状脑回样结构。③多数DNT无强化,少数(约18%[5])呈点状或网格状强化,点状强化多位于假性囊肿周围。④绝大多数DNT无占位效应,无瘤周水肿。⑤功能影像学:Yu AH等[5]最近的一项研究表明MRS提示N-乙酰天门冬氨酸、胆碱及胆碱/肌酸峰下降需考虑DNT诊断。弥散加权成像提示较高的表观弥散系数 (apparent diffusion coefficient,ADC),灌注成像提示局部血流量下降,以及色氨酸PET提示低代谢,具有一定的鉴别诊断意义[6]。本组除1例脑室内DNT外,均位于额叶或颞叶,5例可见假性囊肿,1例钙化,T1WI等信号或等、低混杂信号,T2WI高信号,无瘤周水肿及占位效应,MRS显示病灶区域胆碱峰减低,3例有特征性的“三角征”或“脑回征”,具有鉴别诊断意义。
DNT的组织起源于中枢神经系统发育过程中的中间发生层,包括室管膜下层、海马齿状回、软脑膜下颗粒和小脑外层颗粒等,为脑灰质非正常发育的继发性肿瘤[1],可能与妊娠期第二个月的发育缺陷有关[7]。DNT的组织学有相对特征性改变,即“特异性胶质神经元成分”,表现为与皮质表面垂直排列的柱状结构,束状分布的神经元轴索及小血管上排列着S-100阳性和GFAP阴性的少突胶质样细胞,其间夹杂着GFAP阳性的星形细胞,柱状结构之间被黏液样基质分开,可见成熟神经元如“浮蛙”样漂浮于其中。少突胶质样细胞的形态较为一致,核圆形或椭圆形,伴核周空晕,胞质较少,呈 “鱼眼”样。DNT组织学分型根据WHO2007版分类[8],可分为简单型和复杂型两种亚型。简单型DNT由特异性胶质神经元成分组成,复杂型DNT则具有3个典型的组织学特征:①特异性胶质神经元成分,除具有与简单型组织学形态类似结构外,少突胶质样细胞常形成毛细血管周围的假菊形团;②神经胶质结节,可见细胞成分不均一的多结节状结构,结节内可见大量少突胶质样细胞聚集,内混合有类似于少突星形细胞瘤的星形细胞,可有(无)神经元;③局灶性皮质发育不良,常见到发育不良的大脑皮质,表现为皮质结构紊乱,正常的分层消失。本组2例简单型,5例复杂型(包括1例脑室DNT)。复杂型DNT的神经胶质结节可表现出核异型性、内皮细胞增殖、核分裂像等非典型性的组织学特征。本组病例中1例复杂型DNT增强MRI上表现为环形强化,组织学具有细胞异型性和血管内皮细胞增殖表现,Ki-67阳性率亦为本组中最高的1.5%,但均仅限于神经胶质结节中的星形细胞,该病例全切除后随访4年,未见肿瘤复发。2例复杂型DNT可见砂粒体,其中1例影像学可见钙化及点状强化,易误诊为少突胶质细胞瘤,但少突胶质细胞瘤结节状结构罕见,即使存在,也与复杂型DNT的多结节状结构不同。Campos AR等[9]认为钙化及出血仅见于复杂型DNT,可作为鉴别诊断依据,本组简单型未见钙化及出血,与文献报道一致。
免疫组化在DNT病理诊断及鉴别诊断中具有一定辅助作用:S-100蛋白在少突胶质样细胞表达阳性;Syn在神经元及部分少突胶质样细胞表达阳性;GFAP抗体在少突胶质样细胞表达阴性,而散在的星形细胞表达阳性;极少数瘤细胞核Ki-67表达阳性(低增殖活性),一般在0~8%[10],本组简单型DNT的Ki-67阳性率为0和0.1%,而复杂型DNT有 3例 Ki-67阳性率超过 0.5%,最高为1.5%,无高增殖活性病例。Daumas-Duport[1]报道了具有与高级别星形细胞瘤类似高增殖活性的复杂型DNT,认为其未出现恶性转化是由于细胞增殖和细胞凋亡同时发生,而肿瘤的缓慢生长反映了它们之间达到一种平衡。而对于极少数复发性DNT来说,神经胶质结节的增殖指数可能比特异性胶质神经元成分更能决定复杂型DNT的长期生物学行为。
DNT需与以下几种肿瘤相鉴别:①少突胶质细胞瘤,50%位于额叶,以膨胀性生长为主,占位效应较明显,伴强化和显著水肿,典型钙化常呈条索状沿脑回分布;瘤细胞弥漫分布,缺乏特异性胶质神经元成分,免疫组化可与DNT鉴别。②神经节神经胶质瘤,影像学常表现为囊实性,增强实性部分多呈不均匀强化,与DNT规则的假性囊肿差异明显;组织学上纤维组织增生和淋巴套多见,DNT缺乏此种特征。③毛细胞型星形细胞瘤,组织学上的微囊变、嗜酸性小体、Rosenthal纤维可见于DNT,但只是限定于毛细胞型星形细胞瘤样区域。簇状血管增生在毛细胞型星形细胞瘤很常见,但通常位于囊肿壁,而DNT没有此种血管增生改变。
显微手术切除是DNT的首选治疗。手术的目的在于控制癫痫并最大程度的切除肿瘤,同时获得准确的病理诊断。如果肿瘤全切除,则患者的预后良好。多位研究者都证实DNT伴皮质发育不良的发生率超过80%[11],说明在 DNT的致痫机制中,除了瘤灶外还有其他因素参与其中,因此位于非功能区的病灶需行扩大切除术,即由于潜在的致痫性,皮质发育不良脑组织应该一并切除。而对于功能区的肿瘤仅行病灶切除,然后采用多软膜下横纤维切断术或电灼术处理致痫灶。Ozlen等[12]认为,由于皮质发育不良与DNT的密切联系影响术后癫痫的控制,若颞叶广泛存在皮质发育不良,可考虑切除肿瘤同时行前颞叶、海马切除术。
DNT恶性转化非常罕见,到目前为止仅有3例文献报道,主要与DNT的神经胶质成分有关[13]。故手术后一般不需要辅助放射及化学治疗,仅在肿瘤复发或进展时考虑。即使某些DNT表现出退行性变、核分裂活跃以及局部增殖指数增高的特点,由于其侵袭性行为可能会在分子水平上受到抑制,不至于发生恶变。众多大型临床研究表明DNT全切除或扩大切除后癫痫的治愈及有效控制率可达80%,而且术后癫痫控制情况与术前是否存在皮质发育不良无关[12]。本组6例癫痫患者控制结果EngelⅠ级4例,Ⅱ级2例,未见肿瘤复发及转移,与文献报道相符。
依据本组病例结果,我们认为胚胎发育不良性胶质神经上皮肿瘤的特征包括:①癫痫为主要症状;②发病年龄多小于30岁;③常见于颞叶;④常表现为假性囊肿,具有“三角征”、“脑回征”的特征性影像学表现;⑤病理组织学具有“特异性胶质神经元成分”,常合并皮质发育不良;⑥良性的生物学行为和良好的预后。总之,胚胎发育不良性胶质神经上皮肿瘤具有特征性的影像学和病理组织学表现,“特异性胶质神经元成分”对胚胎发育不良性胶质神经上皮肿瘤的诊断和鉴别诊断具有重要价值。
[1]Daumas-Duport C,Scheithauer BW,Chodkiewicz JP,et al.Dysembryoplastic neuroepithelial tumor:a surgically curable tumor of young patients with intractable partial seizures.Report of thirty-nine cases[J].Neurosurgery,1988,23(5):545-556.
[2] 肖庆,张亚卓.胚胎发育不良性神经上皮性肿瘤[J].中国神经精神疾病杂志,2003,29(3):234-235.
[3]Louis DN, Ohgaki H, Wiestler OD, et al.The 2007 WHO Classification of Tumours of the Central Nervous System[J].Acta Neuropathol,2007,114(2):97-109.
[4]Harter DH,Omeis I,Forman S,et al.Endoscopic resection of an intraventricular dysembryoplastic neuroepithelial tumor of the septum pellucidum[J].Pediatr Neurosurg,2006,42(2):105-107.
[5]Yu AH,Chen L,Li YJ,et al.Dysembryoplastic neuroepithelial tumors: magnetic resonance imaging and magnetic resonance spectroscopy evaluation[J].Chin Med J(Engl),2009,122(20):2433-2437.
[6]Juhász C,Muzik O,Chugani DC,et al.Differential kinetics of α-[11C]methyl-L-tryptophan on PET in low-grade brain tumors[J].J Neurooncol,2011,102(3):409-415.
[7]Daumas-Duport C, Pietsch T, Lantos PL.Dysembryoplastic neuropethelial tumour[M]∥ Kleihues P, Cavenee WK. Pathology and genetics of tumours of the nervous system.3rd ed.World Health Organization Classification of Tumours.Lyon:IARC Press,2005:103-106.
[8]Daumas-Duport C,Pietsch T,Hawkins C,et al.Dysembryoplastic neur-oepithelial tumour[M]∥Louis DN,Ohgaki H,Wiestler OD,et al.WHO Classification Nervous System.Lyon:IARC Press,2007:99-102.
[9]Campos AR,Clusmann H,von Lehe M,et al.Simple and complex dysembr-yoplastic neuroepithelial tumors(DNT)variants:clinical profile,MRI,and histopathology[J].Neuroradiology,2009,51(7):433-443.
[10]Thom M,Toma A,An S,et al.One hundred and one dysembryoplastic neuroepithelial tumors: an adult epilepsy series with immunohistochemical, molecular genetic, and clinical correlations and a review of the literature[J].J Neuropathol Exp Neurol,2011,70(10):859-878.
[11]Spalice A,Ruggieri M,Grosso S,et al.Dysembryoplastic neuroepithelial tumors:a prospective clinicopathologic and outcome study of 13 children[J].Pediatr Neurol,2010,43(6):395-402.
[12]Ozlen F,Gunduz A,Asan Z,et al.Dysembryoplastic neuroepithelial tumors and gangliogliomas: clinical results of 52 patients[J].Acta Neurochir,2010,152(10):1661-1671.
[13]Sharma MC,Jain D,Gupta A,et al.Dysembryoplastic neuroepithelial tumor:a clinicopathological study of 32 cases[J].Neurosurg Rev,2009,32(2):161-170.(收稿日期:2012-06-26)
(责任编辑:甘章平)
Pathological and imaging analysis in patients with dysembryoplastic neuroepithelial tumor.
WU Ye,ZHAN Renya.Department of Neurosurgery,The First Affiliated Hospital of Medical College of Zhejiang University,79 QingChun Road,Hangzhou 310003,China.Tel:0571-89972382.
ObjectiveTo investigate the pathological and imaging characteristics of dysembryoplastic neuroepithelial tumor(DNT).MethodsThe data including clinical manifestations,imaging features,surgical methods,histological features and immunohistochemical results was collected and analyzed in 7 cases with DNT from January 2001 to December 2011 retrospectively.ResultsTumors were located in the temporal lobe in 4 cases,in the frontal lobe in 2 cases and in the lateral third ventricle in 1 case.DNT had distinctive MRI imaging features such as“triangularshaped pattern”or“gyriform pattern”and specific pathological features-“specific glioneuronal element”.All patients received microsurgery and had undergone follow-up for 1 to 10 years.All patients had satisfied outcomes with wellcontrolled epilepsy and without relapse or metastasis.ConclusionDNT has typical imaging and pathological features,in which the pathological feature-“specific glioneuronal element”is valuable for the diagnosis and differential diagnosis of DNT.
Dysembryoplastic neuroepithelial tumor Pathology Imaging
R651.1
A
10.3969/j.issn.1002-0152.2012.09.002
* 浙江大学医学院附属第一医院神经外科,现工作于浙江省立同德医院(杭州 310003)
△浙江大学医学院附属第一医院神经外科
