首发精神分裂症额叶白质和海马氢质子波谱的非对称性异常及其治疗1年后的变化☆
2012-04-19崔立谦邓伟蒋莉君黄朝华陈壮飞李名立王强
崔立谦邓伟蒋莉君黄朝华陈壮飞李名立王强
王英成*马小红*龚启勇※李涛*
·论 著·
首发精神分裂症额叶白质和海马氢质子波谱的非对称性异常及其治疗1年后的变化☆
崔立谦*△邓伟*蒋莉君*黄朝华*陈壮飞*李名立*王强*
王英成*马小红*龚启勇※李涛*
目的 探讨首发精神分裂症患者脑代谢物非对称性的改变及其受非典型抗精神病药物治疗的影响。 方法 对符合美国精神障碍诊断与统计手册第4版 (Diagnostic and Statistical Manual of Mental Disorders,DSM-Ⅳ)诊断标准的21例首发精神分裂症患者和21名健康对照进行氢质子磁共振波谱扫描,并在治疗1年后对患者再次进行扫描,检测双侧额叶白质和海马的 N-乙酰天门冬氨酸 (N-Acetylaspartate, NAA)、胆碱(choline,Cho)和肌酸(creatine,Cr),以Cr为参照物,分别计算双侧NAA/Cr、Cho/Cr比值。在治疗前后对患者进行阳性和阴性量表(positive and negcotive symtoms scale,PANSS)、大体功能量表(global assessment function,GAF)评定。采用配对t检验进行脑代谢物非对称性分析。 结果 非对称性分析发现基线期健康对照组左侧海马NAA/Cr比右侧高[(1.41±0.09)vs.(1.32±0.10),P<0.05],首发精神分裂症组左、右侧海马代谢物比较,差异无统计学意义;而经过1年治疗后,与治疗前相比首发精神分裂症组PANSS评分显著降低(68.57±27.74 vs.97.95±13.81)、GAF量表评分显著增加 (58.76±23.07 vs.28.05±8.99),均P<0.05,精神分裂症组左侧海马NAA/Cr比右侧高[(1.41±0.10)vs.(1.31±0.13),P<0.05]。健康对照组及首发精神分裂症组治疗前后双侧额叶白质代谢物差异均无统计学意义(P>0.05)。结论 首发精神分裂症患者海马NAA/Cr的非对称性消失,经非典型抗精神病药物治疗后,在精神症状改善的同时海马NAA/Cr的非对称性恢复。
精神分裂症 额叶 海马 磁共振波谱
脑发育异常被认为是精神分裂症发病的主要原因之一。右利手健康人大脑半球存在着以左侧半球优势的非对称性改变,而多数研究发现右利手精神分裂症患者大脑半球结构左大于右的非对称性消失或逆转,这种非对称性的异常改变可能与遗传有关,是精神分裂症先天神经发育异常的标志之一[1-2]。最近的氢质子磁共振波谱(proton magnetic resonance spectroscopy,1H-MRS)研究发现精神分裂症阳性症状为主型患者额叶、海马区的各代谢物异常均表现为左侧低于右侧[3],提示精神分裂症患者两侧大脑半球的代谢物也存在非对称性的改变,但这种改变仍需进一步证实,目前也不清楚药物治疗对其的影响。
本研究纳入首发未服药的精神分裂症患者,在治疗前和治疗1年后,通过单体素1H-MRS技术对患者前额叶白质、海马脑组织N-乙酰天门冬氨酸(N-Acetylaspartate,NAA)、胆碱(choline,Cho)、肌酸(creatine,Cr)3种代谢物进行定量评估,进行非对称性分析,旨在探讨精神分裂症患者脑代谢物非对称性的改变及非典型抗精神病药物治疗的影响,为揭示精神分裂症的病因学和治疗机制提供线索。
1 对象和方法
1.1 研究对象 为来自2006年6月至2008年6月华西医院心理卫生中心住院的精神分裂症患者,入组标准:①符合美国精神障碍诊断与统计手册第4版 (the fourth ediction of diagnostic and statistical manual of mental disorders,DSM-Ⅳ)精神分裂症或精神分裂样障碍的诊断标准者。所有在入组时诊断为精神分裂样障碍的患者(8例)均进行了至少6个月的随访,并在随后的随访研究中修正诊断为精神分裂症。②首次发作,病程小于2年,未服用过任何抗精神病药物。排除标准:①神经系统疾病、严重躯体疾病及脑外伤史;②DSM-Ⅳ轴Ⅰ其他精神障碍。2年间积累的磁共振扫描入组患者60例,符合1年随访要求的21例,年龄16~48岁,男5例,女性16例,平均(23.0±9.4)岁;病程 0.3月~22月,1.3(8.4)月[中位数(四分位间距)];受教育年限9~16年,平均(12.1±2.2)年。
健康对照组均来自广告征集志愿者,共21名健康人,男5例,女16例;年龄17~49岁,平均(22.7±9.0)岁;平均受教育年限(11.7±1.4)年;均排除躯体疾病、精神神经系统疾病及阳性精神疾病家族史。
两组对象的年龄、受教育年限的差异均无统计学意义(t=0.12,P=0.91;t=0.65,P=0.52)。全部对象均为右利手。本研究经四川大学华西医院伦理委员会批准,研究对象均对本研究知情同意,并签署书面知情同意书。
1.2 方法
1.2.1 临床评定 由同一位经验丰富的精神专科医师在进行1H-MRS扫描前对研究对象进行一般情况调查。所有患者入院后均接受了为期1年的非典型抗精神病药(利培酮、喹硫平、奥氮平、阿立哌唑)系统治疗。对精神分裂症患者在治疗前和治疗1年后进行阳性和阴性量表 (positive and negative symptoms scale,PANSS)和大体功能量表(global assessment function,GAF)评定。
1.2.21H-MRS检查 使用3.0T磁共振扫描系统(美国通用公司,8通道头部线圈)在治疗前(基线期)和治疗1年后进行扫描。每次扫描前均经过严格的质量保证检测,以确保信号的稳定性。所有纳入者首先进行常规头部磁共振成像 (T1加权自旋回波序列图像和T2加权梯度回波序列图像),由一名经验丰富的影像科医师对其进行诊断,未发现显著形态学异常者才进入后续的扫描序列。额叶数据采集时先采集纯轴位3DT1图像,用以定位。高分辨 3D T1图像通过 3D扰相梯度回波序列(spoil Gradient Recalled,SPGR)获得,扫描参数如下:重复时间(repeat time,TR)8.5 ms,回波时间(echo time,TE)3.4 ms,翻转角(flip angle)12°,层厚(slice thickness)1 mm,单次激发(one NEX),视野(field of view,FOV) 24 cm×24 cm, 矩阵(matrix size,MS)256×256,体素大小(voxel size)0.47× 0.47×1 mm,全脑共采集156层轴位图像。左右两侧额叶白质区选取体素的上下、左右、前后径大小分别为2×2×2 mm,避开颅骨、脂肪、气腔及脑脊液等结构。海马数据采集首先沿海马长轴快速定位成像,T2FSE序列,层厚2 mm,共18层,扫描时间为1 min 44 s。然后确定感兴趣区(region of interest,ROI),尽量选取包含海马整个头、体、尾的灰质,避开接触颅底结构及脑脊液,体素体积根据个体差异确定,同一个体双侧ROI大小一致。1H-MRS数据采用单体素多次采集,TR 1500 ms,TE 35 ms,平均次数(Number of Average,NA)128次,扫描时间为3 min 48 s。机器自动匀场、水抑制及调谐,信号经系统软件处理后转换为波谱图及数据来反映NAA、Cho和Cr的相对水平,并以Cr为参照物,计算NAA/Cr、Cho/Cr。每次扫描前均经过严格的质量保证检测,以确保信号的稳定性。
1.3 统计学方法 使用SPSS 13.0统计软件对数据进行统计分析。患者组、对照组各代谢物双侧对应脑区间比较采用组内配对t检验,统计结果用(±s)表示,以P<0.05为差异有统计学意义。
2 结果
2.1 患者药物治疗情况 入组患者选用非典型抗精神病药物,服用利培酮11例,2~8 mg/d,平均剂量(6.2±1.1)mg/d;喹硫平3例,600~1200 mg/d,平均剂量(817.2±150.3)mg;奥氮平5例,10~20 mg/d,平均剂量(13.6±5.5)mg/d;阿立哌唑2例,10~30 mg/d,平均剂量(17.5±6.5)mg/d。治疗1年后,有2例服用利培酮换用奥氮平,1例服用阿立哌唑换用奥氮平;利培酮平均剂量 (3.1±1.1)mg/d,喹硫平平均剂量(633.2±100.5)mg/d,奥氮平平均剂量 (10.5±3.6)mg,阿立哌唑平均剂量(13.3±3.5)mg。
2.2 患者组治疗前后PANSS量表和GAF量表评分比较 与治疗前相比,患者组PANSS总分(t=4.35)、一般病理分(t=4.01)、阳性(t=4.44)和阴性(t=2.40)量表分在治疗一年后降低,差异有显著统计学意义 (均P<0.05);GAF分在治疗后升高,差异有显著统计学意义(t=5.96,P<0.01),见表1。
2.2 患者组治疗前、后与对照组双侧脑代谢物水平比较 健康对照组在基线期组内左侧海马NAA/Cr比右侧高,差异有统计学意义(t=2.52,P=0.02),左右两侧前额白质NAA/Cr、Cho/Cr及左右两侧海马Cho/Cr对比,差异均无统计学意义(P>0.05),见表2。患者组在基线期组内左右两侧前额白质、海马NAA/Cr和Cho/Cr对比,差异均无统计学意义(P>0.05);经过1年治疗后,患者组内左侧海马NAA/Cr比右侧高,差异有统计学意义 (t=3.45, P<0.01),左右两侧前额白质NAA/Cr、Cho/Cr及左右两侧海马Cho/Cr对比,差异均无统计学意义(P>0.05),见表2。

表1 患者组治疗前后临床量表评分
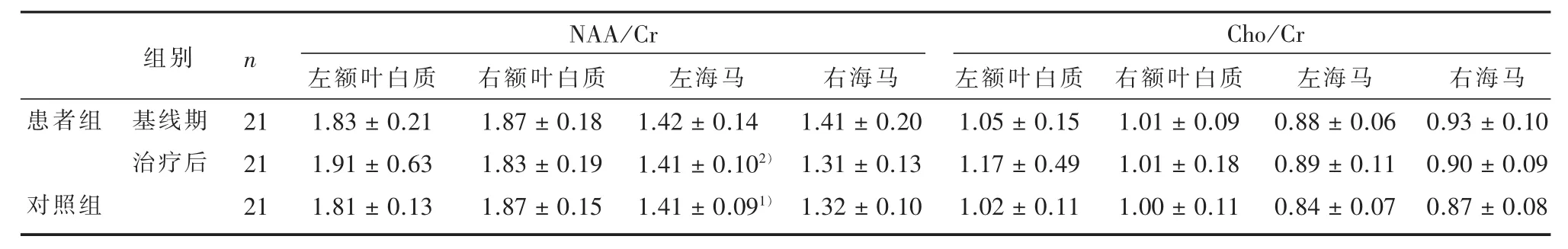
表2 患者组治疗前后及正常对照额叶白质和海马氢质子波谱代谢物非对称性比较
3 讨论
本研究显示,在基线期健康对照组海马NAA/Cr存在左高右低的非对称性,而首发精神分裂症患者这种非对称性消失。在以往的报道中,精神分裂症患者脑结构和功能非对称性发生改变的结果已在多个研究中得到支持,这种改变多为左侧优势的减弱或消失[1]。在精神分裂症患者一级亲属中也发现非对称性的改变[2,4],说明脑半球非对称的干扰是精神分裂症的生物学危险因素。有学者提出了脑非对称性异常是精神分裂症病理学基础的假说,其病因可能是建立两侧半球非对称性的基因调控过程出现了异常[1]。本研究结果也证实了首发精神分裂症患者海马NAA/Cr非对称性分布的消失。NAA主要存在于神经元细胞,在线粒体内产生,在线粒体酶的作用下由乙酰辅酶A和天冬氨酸合成,因此对氧化磷酸化敏感,是神经元及神经结构完整性的标志,NAA和/或NAA/Cr比率降低提示神经元丧失和/或轴突丧失、神经元功能紊乱。在早前大样本研究结果中,并未发现首发精神分裂症患者脑代谢物与健康对照有差异[5],本研究结果提示精神分裂症脑海马NAA/Cr非对称性的改变也许是早期和敏感的变化。本研究发现与国内报道的首发精神分裂症阳性症状为主型患者左侧海马头NAA/Cr和Cho/Cr小于右侧的结果不一致[3],可能与扫描设备和方法、感兴趣区的定位不同有关。
对精神分裂症患者进行为期1年的非典型抗精神病药物治疗后,PANSS量表总分、阳性量表、阴性量表和一般病理分显著下降,同时,患者组海马部位的NAA/Cr指标恢复了左高右低的非对称性,这与基线期健康对照组相同。最近的meta分析认为精神分裂症患者脑部NAA的减少是非进展性的,无论首发或慢性患者NAA减少的程度无差异,而非典型抗精神病药物可以阻止NAA的减少,甚至增加NAA的水平[6-7],因此推测海马NAA/Cr非对称性的恢复可能与非典型抗精神病药物的神经保护作用有关[8]。另外海马NAA/Cr非对称性的改变也可能与Cr的非恒定有关[9],Cr是细胞新陈代谢的标记物,疾病早期阶段海马代谢活动的增高引起 Cr的增加[10-11],导致 NAA/Cr的减少和非对称性的改变,而后期的药物治疗可以逆转这一改变。这种推测尚需要设计合理的纵向研究来支持。既往发现电抽搐治疗可以引起精神分裂症患者额叶血流左大右小的非对称性增加,但双相障碍患者不出现这种改变[12]。在前期的报道中,我们也发现经药物治疗的慢性精神分裂症患者存在海马NAA/Cr左大右小非对称性的改变,而双相情感障碍患者中未发现[13]。本研究从代谢物分布的角度证实了非典型抗精神病药物对海马NAA/Cr非对称性的恢复作用,由于目前非典型抗精神病药物治疗对脑代谢物非对称性影响的研究较少,这种影响是否具有特异性需要进一步证实。
本研究发现精神分裂症患者治疗前后和健康对照一样,额叶白质的代谢物双侧分布无差异,与国外对额叶白质进行弥散张量成像和波谱联合分析的阴性结果相一致[14],也支持陈丽君[15]报道的第二代抗精神病药短期治疗对精神分裂症患者额叶代谢物水平无明显影响的发现。但与王颖[2]发现的精神分裂症患者左侧额叶白质Cho/Cr小于右侧的结果不相符。额叶白质代谢物的分布可能不同于额叶灰质代谢物的非对称性分布[16]。
本研究的不足在于未对基线期健康对照进行1年后波谱扫描分析,未对被试区分性别进行研究;也未能对非对称性的改变与临床量表进行相关分析,这些不足在一定程度上限制了结果的解释。在本研究2年内积累的60例患者中,符合随访1年要求的有21例,其余未纳入统计的患者,部分是由于随访时间未到年,部分是失访,粗略统计的失访率约为50%。在纳入统计的21例随访患者中,有4例患者PANSS评分在治疗后下降小于30%,与治疗有效的样本量比较,所占比例较小,因此对结果的影响应该不大,在以后的研究中,需要在积累足够样本的基础上,根据患者不同疗效进行分类比较研究。
总之,本研究从代谢物分布的角度对非典型抗精神病药物的治疗机制进行了初步的探讨,表明首发精神分裂症患者海马NAA/Cr非对称性消失,非典型抗精神病药物治疗可恢复非对称性,此结果尚有待进一步验证。在将来的研究中,需要在区分性别的基础上,根据治疗效果进行代谢物的分类分析。
[1]Oertel-Knöchel V,Linden DE.Cerebral asymmetry in schizophrenia[J].Neuroscientist,2011,17(5):456-467.
[2] 杨磊,韩雪,程章,等.精神分裂症患者及一级亲属的脑结构非对称性异常[J].中国心理卫生杂志,2010,24(11):813-817.
[3] 王颖,贾艳滨,凌雪,等.阳性症状为主型首发精神分裂症患者脑磁共振质子波谱的偏侧性研究[J].中华行为医学科学与脑科学,2010,19(9):807-809.
[4]Oertel V,Knöchel C,Rotarska-Jagiela A,et al.Reduced laterality as a trait marker of schizophrenia-evidence from structural and functional neuroimaging[J].J Neurosci,2010,30(6):2289-2299.
[5] 何宗岭,邓伟,李名立,等.首发精神分裂症患者额叶白质及海马中脑代谢物质的变化[J].四川大学学报(医学版),2011,42(3):433-435.
[6]Brugger S,Davis JM,Leucht S,et al.Proton magnetic resonance spectroscopy and illness stage in schizophrenia-a systematic review and meta-analysis[J].Biol Psychiatry,2011,69(5):495-503.
[7]Steen RG, Hamer RM, Lieberman JA.Measurement of brain metabolites by1H magnetic resonance spectroscopy in patients with schizophrenia: A systematic review and meta-analysis[J].Neuropsychopharmacology,2005,30(11):1949-1962.
[8]Hunsberger J,Austin DR,Henter ID,et al.The neurotrophic and neuroprotective effects of psychotropic agents[J].Dialogues Clin Neurosci,2009,11(3):333-348.
[9]Ongür D,Prescot AP,Jensen JE,et al.Creatine abnormalities in schizophrenia and bipolar disorder[J].Psychiatry Res,2009,172(1):44-48.
[10]Schobel SA,Lewandowski NM,Corcoran CM,et al.Differential targeting of the CA1 subfield of the hippocampal formation by schizophrenia and related psychotic disorders[J].Arch Gen Psychiatry,2009,66(9):938-946.
[11]Tamminga CA,Stan AD,Wagner AD.The hippocampal formation in schizophrenia[J].Am J Psychiatry,2010,167(10):1178-1193.
[12]Fujita Y,Takebayashi M,Hisaoka K,et al.Asymmetric alternation of the hemodynamic response at the prefrontal cortex in patients with schizophrenia during electroconvulsive therapy:a near-infrared spectroscopy study[J].Brain Res,2011,1410:132-140.
[13]崔立谦,李涛,蒋莉君,等.偏执型精神分裂症和双相Ⅰ型患者海马氢质子波谱研究[J].中国神经精神疾病杂志,2009,35(6):355-358.
[14]Tang CY,Friedman J,Shungu D,et al.Correlations between Diffusion Tensor Imaging(DTI)and Magnetic Resonance Spectroscopy(1H-MRS)in schizophrenic patients and normal controls[J].BMC Psychiatry,2007,(7):25.
[15]陈丽君,谢世平,陈宁.男性首次发病精神分裂症患者治疗前后额叶的质子波谱研究[J].中华精神科杂志,2006,39(3):157-160.
[16]Delamillieure P,Constans JM,Fernandez J,et al.Proton Magnetic Resonance Spectroscopy(1H-MRS)in schizophrenia:investigation of the right and left hippocampus, thalamus, and prefrontal cortex[J].Schizophr Ball,2002,28(2):329-339.
Longitudinal follow-up of asymmetric changes by proton magnetic resonance spectroscopy in first-episode schizophrenia patients.
CUI Liqian,DENG Wei,JIANG Lijun,HUANG Chaohua,CHEN Zhuangfei,LI Mingli,WANG Qiang,WANG Yingcheng,MA Xiaohong,GONG Qiyong,LI Tao.The Mental Health Center&Psychiatric Laboratory,West China Hospital,Sichuan University,Chengdu 610041,China.Tel:028-85164021.
Objective To investigate asymmetric changes of the prefrontal lobes and hippocampus before and after treatment in first-episode schizophrenia patients using proton magnetic resonance spectroscopy (1H-MRS).Method 21 first-episode schizophrenia patients and 21 healthy subjects matched for age, gender, and years of education were included in the study.1H-MRS was performed in two sides of the hippocampus and frontal lobes regions before and one year after treatment The ratios of N-Acetylaspartate(NAA),choline(Cho)to creatine(Cr)were measured.The patients were also assessed by (positive and negative symptoms scale, PANSS) and(global assessment fumction,GAF).One-sample T test and paired-samples T test were used for statistic process.Results The NAA/Cr was significantly higher in the left hippocampus than in the right (1.41±0.09 vs.1.32±0.10) forhealthy control subjects(P<0.05).There are no significant difference in brain metabolites between the left and right hippocampus in the first episode schizophrenia patients(P>0.05).One year following treatment,the NAA/Cr ratio was significantly higher in the left hippocampus than in the right(1.41±0.09 vs.1.32±0.10)for the schizophrenia patents concomitant with the improvements of PANSS(58.76±23.07 vs 28.05±8.99)and GAR(68.52±27.74 vs.97.95±13.81)(P<0.05).There was no significant difference at brain metabolites between the left and right frontal lobes regions in the first episode schizophrenia patients before and after treatment and healthy control subjects.Conclusion Asymmetry of NAA/Cr disappears in the hippocampus in the first-episode schizophrenia whereas treatment of atypical antipsychotics can attenuate the asymmetry of NAA/Cr.
Schizophrenia Frontal lobe Hippocampus Magnetic resonance spectroscopy
R749
A
2012-01-30)
(责任编辑:文飞)
10.3969/j.issn.1002-0152.2012.05.001
国家自然科学基金重点项目(编号:30530300);973课题(编号:2007CB12301)*
四川大学华西医院精神医学研究室(成都 610041)
(E-mail:xuntao26@hotmail.com)
※ 四川大学华西医院临床磁共振研究中心
△ 广州医学院第一附属医院精神医学科
