哮喘大鼠肺组织TGF-β1 与Smad3、Smad7蛋白的变化及不同中医治法对其的影响
2012-04-15许朝霞李学良钱鹏李娜燕海霞郭睿郝一鸣陈理君
许朝霞 李学良 钱鹏 李娜 燕海霞 郭睿 郝一鸣 陈理君
支气管哮喘的发病机制尚未完全阐明。研究证实,转化生长因子-β(transforming growth factor-beta,TGF-β)在参与上皮炎症损伤后修复的同时也参与气道重建的发生[1-3]。Smads 蛋白是TGF-β 的下游信号转导蛋白,介导TGF-β 的胞内信号转导,在哮喘气道重建形成中发挥重要的作用。其中Smad3蛋白参与TGF-β1 的信号转导,起正调节作用,促进TGF-β1 的生物学表达活性,从而促进气道重塑的发生发展,而Smad7 蛋白在参与TGF-β1 的信号转导过程中起负调节作用,抑制TGF-β1 的生物学表达活性,从而抑制气道重塑的发生发展[4]。本研究观察哮喘大鼠气道重建中支气管肺组织的形态学变化及其TGF-β1 与Smad3、Smad7 蛋白的表达,并分析固本、宣肺、宣肺固本三种中医治法对其的影响,以期探索三种中医治法治疗哮喘的作用及机制。
1 材料与方法
1.1 动物分组
60 只雄性SD 大鼠(购自上海斯莱克实验动物有限责任公司,许可证号:SCXK 沪2007-0005),体重(200±20)g,随机分成正常组、模型组、地塞米松干预组、宣肺方干预组、固本方干预组、宣肺固本方干预组,每组10 只。
1.2 试剂及仪器
DAB、SABC 试剂盒、羊抗兔IgG 武汉博士德生物工程有限公司,显微镜(OLYMPUS1X71)及其图像分析系统。
1.3 造模方法
介绍的造模方法[5-6]进行改良。分组后,分别于第1 天、7 天,模型组、地塞米松干预组、宣肺方干预组、固本方干预组、宣肺固本方干预组每只大鼠腹腔注射致敏液1 ml,其中含卵蛋白(Ovalbuminj,OVA)100 mg,氢氧化铝100 mg。第15 天始,激发引喘,每天1%OVA 40 ml/20 min 雾化吸入,连续28 天。相同时间点,正常组大鼠以生理盐水替代OVA 进行腹腔注射及雾化吸入,连续28 天。
1.4 药物干预
地塞米松片(上海信谊药厂有限公司,批号:H31020793-01)用生理盐水制成浓度为0.32 mg/ml的混悬液。
宣肺方由麻黄4 g、法半夏9 g、地龙9 g、柴胡9 g、黄芩9 g、葶苈子9 g 组成。固本方由生地黄10 g、熟地黄10 g、党参10 g、茯苓9 g、黄精9 g、玉竹9 g、淫羊藿9 g 组成。宣肺固本方由生地黄10 g、熟地黄10 g、党参10 g、泽泻10 g、黄精10 g、淫羊藿10 g、南沙参9 g、北沙参9 g、法半夏9 g、地龙9 g、黄芩9 g 组成。分别将三方加水浸泡1 小时,头煎加水为总药量的10 倍,二煎加水为总药量的4 倍,取汁弃渣,合并两次药汁,蒸发浓缩至生药浓度为3 g/ml溶液(药物的汤剂由本课题组自煎)。
于激发引喘后第一天开始进行药物干预:正常组、模型组生理盐水灌胃1 次/天,地塞米松干预组地塞米松混悬液灌胃1 次/天,宣肺方干预组、固本方干预组、宣肺固本方干预组分别以宣肺方、固本方、宣肺固本方水煎液灌胃1 次/天,6 组大鼠灌胃的剂量均为10 ml/kg。干预4 周后取材,检测相关指标。
1.5 指标检测
1.5.1 标本的采集及制备 各组分别于造模结束日处死大鼠,开胸暴露肺脏,将右支气管肺组织浸泡于4%多聚甲醛溶液中固定24 小时后,将肺组织横切成3 mm 厚的薄片,继续用4%多聚甲醛固定72 小时,乙醇梯度脱水,二甲苯透明,石蜡定向包埋,连续切片,厚度6 μm。用于免疫组化方法检测。
1.5.2 免疫组化实验步骤 取支气管肺组织切片,用免疫组化法进行检测,按试剂盒说明操作:切片脱蜡至水,3%过氧化氢阻断10 分钟,浸入柠檬酸,微波炉加热至沸,抗原修复,山羊血封闭20 分钟,一抗4 ℃孵育过夜,生物素化二抗37 ℃孵育30 分钟,加SABC 试剂37 ℃孵育30 分钟,DAB 镜下控制染色,苏木素复染0.5 分钟,盐酸酒精分化,酒精脱水,二甲苯透明,中性树胶封片,显微镜下观察支气管肺组织着色情况。
1.5.3 结果判定 (1)治疗结束后处死大鼠,取出全肺称重。肺系数=肺重量(g)/身体重量(kg)。比较各组大鼠肺系数的变化。(2)免疫组化染色后大鼠的支气管肺组织切片中均见棕黄色的免疫阳性反应,阳性表达主要集中在气道上皮细胞、黏膜下、平滑肌肌层。以图像分析系统测定灰度值,取阳性率面积占总面积的百分比值作比较。
1.6 统计学处理
2 结果
2.1 大鼠一般情况观察
造模前各组大鼠性别、体重、月龄及健康状况无差异。致敏的两周内,模型组、地塞米松干预组及三种中药治疗组大鼠的体重增长较正常组少。除正常组外,其他各组大鼠在引喘后会出现呼吸急促,喉间有痰鸣音;至引喘1 ~2 周后,会出现唇及趾末端轻度发绀,但中药治疗组稍好于模型组和地塞米松组。引喘后,哮喘大鼠体重增长缓慢,尤以地塞米松组为甚。正常组大鼠精神活动未见异常,其余各组大鼠喜抱团而眠,活动较正常组欠活跃。引喘并药物干预1 周后,宣肺、宣肺固本组大鼠大便量较其他组多,稍较软。饮食未见明显变化。
2.2 各组大鼠肺系数的比较
模型组和地塞米松干预组大鼠肺系数比正常组升高,差异有统计学意义(P <0.05);三个中药干预组大鼠肺系数比正常组升高,差异无统计学意义(P >0.05);三个中药干预组大鼠肺系数比地塞米松干预组低,差异具有统计学意义(P <0.05);三个中药干预组大鼠肺系数比模型组低,但差异无统计学意义(P >0.05)。详见表1。
表1 各组大鼠肺系数比较
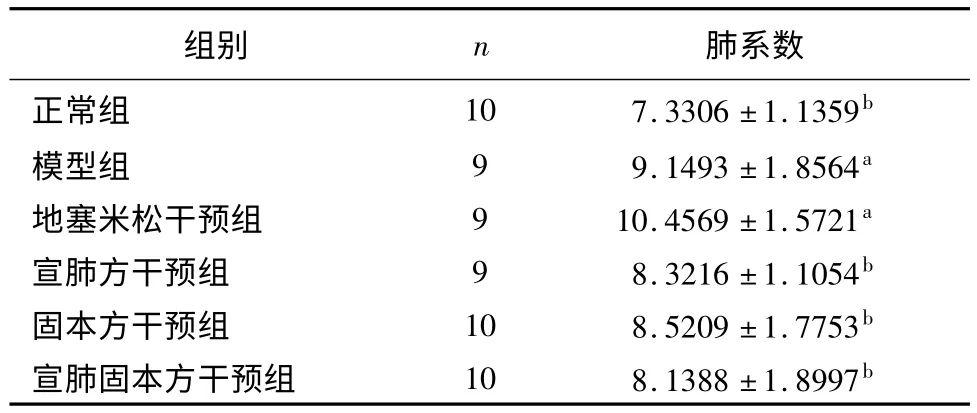
表1 各组大鼠肺系数比较
注:与正常组比较,aP <0.05;与地塞米松干预组比较,bP <0.05
组别 n 肺系数正常组 10 7.3306±1.1359b模型组 9 9.1493±1.8564a地塞米松干预组 9 10.4569±1.5721a宣肺方干预组 9 8.3216±1.1054b固本方干预组 10 8.5209±1.7753b宣肺固本方干预组 10 8.1388±1.8997b
2.3 各组大鼠支气管肺组织切片中TGF-β1 与Smad3、Smad7 蛋白表达水平
模型组、地塞米松干预组及三个中药干预组大鼠支气管肺组织切片中TGF-β1、Smad7 蛋白表达的灰度值的百分比正常组高,而Smad3 蛋白表达则比正常组低,差异均具有统计学意义(P <0.05);宣肺固本干预组TGF-β1 的表达比模型组低,Smad3 蛋白的表达比模型组高,差异均具有统计学意义(P <0.05);地塞米松组、宣肺方干预组、宣肺固本方干预组Smad7 蛋白的表达比模型组高,差异有统计学意义(P <0.05);宣肺固本方组TGF-β1 表达比地塞米松组低,而Smad3 蛋白的表达比地塞米松组高,差异均具有统计学意义(P <0.05);模型组Smad7蛋白比地塞米松组高,差异具有统计学意义(P <0.05)。详见表2。
3 讨论
气道重建是哮喘发病的重要特征之一,是导致气道不可逆性阻塞和气道高反应性的主要病理基础,与哮喘的持续、严重程度、预后及治疗反应等密切相关。抑制气道重建已经成为中医药防治哮喘的新策略[7]。TGF-β 是一种多功能细胞调节因子,以自分泌、旁分泌和内分泌的方式通过细胞表面的受体信号转导途径调控细胞的增殖、分泌和凋亡[8]。多种细胞均可产生TGF-β,气道上皮细胞为其主要来源。TGF-β 具有多重作用,包括促进炎性细胞分化、增殖,促进气道平滑肌增生、肥大[9-10]。在哮喘的发病过程中,TGF-β1 主要来源于肺局部浸润的嗜酸性粒细胞和气道壁的成纤维细胞[11]。研究[12-14]显示,TGF-β1 在气道重建中发挥重要作用,可加重上皮细胞受损,促进气道平滑肌细胞、肌成纤维细胞增殖,进而直接参与哮喘气道炎症和重建的发生、发展过程。Smads 蛋白是TGF-β 家族的特异性细胞内信号转导分子,在参与维持细胞的正常生理功能中发挥着重要的作用。
Smad3 蛋白是共同通路型蛋白,是所有TGF-β家族信号转位入细胞核所必需的,Smad7 是抑制性蛋白,可与激活的I 型受体结合,抑制TGF-β 家族的信号转导。TGF-β/Smad 信号通路是TGF-β 发挥生物学作用的重要通路,研究证实[15-16],Smads蛋白家族可能在哺乳动物细胞内充当TGF-β1 信号的介导子,TGF-β1 主要通过TGF-β1/Smads 途径发挥生物学效应,活性的TGF-β1 结合并激活Ⅱ型/Ⅰ型的Smad3 和Smad4,然后其聚集成共同复合物或形成数个异源二聚体,进入细胞核内与特异的DNA 连接蛋白结合,直接启动靶基因转录,从而引起气道和血管的平滑肌细胞增殖及表型转化等一系列变化;在此过程中Smad6 和Smad7 蛋白能够抑制其信号转导[17],进而调节α-平滑肌肌动蛋白(α-SMA)的表达。
中医学认为,哮喘缓解期多累及肺脾肾三脏,多表现为气虚与阴阳失调,治疗当补肺益肾、温阳填精。本研究中宣肺方由麻黄、黄芩、柴胡、地龙、半夏、葶苈子组成,有宣肺平喘、化痰止咳、清肺解痉之功,能较好地缓解哮喘发作,是哮喘发作期的有效验方。固本方由熟地黄、黄精、生地黄、党参、仙灵脾组成,起到肺脾肾三补,气血阴阳兼顾的作用,重在调节机体的免疫抗病能力。宣肺固本方两者兼之,攻补兼施。笔者在此基础上,本着整体观念的思维,进一步整合治疗方法,将“宣肺固本”与“宣肺”、“固本”治法进行比较,以选择更为有效的哮喘治法。
表2 各组大鼠TGF-β1 与Smad3、Smad7 蛋白表达的灰度值比较

表2 各组大鼠TGF-β1 与Smad3、Smad7 蛋白表达的灰度值比较
注:与正常组比较:aP <0.05,与模型组比较:bP <0.05,与地塞米松干预组组比较:cP <0.05。
组别 n TGF-β1(%) Smad7(%) Smad3(%)正常组 8 0.0601±0.0163bc 0.0303±0.0112bc 0.1325±0.0401bc模型组 7 0.1033±0.0164a 0.0900±0.0264ac 0.0737±0.0207a地塞米松干预组 7 0.0986±0.0126a 0.0647±0.0341ab 0.0814±0.0213a宣肺方干预组 8 0.0974±0.0151a 0.0607±0.0159ab 0.0933±0.0224a固本方干预组 8 0.0955±0.0130a 0.0746±0.0252a 0.0825±0.0222a宣肺固本方干预组 8 0.0815±0.0179abc 0.0629±0.0179ab 0.1097±0.0331abc
利用卵蛋白复制哮喘模型的方法已经得到广泛的认可和应用,延长OVA 激发时间制备大鼠慢性哮喘模型,气道不仅存在慢性炎症,而且有气道重建的改变[6]。因为TGF-β1 的表达反映大鼠气道上皮细胞的损伤程度及炎症的发生发展情况,而Smad3、Smad7 蛋白在TGF-β1 的生物功能中发挥重要的调节作用,因此,本研究通过观察中药对哮喘大鼠肺组织中TGF-β1 和Smad3、Smad7 蛋白的影响,以期探讨TGF-β1 和Smad3、Smad7 蛋白在哮喘大鼠气道重建中的作用及宣肺固本治法治疗哮喘大鼠的作用机制。本研究结果表明:(1)各哮喘组大鼠的肺系数较正常组均有不同程度的升高,但三个中药治疗组大鼠的肺系数与正常组间差异无统计学意义,而与地塞米松组间差异有统计学意义。脏器系数的变化常可较好地反映药物对该脏器的毒性综合情况,可旁证病理组织学改变的可能性[18]。(2)哮喘大鼠支气管肺组织中TGF-β1 和Smad3 蛋白的表达水平升高,而Smad7 蛋白的表达下降,三种中医治法对其均有影响,其中宣肺固本方能更明显调节TGF-β1 和Smad3、Smad7 蛋白的表达,其结果与地塞米松组和模型组间差异有统计学意义。结果提示,TGF-β1 和Smad3、Smad7 蛋白与哮喘大鼠气道重建有一定的相关性;中医宣肺固本法治疗哮喘气道重建可能与调节TGF-β1 和Smad3、Smad7 蛋白的表达水平有关,但中药如何通过对TGF-β1/Smads 通路的调节来影响哮喘气道炎症的途径还有待进一步探究。
参 考 文 献
[1] Torrego A,Hew M,Oates T,et al. Expression and activation of TGF beta isoforms in acute allergen-induced remodeling in asthma[J].Thorax,2007,62(4):307-313.
[2] Fattouh R,Jordana M.TGF-beta,eosinophils and IL-13 in allergic airway remodeling:a critical appraisal with therapeutic considerations[J].Inflamm Allergy Drug Targets,2008,7(4):224-236.
[3] Bosse Y,Rola-pleszczynski M.Controversy surrounding the increased expression of TGF beta 1 in asthma[J]. Respir Res,2007,8(1):66-83.
[4] 李蓓.TGF-β/Smad 信号转导通路在哮喘气道重建中的作用研究[J].山西医学杂志,2009,38(9):1247-1249.
[5] Wasemmn S,Olivenstein R,Renzi P M. The relationship between late asthma tic responses and antigen-specific immunoglobulin[J].J Allergy Clin Immunol,1992,90(4Pt1):661-669.
[6] 许淑云,徐永健,张珍详,等.支气管哮喘模型大鼠气道重建的特征及机制[J].华中科技大学学报(医学版),2006,35(4):465-472.
[7] 王爱明.免疫重建,抑制气道重塑-中医药防治哮喘新策略[J].长春中医学院学报,2005,21(3):5-6.
[8] Luo X,Ding L,Xu J,et al.Gene expression profiling of leiomyoma and myometrial smooth muscle cells in response to transforming growth factor-beta[J]. Endocrinology,2005,146(3):1097-1118.
[9] Moore B,Murphy RF,Agrawal DK.Interaction of TGF-beta with immune cells in airway disease[J].Cur Mol Med,2008,8(5):427-436.
[10] Xie S,Sukkar MB,Issa R,et al.Mechanisms of induction of airway smooth muscle hyperplasia by transforming growth factor-beta[J].Am J Physiol Lung Cell Mol Physiol,2007,293(1):L245-L253.
[11] Tanaka H,Komai M,Nagao K,et al. Role of interleukin5 and eosinophils in allergen-induced airway remodeling in mice[J].Am J Respir Cell Mol Biol,2004,31(1):62-68.
[12] Moir LM,Burgess JK,Black JL,et al.Transforming growth factor beta(1)increases fibronectin deposition through integrin receptor alpha(5)beta(1)on human airway smooth muscle[J].J Allergy Clin Immunol,2008,121(4):1034-1039.
[13] Makinde T,Murphy RF,Agrawal DK,et al.The regulatory role of TGF-beta in airway remodeling in asthma[J].Immunol Cell Biol,2007,85(5):348-356.
[14] 陈兴无,徐军.气道上皮损伤对上皮下成纤维细胞转分化的影响及其在支气管哮喘气道高反应发生中的地位[J].中华结核和呼吸杂志,2005,28(10):698-703.
[15] Zhao W,Gome ZG,Yu SH,et al.TGF-beta1 attenuates mediator release and de novo Kit exp ression by human skin mast cells through a Smad-dependent pathway[J]. Inmunal,2008,181(10):7263-7272.
[16] Turner NJ,Jones HS,Davies JE,et al. Cyclic stretch-induced TGF-beta1 /Smad signaling inhibits adipogenesis in umbilical cord progenitor cells[J]. Biochem Biophys Res Commun,2008,377(4):1147-1151.
[17] Kuang C,Xiao Y,Liu X,et al. In vivo disruption of TGF-beta signaling by Smad7 leads to p remalignant ductal lesions in the pancreas[J].Proc Nat l Acad Sci USA,2006,103 (6):1858-1863.
[18] 黄雅卿,张文昌,李煌元.镉对雌性大鼠体重变化和卵巢脏器系数的影响[J].职业与健康,2003,19(7):6-9.
