生物制麦中白地霉的筛选及其特性的研究
2012-04-13王千存张怀予路宏科马文锦陈兴叶
彭 涛 ,刘 琦,王千存,张怀予,路宏科,马文锦,陈兴叶,殷 欣
(1.甘肃省轻工研究院,甘肃 兰州 730000;2.甘肃农业大学,甘肃 兰州 730070)
甘啤3号是甘肃省啤酒酿造专用大麦品种,在工业生产上表现出较好的制麦品质,但高海拔种植区的大麦仍存在发芽率较低、溶解性能较差等问题[1]。近年来研究发现,制麦过程中添加一些有益微生物菌株(即生物制麦技术)可改善麦芽的溶解性,提高成品麦芽品质及安全性。
用于生物制麦的有益微生物主要有白地霉(Geotrichum candidum)、乳酸菌(Lactic acid bacteria)和根霉(Rhizopus)等。特别是白地霉培养物,是绿麦芽及焙燥麦芽中自然菌群组成菌种之一,毒理学研究表明其安全、无毒素遗传性[2]。其生长过程中分泌的多种水解酶可促进大麦胚乳细胞的溶解,而且能有效地抑制麦芽中真菌毒素的产生,大大提高麦芽的安全性[3]。
本研究以甘啤3号大麦为原料,从中筛选出产β-葡聚糖酶、木聚糖酶、纤维素酶和糖化酶活性较高的白地霉菌株,并对其生长特性进行研究,有利于今后进一步将筛选得到的白地霉应用到生物制麦过程中,以考察通过白地霉改善成品麦芽综合品质的效果,为生物制麦工艺的优化提供一定参考。
1 材料与方法
1.1 材料与仪器
1.1.1 菌株分离源
新鲜浅色甘啤3号大麦,其理化指标为水分15.3%、千粒重32.9g、蛋白质10.8%、发芽率65%,贮存于4℃冰箱中备用。
1.1.2 培养基
麦芽汁琼脂培养基;麦芽汁液体培养基;PDA培养基;5°P麦汁培养基;分解脂肪培养基(果罗德科瓦培养基)。
1.1.3 仪器
恒温鼔风干燥箱;pH计;电子天平;7200型分光光度计;恒温水浴锅;PB203-N型分析天平;培养箱;显微镜;高压灭菌锅。
1.2 试验方法
1.2.1 白地霉筛选分离
(1)采样
无菌条件下选取100粒完整大麦于培养基中,28℃培养24h,定期观察培养过程并记录,选择生霉效果较好的大麦平板,备用。
(2)增殖培养
将上述菌种物接种于麦芽汁液体培养基,28℃恒温箱中培养24h。
(3)平板分离
将增殖培养后的菌种进行适当稀释,涂布麦芽汁琼脂平板,置于28℃恒温培养箱中培养,定期观察并记录。
(4)初筛
挑取经二次平板分离的菌株,进行麦芽汁琼脂培养基划线培养,每株划线3个平皿,保留生长能力较强的菌株。
(5)复筛
将初筛后的菌株再次接种于麦芽汁琼脂培养基,观察其生长能力,保留生长能力较强的菌株。
1.2.2 酶活测定
取250mL三角瓶6个,每瓶装50mL 4g/100mL麦芽粉悬浮液培养基,121℃灭菌20min,冷却至室温。每个三角瓶接种菌株孢子悬浮液1mL,168r/min、28℃恒温振荡培养,从第2d起,每天取一瓶发酵液,3000r/min离心10min。取上清液,适当稀释后测定酶活[4]。
(1)β-葡聚糖酶[5]:在50℃、pH 5.0条件下,每分钟水解β-葡聚糖产生1μmol葡萄糖的酶量定义为一个酶活单位。
(2)木聚糖酶[6]:在50℃、pH 4.8条件下,每分钟水解木聚糖产生1μmol木糖的酶量定义为一个酶活单位。
(3)纤维素酶[7]:在50℃、pH 6.0条件下,每分钟分解羧甲基纤维素生成1μg葡萄糖的酶量定义为一个酶活单位。
(4)糖化酶[8]:在40℃、pH4.6条件下,每分解可溶性淀粉产生1mg葡萄糖的酶量定义为一个酶活力单位。
1.2.3 菌种鉴定与保藏
(1)菌种鉴定:对筛选得到的2株生长能力较强、产酶活性指标较高的菌株进行鉴定:
细胞形态、菌落形态观察、糖类同化试验、碳源同化试验、氮源同化试验、水解蛋白、分解杨梅苷测定及分解脂肪试验:均参照《真菌鉴定手册》从梗孢科地霉属白地霉鉴定方法[9]。
(2)菌种保藏:将分离得到的菌株接种于麦芽汁斜面,置于28℃恒温箱中培养24h后于4℃冰箱中备用[10]。
1.2.4 菌株GQG28生长特性的研究
(1)最适生长温度测定:将菌株GQG28种子接入麦芽汁液体培养基中,分别在10℃~37℃不同温度恒温振荡培养(150r/min)10h,于波长660nm处测定培养液OD值,依据OD值大小确定其最适生长温度。
(2)最低和最高生长温度测定:将菌株GQG28种子接入麦芽汁液体培养基中,于5℃~10℃的低温和34℃~38℃的高温150r/min恒温振荡培养8d,观察有无菌体生长[11]。
(3)最适生长pH值测定:将菌株GQG28种子分别接入pH值3~9的不同麦芽汁液体培养基中,于最适生长温度条件下,150r/min振荡培养10h,于波长660nm处测定培养液OD值,依据OD值大小确定其最适生长pH值。
(4)最低和最高生长pH值测定:将菌株GQG28种子液分别接入pH值为1~11的麦芽汁液体培养基中,于最适生长温度条件下,150r/min振荡培养8d,观察有无菌生长[12]。
(5)生长曲线的测定:将菌株GQG28种子液以2%接入pH 5.4的麦芽汁液体培养基中,于最适生长温度条件下,150r/min振荡培养,每隔2h用血球计数板计数法测定麦芽汁中的总菌数,并绘制生长曲线[13]。
2 结果与分析
2.1 菌种分离与鉴定
2.1.1 菌种筛选分离
(1)菌种筛选
培养期间观察得到4个大麦样品具有较强的生霉能力,结果见图1。
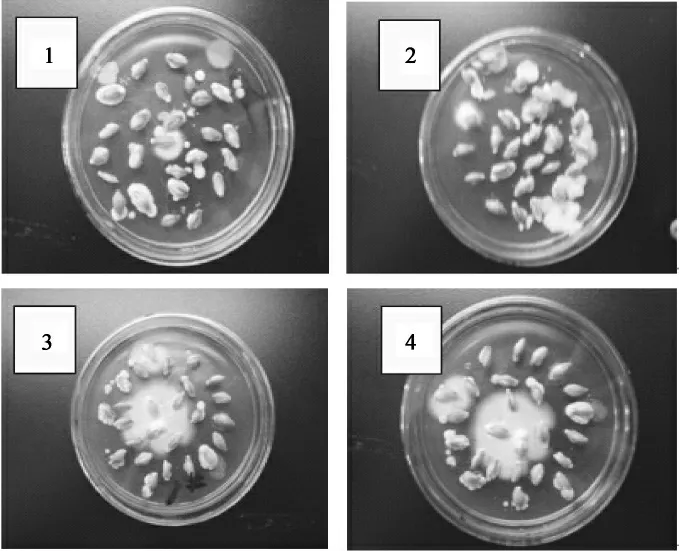
图1 菌种筛选结果Fig.1 The results of screening strains from barley
(2)平板分离
平板分离结果见图2。
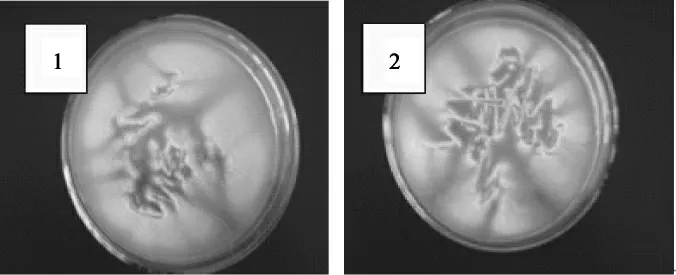
图2 平板分离结果Fig.2 The result of the flat-panel separation
(3)增殖培养
平板分离后的菌株经过增殖培养后出现菌落,见图3。
(4)纯种分离
经过二次平板分离、初筛、复筛等步骤,共筛选出2株优良菌株GQG28-1和GQG28-2,菌落形态见图4。

图3 菌株增殖培养结果Fig.3 The results of strains proliferation
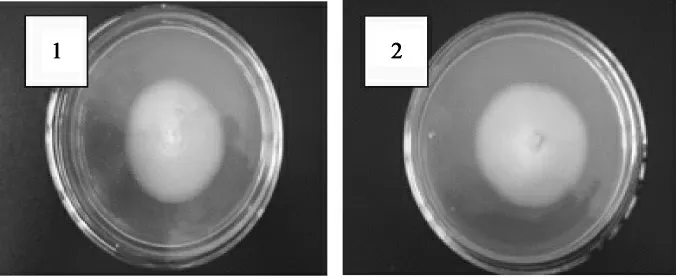
图4 纯种分离结果Fig.4 The result of primary isolation
2.1.2 产酶情况
测定培养第2d~8d的发酵液相关的酶活,结果见图5,最终筛选出GQG28-1、GQG28-2菌株水解酶活性见表1。
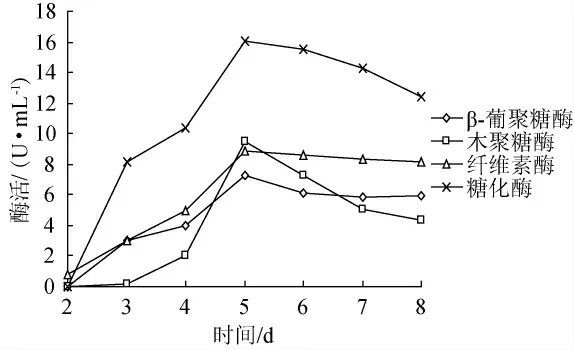
图5 GQG28产4种酶活性变化曲线Fig.5 Change curves of activity of four kinds of enzyme produced by GQG28

表1 GQG28 菌株4 种酶活性Table 1 Four enzyme activities of produced by GQG28(U/mL)
由图5可以看出,在培养第2d~7d时,β-葡聚糖酶、木聚糖酶、酶活随培养时间的延长而增大,在培养第5d时各酶活达到最大值,β-葡聚糖酶酶活为7.3U/mL,木聚糖酶酶活为9.5U/mL,纤维素酶酶活为8.8 U/mL,糖化酶酶活为16.0,之后酶活呈下降趋势。
2.1.3 菌种鉴定及保藏
(1)细胞形态
对筛选得到的2株菌种GQG28-1和GQG28-2细胞形态观察,见图6。

图6 GQG28-1(左,100×)和GQG28-2(右,100×)显微照片Fig.6 The micrographs of GQG28-1 (left,100×)and GQG28-2(right,100×)
由图6可观察到,分离所得菌株的菌落形态,GQG28-1:菌丝宽4.5μm~5.5μm,裂殖,节孢子单个、成双或成链,椭圆或圆形,分枝及曲弯少,圆头;GQG28-2:细胞分布均匀,菌丝宽4.5μm~6.9μm,裂殖,椭圆或圆形,分枝及曲弯少,圆头,有横膈膜,节孢子单个或连接成链。
(2)菌落特征
筛选得到的2株菌种GQG28-1和GQG28-2菌落特征见图7。

图7 GQG28-1(左)和GQG28-2(右)的菌落形态Fig.7 The colony morphology of GQG28-1 (left) and GQG28-2 (right)
由图7观察可知,GQG28-1:菌落直径为62mm,菌落呈白色、绒毛状、扁平、均匀,放射线中心有突起;GQG28-2:菌落直径为59mm,菌落呈白色、绒毛状、扁平、均匀,放射线中心有突起。
(3)糖类同化
糖类同化测定结果见表2。
(4)醇类同化
醇类同化结果见表3。
(5)氮源同化
氮源同化结果见表4。
由表5可知,菌株GQG28-1、GQG28-2均不能分解杨梅苷、均能分解脂肪。
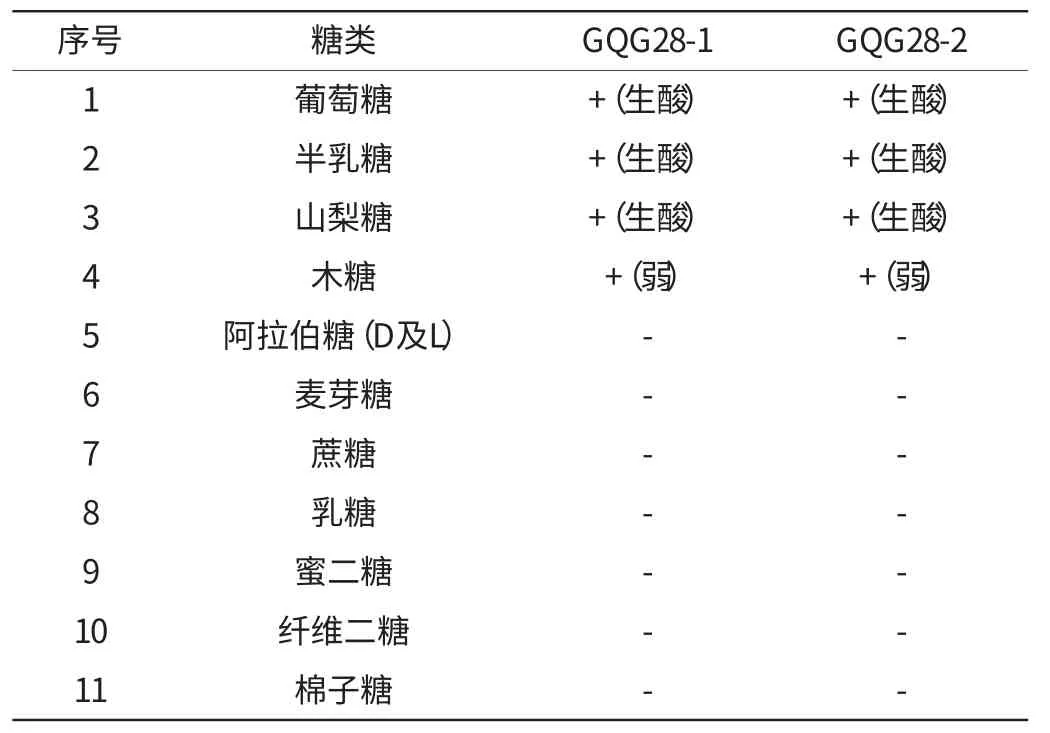
表2 糖类同化结果Table 2 The results of sugars assimilation
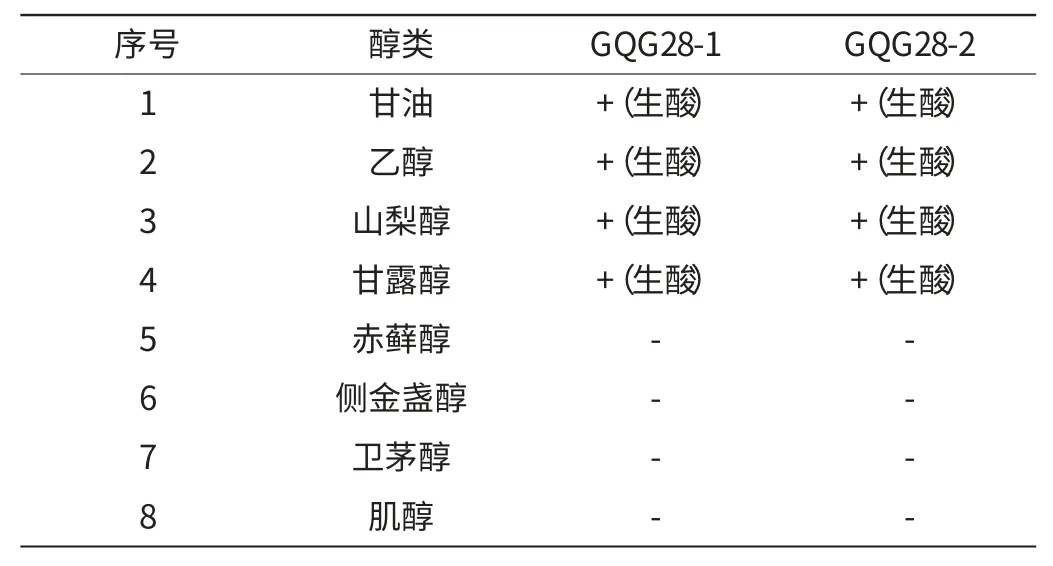
表3 同化醇类结果Table 3 The results of alcohols assimilation

表4 同化氮源结果Table 4 The results of nitrogen assimilation

表5 其它生理试验结果汇总表Table 5 Summary of other physiological properties
根据《真菌鉴定手册》综合以上鉴定结果可以鉴定得出从甘啤3号大麦中筛选分离得到的2菌株是白地霉,分别为白地霉GQG28-1和白地霉GQG28-2。
2.1.4 生长特性的研究
(1)最适生长温度
白地霉GQG28的生长温度曲线见图8。

图8 温度对白地霉GQG28生长的影响Fig.8 The effects on temperature on growth of Geotrichum candidum Link GQG28
由图8可以看出,随生长温度的升高OD值增大,于25℃时达到最大值,故白地霉GQG28的最适生长温度为25℃,在15℃~35℃温度范围内生长良好。
(2)最低和最高生长温度
分别于4℃~10℃的低温和32℃~38℃的高温下恒温振荡培养8d,考察菌体生长情况,试验结果见表6。
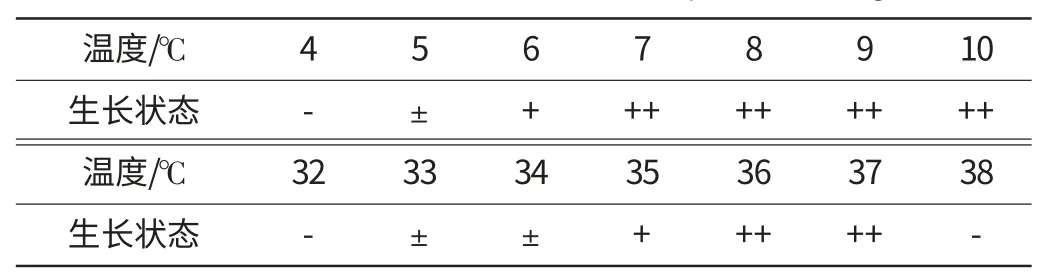
表6 最低和最高生长温度Table 6 The minimum and maximum temperature for growth
由表6可见,白地霉GQG28的最低生长温度为5℃;最高生长温度为37℃。
(3)最适生长pH值
根据试验数据做出白地霉GQG28的生长pH曲线图,见图9。

图9 pH值对白地霉GQG28生长的影响Fig.9 The effect of pH value on growth of Geotrichum candidum Link GQG28
由图9可以看出,白地霉GQG28生长适宜pH值范围较宽,为4.4~6.8,其最适生长pH值为5.6。pH值低于4.4或高于6.8对其生长影响明显。
(4)最低和最高生长pH值
将白地霉GQG28种子液分别接入pH从1~11的麦芽汁液体培养基中,于25℃培养8d,观察有无菌生长。该酵母菌在1.4~2.0的低pH值和9~10的高pH值麦芽汁中的生长情况见表7。

表7 最低和最高生长pH 值Table 7 The minimum and maximum pH value for growth
由表7可以看出,GQG28在麦芽汁中的最低生长pH值为3.2,最高生长pH值为11.0。故该菌种的生长pH值范围较宽,并对酸性环境有较强的耐受性。
(5)生长曲线的绘制
将酵母菌Kloeckerasp.4-18种子液以2%接入pH 5.4的麦芽汁液体培养基中,于26℃、150r/min振荡恒温培养,每隔2h用血球计数板计数法测定麦芽汁中的总菌数。根据实验数据做出该菌种的生长曲线图,见图10。

图10 白地霉GQG28的生长曲线Fig.10 The growth curve of Geotrichum candidum Link GQG28
由图10可以看出,该菌株在前2h内细胞数量增长不明显,但细胞体积明显增大,属于接种迟滞期;当培养到2h~14h时,视野内单个存在的细胞较多,细胞数以几何级数增长,这一阶段属于对数生长期;培养到14h后菌量达到稳定(约为7.8×108个/mL),并在14h~40h内总菌数基本保持恒定,这一阶段为恒定期。
2.1.5 白地霉制麦应用
将分离筛选出的白地霉GQG28菌株添加到制麦过程中,在最优制麦条件下所制备的麦芽综合指标为206.15,所制麦芽糖化力为308.5WK、α-氨基酸态氮为186mg/100g、浸出物相对质量分数为87.1%,均高于QB/T1686-2008[14]行业标准,与GB 2761-2011:食品安全国家标准[15]相比均未检出真菌毒素,本研究利用白地霉制麦可以得到品质较高的大麦产品。
3 结论
3.1 从甘啤3号大麦中分离筛选出白地霉菌株,对白地霉所产生的4种主要水解酶进行动态测定及分析,筛选出2株产酶活性较高的白地霉菌株GQG28-1、GQG28-2。
3.2 对筛选得到的白地霉菌株的生长性能进行研究,得到白地霉GQG28-1、GQG28-2的最适生长温度是25℃、最适生长范围是5℃~37℃、最适生长pH值为5.6、最适生长pH值范围是3.2~11。
3.3 利用筛选的白地霉制得麦芽综合指标为206.15,所制麦芽糖化力为308.5WK、α-氨基酸态氮为186mg/100g、浸出物相对质量分数为87.1%,均高于QB/T1686-2008[14]行业标准,有效提高了麦芽的综合品质。
[1]酿酒工业协会啤酒分会.2006年中国酿酒工业协会啤酒分会工作报告[R].2007,11.
[2]BOIVIN P,MALANDA M,DUMOULIN M.Improving the quality of malting barley by employing microbial starter cultures in the field[J].J Inst Brewing,1999,105(3):145-147.
[3]龙 杰,孙军勇,陆 健.微生物对麦芽品质的影响[J].啤酒科技,2007(1):87-89.
[4]MICHAL P,DANUTA W,REGINA S.Geotrichum hydrolytic activity in milled malt and barley medium[J].J Biotechnol,2005,8(1):15-19.
[5]贺小贤,陈 合,齐香君,等.黑曲霉β-葡聚糖酶菌株诱变选育研究[J].食品科技,2005(11):13-16.
[6]彭林才,陈元彩,付时雨,等.黑曲霉液体发酵产木聚糖酶条件的研究[J].造纸科学与技术,2008,27(3):81-84.
[7]QB 2583-2003.纤维素酶制剂:羧甲基纤维素钠(还原糖法)酶活力(CMCA-DNS)测定方法[S].
[8]孙淑琴,邵冬梅.比色法快速测定糖化酶活力新方法[J].河北省科学院学报,1997(2):35-39.
[9]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[10]吕红线,郭利美.工业微生物菌种的保藏方法[J].山东轻工业学院学报,2007,21(1):52-55.
[11]李瑛婕,宋希强,李绍鹏,等.美花石斛优势内生菌根真菌生物学特性研究[J].中国园艺文摘,2010(8):17-19.
[12]许美玲,朱教君,许爱华,等.不同培养基、pH值、水势和温度对2种外生菌根真菌生长的影响[J].辽宁林业科技,2007(5):20-22.
[13]谢建华,庞 杰,何 佳,等.杨梅汁中酿酒酵母的分离、鉴定及生长特性的研究[J].中国农学通报,2011,27(14):64-68.
[14]QB/Tl686-2008中华人民共和国轻工行业标准:啤酒麦芽[S].
[15]GB2761-2011:食品安全国家标准-食品中真菌毒素限量[S].
